Алгоритм исследований при ревматоидном артрите
Для ревматоидного артрита характерны эрозивно-деструктивные изменения в суставах и большой спектр внесуставных проявлений. Клинически он проявляется суставным синдромом: припухлостью, болезненностью, ограничением подвижности, впоследствии — нарушением функции суставов, скованностью в них по утрам.
Какие лабораторные методы применяются при ревматоидном артрите?
Суставной синдром встречается при многих ревматических заболеваниях. Это усложняет диагностику, особенно на ранних стадиях артрита. Поэтому больным часто требуется обширное обследование для того, чтобы установить диагноз. Из лабораторных методов для этого применяются:
- Анализ на ревматоидный фактор.
- Тест на АЦЦП.
- Общий анализ крови.
- Биохимия крови.
- Исследование синовиальной жидкости.
Количественный и качественный анализ на РФ
При ревматоидном артрите синовия вырабатывает измененные иммуноглобулины G. Организм не распознает их и считает чужеродными. Иммунная система в ответ на появление антигенов синтезирует ревматоидные факторы — иммуноглобулины М, А, G. Для диагностики самыми важными из них являются IgM. Они обнаруживаются у 70-85% пациентов.
Существуют разные лабораторные методики для выявления ревматоидного фактора:
- Латексная агглютинация — качественный анализ, с помощью которого определяют отсутствие или наличие РФ (концентрация не указывается). Он недорогой, быстро проводится, но нечувствительный и неспецифичный. Нормальный результат при латекс-тесте — минус (-).
- Нефелометрия, иммунотурбидиметрия — количественные методы определения IgM. Норма — до 15 МЕ/мл. При ревматоидном артрите титры повышаются до 40 МЕ/мл и более. Недостаток этих методов заключается в том, что их результаты бывают ложноположительными у 2-3% здоровых лиц, у пожилых людей эта цифра достигает 15%.
- ИФА — количественный анализ. Он широко распространен, так как признан самым точным и надежным. Кроме IgM методом иммуноферментного анализа можно определить иммуноглобулины А, Е, G. Они составляют до 10% белка, называемого ревмофактором. Концентрация IgG повышается при васкулите, IgA — при тяжелом и быстропрогрессирующем течении болезни. Норма для IgM — меньше 14 МЕ/мл, для IgA — меньше 20 МЕ/мл.
Определение иммуноглобулинов разных классов повышает специфичность исследования. Одновременное выявление IgM и IgA убедительно говорит о наличии ревматоидного артрита.
РФ бывает повышенным у здоровых людей и лиц с другой ревматической патологией (СКВ, синдром Шегрена, слеродермия), хроническими болезнями почек, легких, печени, злокачественными новообразованиями.
Если в крови больных выявляется классический РФ (IgM), то ревматоидный артрит считают серопозитивным, если не выявляется — серонегативным.
Тест на АЦЦП
Цитруллин — заменимая аминокислота. Она образуется в ходе биохимических процессов из незаменимой аминокислоты аргинина. По невыясненной причине при ревматоидном артрите иммунная система вырабатывает к ней антитела — преимущественно иммуноглобулины G.
Тест на антитела к циклическому цитруллинированному пептиду имеет высокую чувствительность (71%) и специфичность (до 99%). При ревматоидном артрите он используется с целями:
- ранней диагностики. Антитела появляются в крови больных, в среднем, за полтора года до возникновения первых симптомов;
- выявления серонегативных форм болезни;
- дифференциальной диагностики с другими ревматическими заболеваниями;
- прогнозирования темпов деструкции суставов (чем выше уровень АЦЦП, тем больше они повреждены).
Для определения антител к ЦЦП применяются стандартные методы:
- ИФА;
- полуколичественный иммунохроматографический экспресс-метод;
- хемилюминисцентный и электрохемилюминисцентный анализ.
Если АЦЦП в крови не обнаруживаются, то результат теста считают отрицательным, если их содержание равняется 3 ЕД/мл и меньше — слабо позитивным, больше 3 ЕД/мл — высоко позитивным.
Общий анализ крови
При артрите в нем появляются маркеры воспаления — повышение СОЭ (больше 10 мм/час у мужчин, 15 — у женщин), лейкоцитоз (более 10 х 10^9/л). Это неспецифические показатели, которые изменяются при любом воспалительном процессе. Но ускорение СОЭ свыше 40 мм/час может говорить об обострении ревматоидного артрита или его прогностически неблагоприятном течении.
При особом варианте болезни — синдроме Фелти — поражается селезенка. В ОАК при этом наблюдается нейтропения (число нейтрофилов меньше 48%) и тромбоцитопения (количество тромбоцитов меньше 180 х 10^9/л).
При ревматоидном артрите существенно возрастает уровень и активность противовоспалительных цитокинов. Они влияют на метаболизм железа, продолжительность жизни эритроцитов, их продукцию костным мозгом. В крови появляется картина анемии. Чаще всего она гипохромная и микроцитарная. Для нее характерны:
- снижение гемоглобина (у женщин ниже 120, мужчин — 130 г/л);
- уменьшение MCV (среднего объема эритроцита) — менее 80 fl;
- уменьшение цветового показателя (меньше 0,85);
- реактивный тромбоцитоз — число тромбоцитов больше 320 х 10^9/л.
Анемию может усугублять применение лекарств. Некоторые базисные препараты при длительном применении оказывают токсическое действие на клетки крови. Так, метотрексат довольно часто вызывает мегалобластную анемию, препараты золота и сульфасалазин — апластическую. Выраженная анемия может быть противопоказанием для проведения плазмафереза при ревматоидном артрите.
Биохимия крови
При обострении артрита в биохимическом анализе повышается уровень:
- фибриногена (> 4 г/л);
- сиаловых кислот (> 2,36 ммоль/л);
- гаптоглобина (> 3,03 г/л);
- церулоплазмина (> 60 мг/дл);
- C-реактивного белка (> 5 мг/л);
- гамма-глобулинов (> 15%);
- компонентов системы комплемента.
Увеличение и снижение этих показателей коррелирует с активностью заболевания и является индикатором эффективности лечения.
Изменения в биохимии появляются при осложнениях ревматоидного артрита. Например, при вторичном амилоидозе нарушается функция почек и в крови увеличивается содержание креатинина, уменьшается скорость клубочковой фильтрации. Одновременно в моче повышается содержание белка.
На биохимические показатели могут влиять используемые для лечения препараты. Повышение печеночных трансфераз (АЛТ, АСТ) может говорить об их гепатотоксичности.
Анализ синовиальной жидкости

В полости сустава находится жидкость (около 2 мл), которая обеспечивает беспрепятственное скольжение суставных поверхностей костей, а также выполняет другие функции: метаболическую, трофическую, барьерную.
В норме синовиальная жидкость вязкая, прозрачная, имеет соломенно-желтую окраску, содержит небольшое количество клеток — до 200/мкл (гистиоцитов, синовиоцитов, лейкоцитов) и общего белка (10-20 г/л).
При ревматоидном артрите в суставе скапливается выпот объемом 3-25 мл и больше. Он мутный, имеет желтый или зеленый цвет, после смешивания с уксусной кислотой образует рыхлый по структуре муциновый сгусток, содержит много клеток — до 30-50 тысяч/1 мкл.
Характерный признак ревматоидного артрита — появление в суставном выпоте рагоцитов. Это особые «ячеистые»клетки, у которых в цитоплазму включены иммунные комплексы.
При биохимическом исследовании в выпоте обнаруживаются С-реактивный белок и
ревматоидный фактор, которых быть не должно, а также повышение общего белка до 60 г/л.
Микроскопический анализ синовиальной жидкости позволяет отдифференцировать инфекционные артриты, при которых в нативных препаратах выявляются хламидии, гонококки, грамположительные кокки, грибки. Наличие в ней кристаллов говорит о подагрической природе воспаления.
Результаты анализов при ревматоидном артрите должны трактоваться в комплексе с данными клиники, инструментальных методов. Их правильная интерпретация важна для ранней диагностики заболевания. По лабораторным показателям судят об эффективности назначенной терапии, оценивают прогноз заболевания.
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
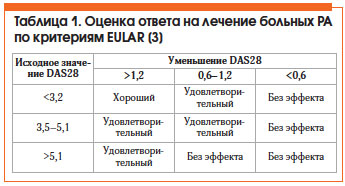
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
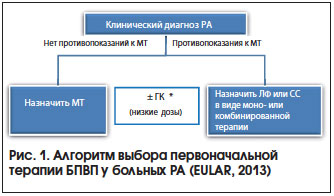
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
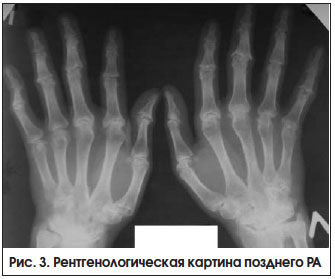
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
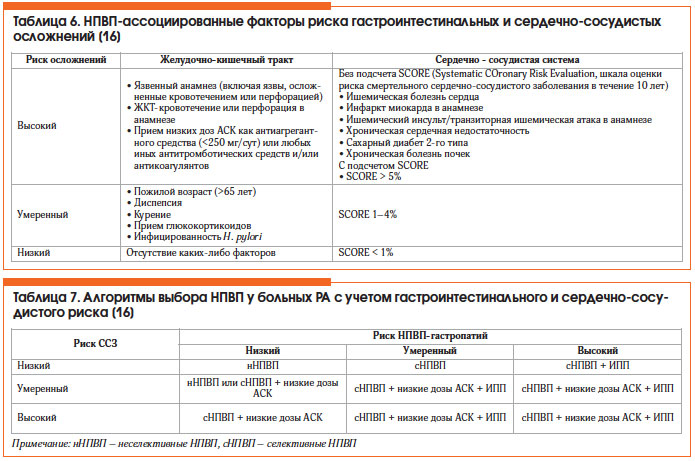
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник