Анализы иммунологические при артрите
Ревматоидный артрит – сложно диагностируемое заболевание, в рамках диагностики которого назначают множество анализов для определения формы болезни. В статье подробно расписаны все самые эффективные анализы.
Что такое ревматоидный артрит?
Ревматоидный артрит – заболевание, которое по симптомам долгое время способно вводить в заблуждение. Подробно о болезни уже писалось в этой статье. Аутоиммунный характер болезни провоцирует поражение всё новых областей суставных механизмов, тканей и органов. Таким образом, больной в начальной стадии болезни сталкивается со следующими признаками:
- Дискомфортные ощущения в суставах, в том числе при пальпации.
- Затруднение подвижности после долгого нахождения в одной позе.
- Появление подкожных шишек.
- Отёчность и покраснение суставных фаланг кистей рук.
- Наблюдение симметричного развития воспаления в мелких суставах кистей и стоп.
- Быстрая утомляемость, апатия, снижение веса.
Ревматоидный артрит — патология, которая сопровождается дискомфортными ощущениями с суставах
Протекание заболевания заключается в постепенном изменении белковой структуры под воздействием патогенных факторов. Это приводит к образованию аутоиммунных антител, убивающих здоровые клетки и разрушающие синовиальную оболочку сустава. В конечном итоге происходит избыточная пролиферация синовиоцитов, хрящевые и костные ткани поражаются, и сустав подвергается деформации.
Для точного диагностирования заболевания необходимо провести дифференциальные исследования биологических материалов пациента. Различают лабораторную и инструментальную методики выявления факторов заболевания.
О лабораторной диагностике и анализах
Для выявления ревматоидного типа артрита берут анализы специфического и неспецифического характера:
- Специфические — дают однозначное подтверждение или опровергают факт заболевания с высокой достоверностью.
- Неспецифические – работают только в совокупной расшифровке с остальными данными обследования, так как выявляют лишь отдельные признаки.
Анализы проводят специфического и неспецифического характера
Определить, какие при ревматоидном артрите нужно сдать анализы, должен лечащий врач. План обследования пациента включает прохождение ёмкого диагностического комплекса мероприятий:
- биохимия крови, её клиническое исследование, определение АЦЦП (антицитруллиновых тел), иммунологический анализ;
- общий анализ мочи;
- анализ внутрисуставной жидкости;
- биоптата оболочки сустава.
Может понадобиться сдача мочи на анализ
Специфические показатели способны выдать ревматоидный артрит ещё до проявления первых сигналов о заболевании. Пациенты с наследственной предрасположенностью могут использовать этот способ для предупреждения болезни, её перехода в хроническую стадию.
Правила взятия анализов
Установление точного диагноза при ревматоидном артрите суставов основывается на грамотной расшифровке клинических результатов и профессиональном умении интерпретировать их в комплексе. Чтобы получить достоверные показатели, необходима специальная подготовка перед сдачей крови. Направление на лабораторные исследования должен выписывать один из лечащих специалистов: врач общей терапии, ревматолог, хирург или иммунолог. Для полного исследования показателей нужно сдать кровь из вены, соблюдая для этого условия:
- Не принимать пищу за 12 часов до взятия анализа (детям до года – за полчаса, от 1 до 5 лет – за 3 часа).
- Не употреблять алкогольные напитки в течение суток.
- Прекратить приём медикаментов за сутки с разрешения врача.
- Не допускать физической нагрузки и нервных стрессов за час до анализа.
- Запрещается курить минимум за 30 минут перед анализом.
К сдаче анализов необходимо правильно подготовиться
Нарушение диеты, употребление лекарственных препаратов или курение искажают клинические данные состава крови и вводят в заблуждение при интерпретации результатов.
Общий анализ крови и мочи
Стартовый набор на выявление воспалительного процесса в организме – общий анализ крови и мочи пациента. Данные анализы определяют также характер возникновения симптомов (инфекция, аутоиммунное заболевание). Так, общий анализ определяет следующие патологические изменения показателей крови у больного человека:
- Рост скорости оседания эритроцитов (СОЭ) – от 25 мм/ч при норме 2–15 мм/ч.
- Снижение гемоглобина — у женщин до 120 г/л и мужчин до 135 г/л.
- Количественный рост лейкоцитов – выше 9000 при норме 4000–9000.
Анализы помогут выявить патологические изменения в организме
Обострение ревматоидного артрита сопровождается лейкоцитозом и тромбоцитозом умеренной степени тяжести, нормоцитарной нормохромной анемией. Иногда происходит хроническая кровопотеря через желудочно-кишечный тракт и, как следствие, недостаток железа и анемия.
Анализ мочи даёт неспецифические сведения и определяет только повышение содержания белка и уровень лейкоцитов, что лишь подтверждает присутствие факторов воспаления.
Скорость оседания эритроцитов
Оседание эритроцитов изучается в пробирке на протяжении определённого времени. Показатель характеризует интенсивность развития патологии, активность распространения разрушительных процессов. Высокие показатели СОЭ указывают на прогрессирование заболевания и необходимость в принятии эффективных медикаментозных мер. При этом, чем выше скорость оседания, тем активнее фаза. Этот процесс объясняется образованием в крови больного воспалительных белков, которые являются причиной соединения эритроцитов в агрегаты, увеличения силы тяжести и скорости их оседания.
Скорость оседания эритроцитов указывает на воспалительный процесс в организме
Биохимический анализ крови
Биохимия крови на ревматоидный артрит для анализа состояния тканей суставов играет решающую роль. Несмотря на признание метода неспецифическим, его показатели определяют:
- Развитие ревматоидных признаков в соединительных тканях суставах.
- Протекание воспалительного процесса.
- Активность аутоиммунного заболевания.
Биохимический анализ крови позволит узнать множество важных данных
Биохимия крови включает следующие данные:
- Присутствие гаптоглобина – характерно для острой фазы. Его норма составляет 0,8-2,7 г/л.
- Активность фибриногена в плазме – норма 2–4 г/л. Увеличение свидетельствует об активности аутоиммунного характера.
- Уровень пептидов, γ — глобулинов, криоглобулинов (IgM, IgG, IgA).
- Действие серомукоидов – сывороточных белков крови. Норма составляет 1,2–1,6 ммоль/л.
- Уровень сиаловых кислот – превышение нормы в 2-2,33 ммоль/л указывает на разрушительные процессы коллагена в клетках даже на стадии прогнозирования болезни.
- С – реактивный белок — норма 0-5 мг/л у здорового человека.
Рост фибриногена в крови выше 4 г/л означает повышение свёртываемости крови, что характерно при ревматоидном артрите. Высокий уровень этого показателя является сигналом о риске образования тромбов и ишемических изменениях в органах.
С реактивный белок
С — реактивный белок отвечает за способность организма проявлять реакцию в ответ на процессы воспаления и повреждения в организме. Поэтому изменение в крови данного маркера доказывает протекание острой фазы заболевания. Установить степень и точное место поражения организма с его помощью невозможно, но при ревматоидном артрите уровень С — реактивного белка превышает 400 мг/л. При этом наблюдается прямая пропорциональность роста показателя к тяжести протекания болезни.
Маркеры гепатитов
Ревматоидный артрит может вызывать развитие гепатита В или С
Развитая форма ревматоидного артрита может в дальнейшем вызывать гепатит В или С. Это обусловлено поражением печени ввиду ослабления иммунитета на фоне медикаментозного лечения. С другой стороны, перекрёстные симптомы заболеваний, какие проявляются при артрите и гепатите, иногда становятся причиной ложного диагноза артрита.
Формы гепатита имеют свойство проявляться в системном патологическом процессе аутоиммунной природы. В результате прохождения больного гепатитом курса терапии, признаки артрита исчезают. Для исключения развития гепатита пациента направляют на анализ крови на серологию, который определяет наличие маркеров заболевания.
Ревматоидный фактор
Перед официальным подтверждением диагноза ревматоидный артрит и выбора схемы терапии, специалист должен сначала определить разновидность патологии. В медицине существует два вида данного заболевания, природа развития которых различна по степени тяжести протекания:
- Серопозитивный – тяжёлая форма, поддающаяся только агрессивному терапевтическому лечению.
- Серонегативный — классический вариант тяжести.
Заболевание может протекать в двух формах
Классифицировать тот или иной случай воспаления болезни можно с помощью выявления присутствия ревматоидного фактора – иммунных белков, участвующих в процессах соединительной ткани. Их уровень и будет влиять на категорию тяжести заболевания:
- Менее 25 МЕ/мл – серонегативная форма.
- Выше 59 МЕ/мл – серопозитивная форма.
Повышенный уровень ревматоидного фактора также может свидетельствовать об иных патологиях организма (гельминтозы, опухоли, гепатиты, васкулиты) или проявиться у пациентов пожилого возраста.
Более того, данный маркер может отсутствовать при первичной диагностике серонегативной формы и обнаружить себя лишь на поздних этапах.
Антицитруллиновые тела
Антитела к циклическому цитруллинированному пептиду (АЦЦП) представляют собой вырабатываемые в результате протекания аутоиммунных процессов элементы. При ревматоидном артрите эти маркеры образуются в виде антител к клеткам собственных тканей и работают на их уничтожение, что вызывает разрушение суставной капсулы.
Обнаружение в составе крови АЦЦП с вероятностью до 95% означает достоверность диагноза. Нормальный показатель здоровых соединительных тканей составляет до 3 ед/мл. Патология вызывает рост тел в количестве от 58 до 87 ед/мл. Степень дегенеративного процесса в тканях суставов напрямую связана с величиной показателя.
В диагностической практике анализ на АЦЦП доказал свою эффективность выявления антител даже на этапе зарождения симптомов ревматоидного артрита: маркер проявляет себя почти за один год до первичных симптомов клинической картины заболевания. Единственный недостаток метода – отсутствие реакции на динамику протекания болезни.
Антинуклеарные тела
Также при лабораторном методе могут применить проверку на антинуклеарные тела. Фактором их проявления чаще является диагноз системной красной волчанки. Положительный результат у пациентов с артритом встречается в 10% случаев. Исключение ряда заболеваний, когда неясна природа воспаления, помогает сузить круг в конкретном перечне.
Расшифровка данных
Вынести окончательный диагноз непросто. Иногда о ревматоидном артрите пациенты узнают спустя 5-7 лет, когда лечение уже малоэффективно и болезнь стала хронической. Поэтому расшифровка полученных анализов крови при артрите требует точности, понимания общей картины заболевания и взаимосвязи различных данных.
Ревматоидный артрит и степень его развития характеризуют по уровню отклонения показателей от нормы. Чем больше разница в показателях – тем тяжелее форма заболевания. Клиническое подтверждение у пациента 4 любых маркеров на протяжении 6 месяцев является медицинским освидетельствованием диагноза ревматоидный артрит.
Повышенные показатели у ребёнка
Даже у самых маленьких детей может быть обнаружены патологии ревматического характера. Симптомы проявляются в скрытой форме, а в силу неосознанности ребёнку сложнее объяснить, что его беспокоит. Жалобы на боли в ножках, ручках и коленках или просто постоянный плач могут быть первыми сигналами развития болезни. Такое заболевание, как ювенильный ревматоидный артрит имеет хроническую природу проявления и развивается у детей до 16 лет.
Патология может быть обнаружена даже у маленьких детей
При диагностическом обследовании для уточнения диагноза проводят:
- Анализ крови на выявление инфекционных вирусов: бета-гемолитического стрептококка, цитомегаловируса, вируса герпетического типа, хламидий.
- Забор на исследование бактерий кишечной группы (иерсиний, шигелл, сальмонелл) и паразитов.
- Электрокардиограмму.
- УЗИ органов брюшной полости, сердца, почек.
- Рентген суставов, грудины, крестцово-подвздошных сочленений и позвоночника.
Помимо общего дифференциального обследования всем детям с заболеваниями суставов показано посещение врача окулиста и осмотр щелевой лампой.
Биопсия синовиальной оболочки сустава
Ревматоидная разновидность артрита сопровождается воспалением синовиальной оболочки сустава. Исследования материалов данной области позволяет точнее расшифровывать стадии патогенеза заболевания и вырабатывать более прогрессивные методы лечения.
Иммуногистохимические особенности синовиальной оболочки отлично характеризуют показатели активности болезни, а применение в лабораторных целях биомаркеров помогает выявить новые потенциально эффективные средства в борьбе с ревматоидным артритом. Важным количественным показателем здесь является содержание макрофагов в субсиновиальном слое, характеризующее, насколько болезнь поддаётся лечению.
Источник
ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
- Авторы
- Резюме
- Файлы
- Ключевые слова
Пачкунова М.В.
У 80 больных ревматоидным артритом исследовано относительное и абсолютное содержание лимфоцитарных рецепторов CD3+, CD4+, CD8+, CD19+ крови, используя иммуноцитохимический субпопуляционный анализ лимфоцитов и уровень интерферона гамма сыворотки крови методом твердофазного иммунноферментного анализа. Проанализированы взаимосвязи между Т-,В-лимфоцитами и уровнем интерферона гамма крови. Определено состояние лимфоцитарных рецепторов и интерферона гамма крови в зависимости от степени активности ревматоидного артрита.
ревматоидный артрит
CD-рецепторы
интерферон гамма
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
В группе больных РА по сравнению с группой контроля определено достоверное снижение относительного содержания CD19+ (22,51±0,53 % и 24,63±1,0 % соответственно, р<0,05) без изменения их абсолютной численности (0,49±0,03*109 /л и 049±0,04*109 /л соответственно, р>0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
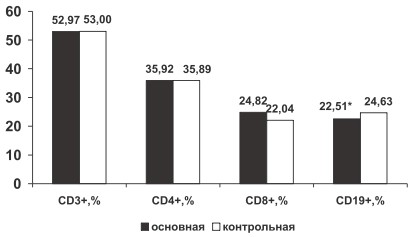
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р<0,05)
У больных РА по сравнению с группой здоровых лиц определена тенденция к росту абсолютного содержания молекулярных рецепторов лимфоцитов крови CD3+, CD4+, CD8+ (р>0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р<0,05).
Было исследовано состояние CD3+, CD4+, CD8+, CD19+ и IFNγ крови у больных РА в зависимости от активности воспалительного процесса. Относительное содержание изучаемых молекулярных рецепторов (р>0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
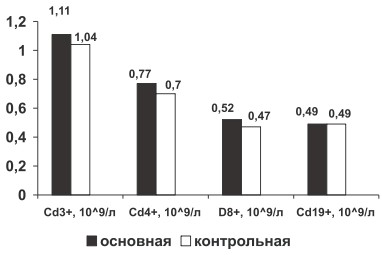
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Показатель | 1 группа здоровые n =25 | Степень активности | ||
2 группа 1 степень n =5 | 3 группа 2 степень n= 36 | 4 группа 3 степень n= 39 | ||
1 | 2 | 3 | 4 | 5 |
CD3 +,% | 53,0±0,99 | 55,4±2,58 р(2,1) >0,05 | 52,81±0,8 р(3,1) >0,05 р(3,2) >0,05 | 52,77±0,86 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD4 +,% | 35,89±1,23 | 35,2±1,93 р(2,1) >0,05 | 35,47±0,61 р(3,1) >0,05 р(3,2) >0,05 | 36,42±0,8 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD8 +,% | 23,74±0,95 | 23,6±2,58 р(2,1) >0,05 | 24,84±0,51 р(3,1) >0,05 р(3,2) >0,05 | 24,97±0,66 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD19 +,% | 24,63±1,0 | 21,8±2,17 р (2,1) >0,05 | 22,31±0,78 р (3,1) >0,05 р (3,2) >0,05 | 22,77±0,8 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
ИРИ CD4+%/ CD8+% | 1,54±0,07 | 1,55±0,19 р (2,1) >0,05 | 1,44±0,03 р (3,1) >0,05 р (3,2) >0,05 | 1,48±0,05 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD3 +,109/л | 1,04±0,09 | 1,06±0,18 р (2,1) >0,05 | 1,23±0,11 р (3,1) >0,05 р (3,2) >0,05 | 1,02±0,09 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD4 +,109/л | 0,7±0,06 | 0,66±0,1 р (2,1) >0,05 | 0,85±0,08 р (3,1) >0,05 р (3,2) >0,05 | 0,7±0,06 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD8 +, 109/л | 0,47±0,05 | 0,4±0,09 р (2,1) >0,05 | 0,57±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,49±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD19 +,109/л | 0,49±0,04 | 0,41±0,07 р (2,1) >0,05 | 0,53±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,46±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
IFNγ, пг/мл | 73,89±6,55 | 139,33±23,04 р (2,1) <0,05 | 191,58±31,03 р (3,1) <0,05 р (3,2) <0,05 | 319,53±68,46 р (4,1) <0,05 р (4,2) <0,05 р (4,3) <0,05 |
Примечания: р ‒ уровень значимости различия групп с соответствующими номерами, n ‒ количество обследованных
При 3-й степени активности РА по сравнению со 2-й степенью, несмотря на нарастание тяжести заболевания, наблюдается тенденция к снижению CD3+, CD4+, CD8+, CD19+ и нарастанию ИРИ, что, вероятно, свидетельствует о срыве компенсаторных реакций и нарастании иммунодефицита (р>0,05).
При всех степенях активности РА по сравнению с нормой определено достоверное увеличение уровня IFNγ (p <0,05, таблица), что, вероятно, связано с воздействием этого существенного показателя аутоиммунизации на развитие и прогрессирование заболевания. У больных РА по мере повышения степени активности РА выявлено закономерное увеличение содержания IFNγ крови (p<0,05, таблица). Мы считаем, что это связано с нарастанием процессов иммунного воспаления по мере усиления активности РА.
При проведении корреляционного анализа нами обнаружена прямая взаимосвязь между активностью воспаления у больных РА, с одной стороны, и IFNγ, с другой,
(r= 0,27, p<0,05). Не выявлены корреляционные взаимосвязи между активностью воспаления при РА и относительным и абсолютным содержанием изучаемых молекулярных рецепторов (р>0,05). Мы считаем, что динамика клеточных субпопуляций лимфоцитов не отражает напрямую активности иммуновоспалительного процесса.
Был проведен корреляционный анализ между показателями лимфоцитарной и цитокиновой систем при РА. Выявлены прямые корреляционные связи между относительным содержанием CD3+%, с одной стороны, и относительным содержанием CD4+% (r=0,56, p<0,0001), CD8+% (r=0,38, p<0,01), с другой, как и между CD4+%, с одной стороны, и CD8+% (r=0,31, p<0,03) и ИРИ (r=0,37, p<0,01), с другой. Определена обратная сильная корреляция между CD8+%, с одной стороны, и ИРИ (r= -0,75, p<0,001), с другой. Определена умеренная обратная корреляционная связь между ИРИ, с одной стороны, и CD19+% (r= -0,32, p<0,03), с другой, что свидетельствует об увеличении миграции В-лимфоцитов в очаг воспаления при снижении относительного содержания цитотоксических лимфоцитов в периферической крови. Выявлены высокодостоверные прямые корреляционные связи между абсолютным содержанием изучаемых молекулярных рецепторов: CD3+, с одной стороны, и CD4+, CD8+, CD19+ (r=0,9, p<0,0001), с другой, как и между CD4+ с одной стороны, и CD8+, CD19+ (r= 0,9, p<0,0001) с другой, и между CD8+, с одной стороны и CD19+ (r=0,9, p<0,0001), с другой. Таким образом, обнаруженная выраженная зависимость между лимфоцитарными рецепторами свидетельствует об имеющемся взаимном влиянии Т- и В- лимфоцитов. Т-хелперы посредством когнатной помощи и путем выработки IFNγ влияют на дифференцировку В-лимфоцитов в плазматические клетки, антителопродукцию, способствуют созреванию цитотоксических лимфоцитов, активируют макрофаги. В-лимфоциты способны презентировать антигены Т-клеткам, активировать аутореактивные CD4+, CD8+ лимфоциты, продуцировать провоспалительные цитокины. CD8+ лимфоциты осуществляют основной клеточный механизм иммунорегуляции, оказывая ингибирующее влияние на Т-хелперы как путем контактных взаимодействий, так и через выделение гуморальных факторов. Выявлена умеренная прямая корреляционная связь между абсолютным содержанием CD19+с, одной стороны, и IFNγ крови (r= 0,36, p<0,01), с другой, что объясняется усилением дифференцировки В-лимфоцитов, их превращением в плазматические клетки с последующим синтезом антител под действием IFNγ.
Выводы
Таким образом, у больных РА имеет место активация лимфоцитарной системы, сопровождающаяся миграцией В-лимфоцитов из периферической крови в очаг воспаления и нарушением функции цитотоксических лимфоцитов. При 3-й степени активности заболевания по сравнению со 2-й, определена тенденция к снижению абсолютного содержания лимфоцитарных рецепторов, вероятно, вследствие нарастания иммунодефицита. Выявлено взаимное прямое влияние между Т- и В-лимфоцитами у больных РА. Миграция В-лимфоцитов из периферической крови в очаг воспаления увеличивается при снижении относительного содержания CD8+ крови. Увеличение уровня IFNγ крови приводит к увеличению содержания в крови абсолютного содержания В-лимфоцитов.
Достоверное повышение уровня IFNγ в сыворотке крови больных РА по сравнению с контрольной группой является, вероятно, признаком дисрегуляции с избыточными иммунными реакциями и последующим нарушением функции клеток общевоспалительного назначения. Концентрация IFNγ достоверно связана с активностью воспалительного процесса. Определение уровня IFNγ может быть использовано в качестве информативного критерия для определения степени активности РА с последующей перспективой применения антител к IFNγ.
Список литературы
- Лукина Г.В. Перспективы антицитокиновой терапии ревматоидного артрита // Вестник Российской академии медицинских наук. ‒ 2003. ‒ №.7. ‒ С.23-27.
- Насонова В.А., Лукина Г.В., Сигидин Я.А. Нейтрализация ИФ-γ ‒ новое направление в терапии ревматоидного артрита // Терапевтический архив. ‒ 2008. ‒ Т. 80, №. 5. ‒ С. 30-37.
- Олюнин Ю.А., Балабанова Р.М. Комбинированная иммуномодулирующая терапия ревматоидного артрита // Терапевтический архив. ‒ 1996. ‒ Т.68, №5. ‒ С. 13-16.
- Порядин П.В., Казимирский А.Н. Иммунная система и воспаление // Сборник трудов 5-го конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». ‒ Т.1. ‒ М., 2002. ‒ С. 269-280.
- Ревматология, национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. ‒ М.: ГЭОТАР-Медиа, 2008. ‒ 714 с.
- Сучков С.В., Хитров А.М., Наумова Т.Е. и др. Современная модель патогенеза ревматоидного артрита и её место в клинической практике // Терапевтический архив. ‒ 2004. ‒ Т. 76, № 12. ‒ С. 83-87.
- Bank I., Coheu L., Monallem M. T cell subsets in patients with arthritis and chronic neutropenia // Ann Rheum Dis. ‒ 2002. ‒ Vol.61, №5. ‒ Р. 438-443.
- Dolhain R.J., ter Haar N.T., Hoefakker S. Increased expression of interferon (IFN)-gamma together with IFN-gamma receptor in the rheumatoid synovial membrane comparedwith synovium of patients with osteoarthritis // Br J Rheumatol. ‒ 1996. ‒ Vol. 35, № 1. ‒ Р. 24-32.
- Klimiuk P.A., Sierakowski S., Latosiewicz R et al. Mistological patterns of synovitis and serum chemokines in patients with rheumatoid arthritis // J Rheumatol. ‒ 2005. ‒ Vol. 32, №9. ‒ P. 1666-1672.
Рецензент:
Кратнов Андрей Евгеньевич, д.м.н., профессор, зав. кафедрой терапии педиатрического факультета Ярославской государственной медицинской академии.
Библиографическая ссылка
Пачкунова М.В. ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Фундаментальные исследования. – 2011. – № 1. – С. 148-156;
URL: https://fundamental-research.ru/ru/article/view?id=15821 (дата обращения: 24.01.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
