Антитела к нативной днк ревматоидный артрит
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Сабирзянова А.З.
1
Невзорова Т.А.
1
1 ГОУ ВПО «Казанский (Приволжский) федеральный университет», Казань, Россия
В работе показано, что положительно заряженные низкоаффинные и высокоаффинные антитела класса IgG к нативной ДНК (IgG-АТ к нДНК) доноров и больных системной красной волчанкой (СКВ) на стадии обострения заболевания оказывают сходное генотоксическое воздействие на лимфоциты здоровых лиц in vitro. АТ к ДНК больных СКВ на стадии обострения, обладающие ДНК-гидролизующей активностью, проявляют более выраженную генотоксичность в культуре лимфоцитов. Обнаружено, что спектр генотоксичных субфракций в сыворотке крови больных ревматоидным артритом шире, чем в норме и при СКВ, и представлен высокоаффинными IgG-АТ к нДНК. В статье обсуждаются возможные причины генерации патологических АТ класса IgG к нДНК и их биологическая роль в организме.
антитела к ДНК
лимфоциты
системная красная волчанка
ревматоидный артрит
генотоксичность
1 Акберова Н.И. Сравнение данных. II Непараметрические критерии значимости : методическое пособие. — Казань : Издательство КГУ, 2004. — 50 с.
2. Анисимов А.Г. Обработка синхронизированных клеток К562 тетрафторалюминатом не модулирует флуоресценцию бромистого этидия и 4,6-диамидино-2-фенилиндола при связывании с нуклеоидной ДНК / А.Г. Анисимов, И.А. Болотников // Цитология — 1999. — Т. 41. — № 8. — С. 680-684.
3. Арлеевская М.И. Диагностические и прогностические маркеры ревматоидного артрита с точки зрения патофизиолога / М.И. Арлеевская, А.Г. Габдулхакова, А. Цибулькин. — Казань : Шип, 2010. — 128 с.
4. Невзорова Т.А. Происхождение и биологическая роль аутоантител к ДНК / Т.А. Невзорова, В.Г. Винтер // Учен. зап. Казан. ун-та. Сер. Естеств. науки. — 2006. — Т. 148. — Кн. 3. — С. 35-52.
5. Сабирзянова А.З. Влияние антител класса IgG к нативной ДНК на моноциты человека in vitro / А.З. Сабирзянова, Т.А. Невзорова // Учен. зап. Казан. ун-та. Сер. Естеств. науки. — 2008. — Т. 150. — Кн. 2. — С. 186-200.
6. Ardoin S.P. Developments in the scientific understanding of lupus / S.P. Ardoin, D.S. Pisetsky // Arthritis Research & Therapy. — 2008. — Vol. 10. — № 5. — Р. 218-225.
7. Gabibov A.G. Catalytic autoantibodies in clinical autoimmunity and modern medicine // Autoimmun Rev. — 2006. — Vol. 5. — № 5. — Р. 324-330.
8. Kubota T. Enhancement of oxidative cleavage of DNA by the binding sites of two anti-double-stranded DNA antibodies // J. Biol. Chem. — 1996. — Vol. 271. — № 11. — P. 6555-6561.
9. Rivadeneyra-Espinoza L. Cell-penetrating anti-native DNA antibodies trigger apoptosis through both the neglect and programmed pathways / L. Rivadeneyra-Espinoza, A. Ruiz-Argüelles // J Autoimmun. — 2006. — Vol. 26. — № 1. — Р. 52-56.
10. Yang R. Autpreactive murine Th1 and Th2 cells kill syngeneic macrophages and induce autoantibodies // Lupus. — 2001. — Vol. 10. — P. 539-541.
Лимфоциты — основные клетки иммунной системы, обеспечивающие гуморальный иммунитет и регулирующие взаимодействие и функционирование клеток в сложном многоклеточном организме в процессе иммунного ответа.
Нарушение функциональной активности Т- и В-лимфоцитов отражается в развитии разнообразных форм иммунонедостаточности.
Системная красная волчанка (СКВ) и ревматоидный артрит (РА) — это хронические аутоиммунные заболевания (АИЗ) с неясной этиологией и обширной картиной иммунопатогенеза, снижают качество и продолжительность жизни населения, поэтому входят в число важных биомедицинских и социальных проблем современности [4; 3].
Для больных СКВ характерно повышение уровня IgG-АТ к нДНК, которые обладают ДНК-гидролизующей активностью [4; 5] и, вероятно, являются участниками патологического процесса. Но на сегодняшний день среди исследователей нет единого мнения о вкладе АТ к нДНК в развитие и течение АИЗ.
При РА также наблюдается повышение уровня ДНК-гидролизующих АТ, но клинические признаки отличаются от СКВ [3; 7]. Следовательно, течение патологического процесса может определяться не только уровнем АТ к ДНК, но и их свойствами, различающимися при разнообразных АИЗ.
Исследования последних лет показали, что некоторые АТ к ДНК проникают внутрь клеток и влияют на внутриклеточные процессы [9].
Можно высказать предположение, что IgG-АТ к нДНК, взаимодействуя с ДНК клеток и изменяя структуру хроматина, приводят к нарушению апоптоза иммунокомпетентных клеток, следствием чего является увеличение апоптотического материала и времени его циркуляции в кровотоке, что наблюдается при СКВ и усугубляет течение аутоиммунного процесса.
Целью работы явилось исследование генотоксичности антител класса IgG к нативной ДНК в первичной культуре лимфоцитов здоровых лиц.
Материалы и методы исследования
Выделение IgG-АТ к нДНК из сыворотки крови человека
Все этапы очистки выделения и очистки IgG-АТ к нДНК из сывороток доноров и больных СКВ и РА проводили по ранее разработанной методике [4]. В работе использовали АТ к ДНК сывороток крови лиц женского пола — 20 сывороток здоровых доноров, 7 сывороток больных СКВ и 20 сывороток больных РА в период обострения заболевания, полученные в медицинских учреждениях г. Казани. Диагноз СКВ и РА был поставлен квалифицированными ревматологами ГОУ ДПО «Казанская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Выделение лимфоцитов из цельной крови здоровых лиц проводили по стандартной методике на фиколл-верографине — плотность 1.077 мг/мл [10].
Культивирование лимфоцитов в присутствии IgG-АТ к нДНК
К клеткам (2•104 клеток/лунку), разведенным полной средой RPMI-1640 рН 7.4 (Gibco, Scotland), содержащей 10% инактивированной эмбриональной бычьей сыворотки, 2 мМ глутамина («Serva», Germany), 100 ед/мл пенициллина (Россия), 100 мкг/мл стрептомицина (Россия), добавляли очищенные субфракции IgG-АТ к нДНК до конечной концентрации 1 мкг/мл. Каждый опыт повторяли трижды. Клетки инкубировали при 37 ºС, 0.5% СО2 в течение 72 часов.
Общее количество и количество жизнеспособных лимфоцитов после выделения из цельной крови и инкубации с субфракциями IgG-АТ к нДНК определяли методом исключения трипанового синего.
Определение уровня повреждения ядерной ДНК клеток после культивирования с субфракциями IgG-АТ к нДНК проводили методом флуоресцентной спектрофотометрии по изменению интенсивности флуоресценции комплекса ЭБ-ДНК хроматина лимфоцитов [2].
Определение уровня повреждения ядерной ДНК методом гель-электрофореза лизированных единичных клеток — «ДНК-комет»
Использовали 1%-ный раствор легкоплавкой агарозы («Fermentas», Canada) в ФСБ. На предметное стекло, покрытое полилизином («ApexLab», Россия), наносили 60 мкл агарозного геля с клетками (2•104 — 5•104), равномерно распределяли и оставляли на 30 минут при +20 °С.Лизис клеток (10 мM Tris-HCl pH 10, 2.5 M NaCl, 100 мM EDTA-Na2, 1% Triton X-100, 5% DMSO, +4 °С) проводили в течение 1 часа. Затем стекла переносили в электрофорезный буфер (300 мM NaOH, 1 мM EDTA-Na2, pH>13, +4 °С) и оставляли на 20 минут. Электрофорез проводили 20 минут при 1 В/см и 300 мА. По окончании препараты переносили в раствор для фиксации (70%-ный этиловый спирт) на 15 минут, после чего высушивали при +20 °С (1-2 часа). В качестве положительного контроля для визуализации деградации ДНК использовали клетки, инкубированные в течение 5 минут при -20 °С в присутствии 100 мкМ Н2О2. Препараты окрашивали акридиновым оранжевым (20 мкг/мл) в течение 30 минут и анализировали на флуоресцентном микроскопе (AxioScope A1, «Сarl Zeiss», Germany) с соответствующими фильтрами (возбуждающий фильтр 490 нм, дихроичное зеркало 510, отсекающий фильтр 530 нм), увеличение 40х.
Статистическая обработка данных
Из полученных данных изменения жизнеспособности и интенсивности флуоресценции ЭБ-ДНК клеток вычисляли медиану, 97,5 и 2,5 перцентили, используя стандартный пакет программ Excel Office 2003, дополнительно использовали критерий Даннета [1].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Повышение уровня ДНК-гидролизующих АТ наблюдается при СКВ и РА, но клиническая картина заболеваний отличается [4; 7]. Предположительно, IgG-АТ к нДНК являются индукторами и участниками воспалительного процесса при АИЗ, но что определяет их патогенетический потенциал и каким образом он реализуется в организме, до конца не выяснено.
Поэтому для более глубокого понимания роли АТ к нДНК в индукции и течении аутоиммунного синдрома была оценена зависимость генотоксичности IgG-АТ к нДНК от их физико-химических и иммуно-химических свойств.
Из каждой сыворотки было получено по 4 субфракции свободных от иммунных комплексов IgG-АТ к нДНК, различающихся зарядом (фракции I, характеризующиеся общим положительным зарядом, и фракции II с общим отрицательным зарядом) и аффинностью к нДНК — субфракции а, элюированные с нДНК-целлюлозы буфером, содержащим 1М NaCl, и субфракции б, элюированные с сорбента буфером Gly-HCl с рН 2.3, что позволяет сделать предположение об их большей аффинности к антигену.
Показано, что в присутствии положительно заряженных IgG-АТ к нДНК доноров снижается общее количество и количество жизнеспособных лимфоцитов по сравнению с контролем (ФСБ) (рис 1). IgG-АТ к нДНК больных СКВ на стадии обострения заболевания оказывают сходное с АТ доноров влияние на лимфоциты здоровых лиц, но их воздействие более выражено, что, вероятно, связано с их высокой ДНК-гидролизующей активностью.
Отсутствие у доноров клинических признаков заболевания при аналогичном воздействии на клетки IgG-АТ к нДНК доноров и больных СКВ на стадии обострения заболевания объясняется тем, что уровень IgG-АТ к нДНК в крови здоровых людей значительно ниже, чем у больных СКВ. Кроме того, большая часть IgG-АТ к нДНК в крови здоровых лиц находится в составе иммунных комплексов с антиидиотипическими АТ [4] или отрицательно заряженными биополимерами сходной с ДНК конформации.
В процессе выделения IgG-АТ к нДНК из сывороток происходит разрушение иммунных комплексов АТ-ДНК с образованием свободных АТ к нДНК, а в опытах на лимфоцитах мы использовали равные концентрации всех исследуемых АТ, получив таким образом возможность наблюдать потенциальный негативный эффект на клетки in vitro АТ доноров.
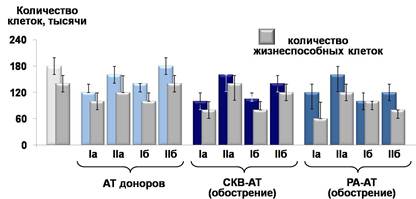
Рис. 1. Изменение общего количества и количества жизнеспособных лимфоцитов здоровых лиц после 72 часов инкубации при 37 °С в присутствии субфракций IgG-АТ к нДНК:
Iа — положительно заряженные низкоаффинные IgG-АТ к нДНК;
IIа — отрицательно заряженные низкоаффинные IgG-АТ к нДНК;
Iб — положительно заряженные высокоаффинные IgG-АТ к нДНК;
IIб — отрицательно заряженные высокоаффинные IgG-АТ к нДНК.
Вероятно, патологические СКВ-АТ к нДНК могут происходить от естественных АТ, выполняющих в организме защитные функции, но вопрос о причинах подобного аномального переключения остается открытым.
Впервые показано, что спектр цитотоксичных субфракций IgG-АТ к нДНК в сыворотках крови больных РА отличается от нормы и СКВ. Наряду с положительно заряженными низкоаффинными АТ к ДНК, характерными для доноров и больных СКВ, высокоаффинные положительно и отрицательно заряженные субфракции IgG-АТ к нДНК больных РА приводят к заметному снижению пролиферации и количества жизнеспособных лимфоцитов здоровых лиц in vitro.
Изменение конденсации хроматина лимфоцитов после воздействия субфракций IgG-АТ к нДНК было исследовано методом флуоресцентной спектрофотометрии. Образование разрывов в ДНК приводит к декомпактизации хроматина, увеличению мест связывания ЭБ с нуклеиновой кислотой и усилению флуоресценции комплекса ЭБ-ДНК [2].
Дополнительно генотоксичность IgG-АТ к нДНК была оценена методом «ДНК-комет». При наличии разрывов в ДНК нарушается структурная организация хроматина и утрачивается сверхспирализация, что приводит к релаксации молекул. В электрическом поле релаксированные петли и фрагменты ДНК вытягиваются по направлению к аноду, что и придает наблюдаемым объектам вид «комет». По длине и структуре «хвоста комет» можно судить о степени деградации ДНК клеток.
Повышение интенсивности флуоресценции комплекса ЭБ-ДНК в образцах, инкубированных с положительно заряженными IgG-АТ к нДНК (Iа, Iб) доноров, свидетельствует об изменении структуры ДНК хроматина клеток — снятии суперспирализации и возможном образовании разрывов (таблица 1). На типичных микрофотографиях объектов после инкубации клеток с положительно заряженными IgG-АТ к нДНК обнаружено образование «хвостов комет» (рис 2В), что не наблюдается в отрицательном контроле ФСБ (рис. 2А) и является отражением генотоксичности АТ к ДНК. Вероятно, некоторые ДНК-связывающие АТ доноров, проникая в клетки, могут достигать ядра, связываться с ДНК и изменять ее конформацию. Например, показано, что АТ в сайте связывания с ДНК значительно усиливают её разрушение гидроксил-радикалами [8]. Вероятно, АТ к нДНК способствуют окислительному разрушению нДНК, изменяя её структуру, делая доступным для гидроксил-радикалов сайты рестрикции.
Таблица 1 — Изменение уровня флуоресценции ЭБ-ДНК хроматина лимфоцитов после 72 часов инкубации при 37 °С с субфракциями IgG-АТ к нДНК
Субфракции IgG-АТ к нДНК | Интенсивность флуоресценции комплекса ЭБ-ДНК, единиц/клетку | |||
Доноры | СКВ | РА | Контроль (ФСБ) | |
Положительно заряженные низкоаффинные | 7.85 (6.75; 8.32) | 9.52 (9.27; 11.06) | 8.51 (8.40; 8.91) | 6.67 (5.75; 6.85) |
Отрицательно заряженные низкоаффинные | 5.56 (5.04; 6.80) | 6.95 (6.49; 7.12) | 5.98 (5.53; 6.19) | |
Положительно заряженные высокоаффинные | 9.10 (8.94; 9.15) | 9.82 (9.25; 9.94) | 9.52 (9.24; 9.64) | |
Отрицательно заряженные высокоаффинные | 6.40 (5.64; 7.07) | 6.64 (6.46; 7.67) | 7.60 (6.96; 9.33) | |
Негативное воздействие на структуру ДНК хроматина лимфоцитов положительно заряженных субфракциями IgG-АТ к нДНК (Iа, Iб) больных СКВ на стадии обострения заболевания более выражено по сравнению с АТ доноров, что отражается в резком повышении флуоресценции комплекса ЭБ-ДНК. На типичной микрофотографии «ДНК-комет» отмечено образование широкого диффузного «хвоста кометы» (рис. 2Г), что является свидетельством высокой степени деградации ДНК лимфоцитов под воздействием АТ к ДНК больных СКВ. Генотоксичность IgG-АТ к нДНК больных СКВ в период обострения заболевания сравнима с действием перекиси водорода, использованной в данном эксперименте в качестве положительного контроля (рис. 2Б). Предположительно, наряду с ДНК-связывающими, ДНК-гидролизующие СКВ-АТ [5] в клетках, достигая ядра, сами могут выступать в качестве биокатализаторов гидролиза фосфодиэфирных связей ДНК и таким образом проявлять генотоксичность.
Рис. 2. Микрофотографии «ДНК-комет» после 72 часов инкубации при 37 °С лимфоцитов здоровых лиц с субфрациями IgG-АТ к нДНК:
А — отрицательный контроль (ФСБ); Б — положительный контроль (Н2О2);
В — типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК доноров;
Г — типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК больных СКВ;
Д- типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа, Iб и IIб IgG-АТ к нДНК больных РА.
На основании полученных результатов можно заключить, что для АТ доноров и СКВ-АТ при воздействии на клетки in vitro большее значение имеет заряд молекул IgG-АТ к нДНК, нежели аффинность их к антигену.
Обнаружено, что при РА спектр генотоксичных субфракций шире, чем в норме и при СКВ — повышение флуоресценции комплекса ЭБ-ДНК хроматина клеток наблюдается после инкубации лимфоцитов с положительно заряженными низкоаффинными субфракциями (Iа), а также высокоаффинными субфракциями IgG-АТ к нДНК больных РА в период обострения заболевания, как положительно, так и отрицательно заряженными (Iб, IIб). При воздействии данных субфракций IgG-АТ к нДНК на клетки после электрофореза наблюдается формирование широких диффузных «хвостов комет» (рис. 2Д), свидетельствующее об образовании разрывов в ДНК лимфоцитов, что является следствием высокой генотоксичности АТ к ДНК при РА. На основании полученных результатов можно заключить, что при РА патогенетический потенциал IgG-АТ к нДНК определяется не зарядом молекулы, а аффинностью АТ к антигену — нативной ДНК. Это позволяет выдвинуть предположение об исходно иной природе формирования патологических IgG-АТ к нДНК при РА.
Вероятно, аномальное повышение уровня в крови естественных АТ к ДНК в определенных условиях способно привести к повреждению клеток иммунной системы, изменению их функциональной активности и экспрессии генов, что может отразиться нарушением иммунного статуса и индукцией аутоиммунного синдрома за счет интенсификации апоптоза здоровых клеток и накопления модифицированных В-лимфоцитов, продуцирующих патологические IgG-АТ к нДНК. Таким образом, IgG-АТ к нДНК являются одним из ключевых звеньев иммунной системы, отражают изменение иммунного статуса и принимают участие в сохранении гомеостаза в многоклеточном организме.
Рецензенты:
- Чиков В.И., д.б.н., профессор, Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, г. Казань.
- Габдрахманова Л.А., д.б.н., с.н.с., начальник Учебного управления ФГБОУ ВПО «Казанский государственный энергетический университет», г. Казань.
Работа получена 03.10.2011
/p
Библиографическая ссылка
Сабирзянова А.З., Невзорова Т.А. АНТИТЕЛА К ДНК СЫВОРОТОК КРОВИ БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ И РЕВМАТОИДНЫМ АРТРИТОМ ПРОЯВЛЯЮТ ГЕНОТОКСИЧНОСТЬ В ПЕРВИЧНОЙ КУЛЬТУРЕ ЛИМФОЦИТОВ ЗДОРОВЫХ ЛИЦ // Современные проблемы науки и образования. – 2011. – № 5.;
URL: https://science-education.ru/ru/article/view?id=4811 (дата обращения: 12.01.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Anti-dsDNA (антиДНК) или антитела двухцепочечной ДНК относятся к неоднородной группе антител против ДНК двухспиральной, а также являются лабораторными маркерами СКВ (системная красная волчанка).
Аутоантителами против ДНК, которые расположены внутри ядра, называют антитела к двуспиральной ДНК. Точной причины их появления в крови установлено не было.
Что такое антитела?
Иммунной системой человека производятся антитела, так называемые специальные белки, борющиеся с различными паразитами, вирусами, грибками, бактериями, то есть с инородными элементами на генетическом уровне. В задачу любых антител входит уничтожать инородный материал и не трогать клетки родные, что называется механизмом аутотолерантности.
Бывают случаи, когда ответ иммунной системы направляется против собственных тканей и клеток, а не инородных. Тогда имеет место развитие аутоиммунной болезни, а антитела, вырабатываемые против своих же клеток и их компонентов, специалисты называют аутоиммунными.
Если случается серьезная «поломка» иммунитета, повышается уровень аутоантител, чего становится вполне достаточно для постановки пациенту диагноза.
Антитела к двуспиральной ДНК – это не одно антитело, а целый их комплекс, мишенью которого является ДНК ядра клетки.
Анализ на антитела является высокочувствительным при диагностике СКВ, то есть, при положительном результате можно говорить о подтверждении диагноза. В 70-80% случаев больные выявляются именно этим анализом. Однако в связи с недостаточной чувствительностью исследования требуется большая осторожность при чтении результатов анализа, поскольку, если результат отрицателен, то далеко не факт, что у пациента нет СКВ.
Данные анализы чаще всего назначаются ревматологом. Но может быть выписано направление и терапевтом, и нефрологом, и дерматологом. Все будет зависеть от того, к какому специалисту обратился пациент изначально. Иммунологическая лаборатория — это то место, где проводят исследование на антитела. Специальная подготовка к анализу не нужна.
СКВ — системная красная волчанка
СКВ является тяжелым аутоиммунным заболеванием, поражающем одновременно несколько систем и органов (системы головного мозга, кожи, почек, суставов, сосудов и сердца). Одновременное присутствие симптомов у всех органов не обязательно. Проявления волчанки достаточно разнообразны: у одного человека будут преобладать кожные симптомы, у другого, например, – почечные.
Антитела к нативной двуспиральной ДНК помогут выявить данное заболевание.
Факторы риска развития системной красной волчанки
- Изменения гормонального фона (роды, беременность, менструации), которые вызывают пролактин и эстроген, чем объясняется большая частота, 90%, заболеваний, среди женского населения.
- Предрасположенность на генетическом уровне, которую подтверждает наличие у родственников пациентов, больных СКВ низкого уровня некоторых антигенов системы HLA и аутоантител.
- Лекарственные средства – «Метилдопа», «Прокаинамид», «Гидралазин».
- Вирусная инфекция, запускающая аутоиммунные процессы.
- Солнечное облучение (ультрафиолетовые лучи приводят клетки кожи к апоптозу, оголяют ДНК, и она становится видима иммунной системе).
Анализ антител к двуспиральной ДНК очень информативен.
Симптоматика СКВ

Общими признаками проявления можно назвать увеличение лимфоузлов, усталость и слабость, повышение температуры тела, снижение веса, боль в суставах и мышцах.
- Люпус нефрит или поражение почек (функции почек снижены и присутствует триада лабораторных симптомов).
- Артралгия и артрит, вызывающие воспаления и болезненные ощущения в суставах запястий, кистей, рентгеновский снимок которых покажет снижение плотности кости вокруг сустава (периартикулярный остеопороз), однако эрозий не будет.
- Серозит, то есть воспаление серозной оболочки легких и сердца (плеврит, перикардит).
- Фоточувствительность, вызывающая ухудшение симптомов после пребывания на солнце.
- Высыпания, в том числе и на лице, бабочкообразная сыпь. Антитела к двуспиральной ДНК будут обнаружены обязательно.
- Синдром нефритический — 45-65%.
- Микрогематурия — наличие 80% эритроцитов в осадке мочи.
- Протеинурия, связана с потерей белка вместе с мочой в объеме больше 0,5 г/с, то есть 100%.
- Очень редко появление в моче значительного количества лейкоцитов (пиурия), особенно в отсутствие инфекций мочевыводящих путей.
- На сетчатке образуются ватообразные очаги, также отекает сосочек зрительного нерва.
- Наличие острого люпус пневмонита, поражения легких, ассоциации кашля и лихорадки с пятнистым альвеолярным инфильтратом.
- Проявления нейропсихических состояний, начиная от депрессий и заканчивая эпилептиформными пароксизмами, психозами и нарушениями зрения.

При выявлении у пациента с СКВ антител к двуспиральной ДНК требуется повторный контроль через 1-3-6-12 месяцев. Это зависит от тяжести болезни. У этих пациентов повышается риск развития поражения почек, потому что комплексы антиДНК с комплексами иммунными ведут к повреждению почек.
Анализ на антиДНК
Это анализ необходим:
- Чтобы спрогнозировать успешность лечения.
- Когда подозревают наличествующее системное аутоиммунное заболевание.
- Когда результат ENA антител, исследования антител антинуклеарных положительный.
- Когда присутствуют симптомы СКВ.
- Когда подозревают наличие системной болезни, в особенности СКВ.
- Для дифференциальной диагностики суставного синдрома.
- Когда положителен результат анализа на антиядерные антитела.
- Для прогнозирования развития поражения почек.
- Для контроля протекания СКВ.
Что с человеком происходит, когда у него повышены антитела к двуспиральной ДНК?
Симптоматика для проведения определения антиДНК
- Увеличивается температура тела, лимфатические узлы, снижается вес, появляется усталость.
- При артрите, воспалении сустава, проявляемом отечностью, болью, повышением температуры на этом участке, покраснением кожи и нарушением подвижности.
- При появлении атипичных психических и неврологических симптомов.
- При плеврите или перикардите неясного происхождения.
- При синдроме Рейно, то есть периодическом изменении цвета пальцев кистей и стоп (покраснение, бледность, посинение), нарушением их чувствительности и болями.
- При заболеваниях почек, имеющих иммунный генез или изменениях результатов анализа мочи (гематурия, протеинурия).
- При кожных симптомах – утолщении кожи, сыпи, особенно после солнечных ванн.
- При гемолитической анемии, разрушении эритроцитов при повышении уровня билирубина в моче и крови.
- При нейтропении, сниженном количестве нейтрофилов в лейкоцитарной формуле.
- При тромбоцитопении, снижении числа тромбоцитов в крови.
Антитела к двуспиральной ДНК: норма
В норме результат анализа должен быть отрицателен, а концентрация 0-25 МЕ/мл.
Если результат положителен, можно говорить о: первичном билиарном циррозе; СКВ; инфекционном мононуклеозе; эффективности лечения (СКВ в стадии ремиссии); хроническом гепатите С и В; синдроме Шегрена; смешанном заболевании соединительной ткани.
ДНК двуспиральная и антитела (IgG и IgM иммуноглобулины) образуют иммунный комплекс. Он и обуславливает определенную симптоматику, характерную для СКВ.
Если результат отрицателен, говорят о лекарственной волчанке или об отсутствии СКВ.
Что влияет на результат анализа?
- Высокие показатели антиДНК ассоциируются с люпус нефритом, обострением заболевания или отсутствием контроля за болезнью.
- Низкие показатели антиДНК ассоциируются с эффективностью проводимой терапии и достижением стадии ремиссии заболевания.
- АнтиДНК является специфическим показателем СКВ, но может наблюдаться также и при других болезнях (аутоиммунных, хроническом гепатите С и В).
- Если антиДНК отсутствует, это не исключает диагноз СКВ.
- Обнаружение антиДНК у больного без каких-либо симптомов и прочих критериев этой болезни не трактуют в пользу постановки диагноза СКВ.
Важные замечания
Анализ крови на антитела к двуспиральной ДНКпроводится вместе с нижеприведенными исследованиями:
- бета-2-микроглобулином;
- общим анализом крови;
- антицентромерными антителами;
- общим анализом мочи;
- антигистоновыми антителами;

- печеночными пробами (щелочная фосфатаза, билирубин, ГГТ, АСТ, АЛТ);
- ревмопробами (АСЛО, С-реактивный белок, ревматоидный фактор, скорость оседания эритроцитов);
- антителами к цитруллиновому пептиду (АЦЦП);
- антинуклеарными антителами (ANA). Являются самыми хорошо изученными аутоантителами наряду с ревматоидным фактором. Были открыты в 1957 г., и одновременно исследователи доказали связь с СКВ. При этом антитела к двуспиральной ДНК повышены;
- anti-SSB и anti-SSA антителами;
- anti-SCL-70 антителами;
- anti-nRNP антителами;
- anti-Sm антителами;
- anti-sp100 антителами.
Два факта об антиДНК
Кроме того, антиДНК появляется в крови в связи со следующими причинами:
- миеломной болезни;
- СКВ, критерием диагноза которой является получение положительного результата исследования;
- правовирусной инфекции;
- лекарственно инуцированной СКВ;
- ВИЧ;
- синдроме Шегрена;
- цитомегаловирусной инфекции;
- синдроме Шарпа (смешанном заболевании соединительной ткани);
- инфекционном мононуклеозе;
- ревматоидном артрите;
- первичном билиарном циррозе;
- системной склеродермией;
- вирусном гепатите С;
- вирусном гепатите В.
Поэтому кровь на антитела к двуспиральной ДНК берут довольно часто.
Источник


