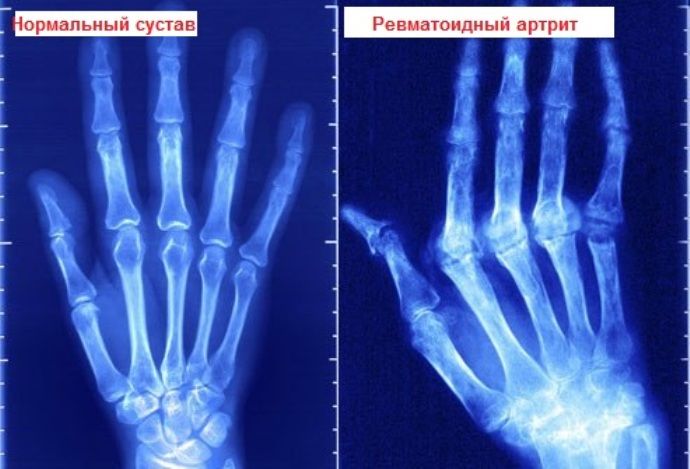
Атрофия мышц при артрите
Мышцы поражаются у большинства больных РА. Мышечная слабость и атрофия отмечаются не менее чем у 75% больных. Причиной этих симптомов служит уменьшение мышечной активности в связи с болью в суставах и особенно их контрактурами. Эта причина, однако, не может считаться единственной. Еще в 1873 г. J. Paget писал, что мышечная атрофия при РА пропорциональна не столько ограничению движений, сколько выраженности боли.
Спустя почти столетие J. De Andrade (1968) доказал в эксперименте, что атрофия мышц у животных с артритами выражена сильнее, чем вызванная иммобилизацией. О том же свидетельствуют частые клинические наблюдения, касающиеся быстро развивающейся амиотрофии при тяжелом РА. Темпы ее развития при этом более быстрые, чем при обычной иммобилизации, тем более что в подобных случаях общий объем движений часто остается немалым.
Поэтому основными причинами мышечной патологии у больных РА следует считать как ограничение мускульной активности, так и катаболическое влияние воспалительного процесса (возможно, опосредуемое эффектом интерлейкина-1 и фактором некроза опухоли, вырабатываемых макрофагами). Последнее может значительно усугубляться сопутствующей лихорадкой, частым ухудшением аппетита, нерациональным питанием (в частности, бедным белками).
Несомненно, что у ряда больных возникает и собственно ревматоидный миозит, имеющий, однако, в большинстве подобных случаев весьма малое клиническое значение. Для его диагностики определяющую роль играет сочетание мышечных самостоятельных болей (особенно в сочетании с болью при пальпации соответствующих мышц), нарастание в крови уровня «мышечных» ферментов (трансаминаз, альдолазы и особенно креатинфосфокиназы) и воспалительных изменений при гистологическом исследовании мышечных биоптатов.
Трактовка данных биопсий вне связи с клиническими и биохимическими показателями должна быть очень осторожной. Микроскопический анализ мышечной ткани нередко обнаруживает сосудистые изменения и клеточные инфильтраты, формально соответствующие представлениям о воспалении, у лиц без какой-либо мышечной патологии. Возможно, что речь идет о реакции на транзиторные физиологические сдвиги (большее накопление молочной кислоты и т. д.).
Не подтвердилось также мнение об относительной специфичности для РА так называемого узелкового полимиозита, представляющего собой узелковые клеточные инфильтраты диаметром 1—2 мм, обильно рассеянные в эндомизии и перимизии и состоящие из скоплений лимфоцитов и плазматических клеток, в редких случаях — тучных клеток, нейтрофилов и эозинофилов. L. Sokoloff и соавт. (1950) показали, что подобные изменения наблюдались у 56% больных РА, у 29% больных неревматическими заболеваниями и у 23% здоровых.
Повышение уровня мышечных ферментов в крови имеет большое значение для диагноза ревматоидного миозита. Однако необходимо принимать во внимание, что содержание этих ферментов у больных РА может повыситься также вследствие внутримышечных инъекций, мышечной биопсии, индивидуальных реакций на некоторые лекарства (хлорохин, ацетилсалициловая кислота, D-пеницилламин) и даже значительной физической нагрузки. В связи с этим диагностика ревматоидного миозита надежна лишь при сочетании клинических симптомов с ферментемией и гистологическими воспалительными изменениями или (что менее убедительно) при комбинировании двух компонентов этой триады.
Четко очерченный синдром миозита у больных РА редок. Относительно чаще он встречается при ревматоидном васкулите, однако и в этих случаях (при локализации васкулита в мышцах) его клиническое значение обычно невелико. Поэтому особый интерес вызывает наблюдение Г. Н. Жуковской (1987) больного классическим серопозитивным и эрозивным РА (без васкулита), у которого миозит в течение длительного времени настолько превалировал над суставными проявлениями, что правильный диагноз был поставлен более чем через год.
Необходимо иметь в виду, что заметная мышечная патология у больных РА в редких случаях может быть связана с влиянием некоторых лекарств. Так, глюкокортикостероиды (прежде всего содержащие фтор — триамцинолон, дексаметазон), особенно при их длительном назначении в больших дозах, вызывают у отдельных больных так называемую стероидную миопатию. Ее симптомы обычно развиваются постепенно и относятся преимущественно к проксимальным мышцам ног, а затем и рук (боли, быстрая утомляемость, затруднения при подъеме на лестницу и при вставании с низкого стула).
Эти симптомы нередко оцениваются как признаки обострения основного заболевания, что ведет к увеличению дозы стероидов и тем самым к усугублению миопатических проявлений. Уровень сывороточных мышечных ферментов при стероидной миопатии нормален. Ценный лабораторный признак — повышенное выделение креатина с мочой. При гистологическом исследовании мышц не обнаруживают достоверных воспалительных изменений; отмечаются лишь неспецифические дистрофические симптомы — потеря поперечной исчерченности, атрофия волокон и т. д. После уменьшения дозы гормональных препаратов и особенно полной отмены их признаки стероидной миопатии исчезают, чему способствует лечебная физкультура, направленная на упражнения для соответствующих мышц.
Назначение D-пеницилламина у некоторых больных может вызвать патологию мышц двух различных типов. Относительно чаще встречается синдром миастении (myasthenia gravis). Он проявляется в постепенном нарастании слабости различных мышечных групп с соответствующими функциональными нарушениями (слабость, утомляемость, диплопия, нарушения глотания и речи, птоз, затруднения при выполнении простых движений).
Повышения уровня мышечных ферментов в крови и гистологической картины миозита не наблюдается. У некоторых больных . определяются антитела к тканевым компонентам мышечных поперечных полос и к ацетилхолиновым рецепторам мышц (последнее обстоятельство может быть непосредственной причиной мышечной слабости). После отмены D-пеницилламина симптомы миастении постепенно исчезают; при недостаточном восстановлении мышечной силы назначают прозерин.
У единичных больных при назначении D-пеницилламина описано развитие истинного полимиозита с миалгиями, слабостью проксимальных мышц конечностей, нарастанием уровня мышечных ферментов и характерной гистологической картиной (инфильтрация лимфоцитами и макрофагами, участки дегенерации и регенерации мышечных волокон). Для лечения этого осложнения необходимо отменить D-пеницилламин, в серьезных случаях — назначить глюкокортикостероиды.
Хлорохиновая миопатия также представляет собой очень редкое лекарственное осложнение. Она характеризуется постепенно прогрессирующей слабостью проксимальных мышц ног, затем — рук, позже — более дистальных мышечных групп. Уровень мышечных ферментов в крови может быть повышен. Характерный гистологический признак — вакуолизация мышечных волокон. Отмена хлорохина приводит к полному, но медленному выздоровлению.
Назначение гидроксихлорохина (плаквенила) не вызывает миопатии. Таким образом, в основе изменений мышц при РА могут лежать принципиально различные причины: миозит, атрофия вследствие недостаточных упражнений, вызванные воспалительным процессом катаболические сдвиги в обмене веществ, недостаточное белковое питание и, наконец, редкие и сугубо индивидуальные (возможно, генетически обусловленные) реакции на определенные лекарственные препараты.
Поэтому в каждом конкретном случае явной мышечной патологии у больного РА необходим соответствующий клинический и анамнестический анализ с определением в крови уровня мышечных ферментов; по показаниям проводят биопсию наиболее пораженных отделов мышц.
Сигидин Я.А.
Опубликовал Константин Моканов
Источник
Сидячий образ жизни и отсутствие регулярных физических нагрузок могут вызвать слабость. Слабость возникает из-за неиспользования и может привести к атрофии мышц. Итак, что такое мышечная атрофия и что можно сделать, чтобы обратить ее вспять?
Атрофия мышц или истощение мышц
Мышечная атрофия — это потеря или уменьшение мышечной массы. Синонимами для этого являются истощение мышц, потеря мышечной массы, мышечный катаболизм, увядание мышц. Причиной мышечной атрофии является нехватка мышц или нарушение нервных сигналов в мышцу. Это замечено во многих условиях, особенно с кахексией в раке и ВИЧ / СПИД. Средство от мышечной атрофии — это использование мышц, наиболее легко с помощью упражнений и активности в обычной повседневной деятельности.
Нейрогенная мышечная атрофия
Когда нерв к мышце поврежден, он больше не может вызвать сокращение мышц, которое вызывает мышечную активность. Тело очень консервативно, а то, что не используется, перерабатывается. Без нервов, вызывающих сокращение мышц, организм считает, что мышцы больше не нужны, и он разрушает их, мышцы атрофируются. При нейрогенной мышечной атрофии мышцы должны быть искусственно тренированы с использованием функциональной электростимуляции, чтобы сохранить мышечную массу.
Disuse мышечной атрофии
Что касается мышц, это определенно «Используй это или потеряй». Если вы занимались спортом и были активны, мышцы будут расти в соответствии с потребностями. Но как только вы перестаете использовать мышцу, организм не хочет тратить энергию на ее питание и поддержание, поэтому он начинает разрушать и перерабатывать. Ваши мышцы уменьшаются как в размерах, так и в силе.
Средство против мышечной атрофии — использовать мышцы, сначала с нормальной физической активностью, вставая, двигаясь, поднимаясь и нося. Специальное упражнение также обратит мышечную атрофию и стимулирует рост мышц. Пока нервы не повреждены и мышцы хорошо питаются, мышцы могут расти снова. Подумайте о том, как бодибилдеры, такие как Арнольд Шварценеггер, проходят через крайние наращивания мышечной массы, но как только они перестают работать, их мышцы сокращаются до нормальных размеров.
В медицинской помощи очень важно поддерживать активность и подвижность пациентов, поскольку атрофия мышц возникает очень быстро, когда кто-то прикован к постели или конечность обездвижена. Если у вас когда-либо была нога в гипсе, вы знаете, как быстро вы потеряли мышечную массу. В некоторых случаях им приходится ставить новый гипс, потому что мышцы сократились настолько, что гипс потерял силу через пару недель. Когда вы находитесь в больнице, вас посещают физиотерапевты и специалисты по трудотерапии, чтобы ваши мышцы работали так, чтобы они не атрофировались.
Потеря мышечной массы при артрите
Рассматривая тип мышечной атрофии, которая может развиться из-за недостатка физической активности из-за болей в суставах и ограниченного диапазона движений, мы имеем в виду тип мышечной атрофии. Это своего рода порочный круг: боль от артрита ведет к снижению физической активности, что приводит к атрофии мышц. Но важно знать, что тип атрофии, вызванной бездействием, можно обратить с помощью упражнений.
Несколько заболеваний могут вызвать атрофию мышц. Это те, которые связаны с артритом:
- Dermatomyositis
- полимиозит
- Долгосрочная терапия кортикостероидами
- Долгосрочная иммобилизация
- остеоартрит
- Ревматоидный артрит
Если вы заметили, что у вас атрофия мышц, поговорите с врачом. Вам, вероятно, нужно будет разработать программу упражнений и придерживаться ее.
Источник
Поражение мышц при ревматоидном артрите является наиболее ранним и постоянным внесуставным симптомом, которое может быть как трофического, так и воспалительного характера. Особенно характерна для инфектартрита атрофия мышц, имеющих отношение к пораженным суставам. При тяжелых формах инфектартрита атрофия мышц может быть очень резкой и диффузной. По нашим наблюдениям, в некоторых случаях заметную атрофию мышц можно наблюдать уже через 10-12 дней от начала болезни. При этом выраженность атрофии не всегда соответствует степени воспалительных изменений в суставах: при небольших изменениях суставов атрофия может быть значительной и наоборот. Рано развивающаяся и выраженная атрофия мышц рассматривается как плохой прогностический признак в отношении восстановления функции суставов.
Поражение мышц при ревматоидном артрите чаще всего проявляется атрофией разгибательных мышц. Так, при поражении лучезапястного сустава больше всего страдает разгибатель предплечья, при заболевании коленного – прямая мышца бедра, при поражении тазобедренного – ягодичная мышца и т. д. Для кистей характерна атрофия межкостных мышц и мышц возвышения большого пальца и мизинца. Вместе с дефигурацией межфаланговых и пястно-фаланговых суставов все это создает довольно характерный вид руки больного инфектартритом. Изменяется также мышечный тонус, чаще в сторону ослабления. В некоторых группах мышц может наблюдаться гипертонус, сопровождающийся резкими болями в этих мышцах (например, в приводящих мышцах бедра). Происхождение амиотрофии мышц при инфектартрите, по всей вероятности, зависит от нескольких факторов. Фактору «бездеятельности», которому старые авторы придавали доминирующее значение, в настоящее время отводится второстепенная роль; о правильности такого взгляда говорит быстрое развитие амиотрофии и частое несоответствие между степенью ее развития и интенсивностью воспалительного процесса в суставах. Однако в некоторых случаях, при значительном уменьшении подвижности сустава, этот фактор может иметь значение добавочного.
Большинство авторов (Н. А. Вельяминов, А. А. Корнилов, Л. О. Даркшевич, Charcot и др.) высказываются за нервнорефлекторное происхождение амиотрофии при ревматоидном артрите. По мнению этих авторов, воспалительный процесс в суставах ведет к раздражению нервных окончаний, которое затем передается в передние рога спинного мозга, где расположены спинальные центры двигательных нервов. Следствием изменений, происходящих в этих центрах, является нарушение трофической иннервации мышц и их атрофия.
Эта концепция поражения мышц при ревматоидном артрите была подтверждена экспериментальными данными А. А. Корнилова, который показал, что перерезка задних корешков предотвращает атрофию мышц при искусственно вызванном артрите у собаки. По мнению А. А. Корнилова, в происхождении атрофии мышц имеет значение нарушение трофической функции ганглиозных клеток спинного мозга и регуляции этой функции со стороны высших психомоторных центров.
Кроме нарушения трофической иннервации (что подтверждается также одновременным развитием трофических изменений костей и кожи), причиной амиотрофии, особенно в тяжелых случаях, является и прямое поражение мышц и сухожилий «ревматоидным» воспалительным процессом. Воспалительные явления в суставах часто распространяются на сухожилия близлежащих мышц, что приводит в дальнейшем к их фиброзным изменениям, сморщиванию и обусловливает развитие контрактур и деформаций. Однако воспалительные изменения мышц могут обнаруживаться и в местах, отдаленных от пораженного сустава. Морфологические исследования Steoner (1946) и Cruickshan (1962) показали, что в межмышечной соединительной ткани, чаще по ходу сосудов, а также в сухожилиях появляются маленькие «ревматоидные» узелки, строение которых сходно со строением подкожных ревматоидных узелков, характерных для инфектартрита. В дальнейшем поражение мышц при ревматоидном артрите прогрессирует, могут развиваться дегенеративные изменения мышечных фибрилл и интерфасцикулярный фиброз, что в некоторых случаях ведет к разрыву сухожилий. Могут наблюдаться ревматоидные тендиниты и теносиновиты, иногда с выраженными болями и даже появлением воспалительного выпота в оболочках сухожилий.
См. также
Источник
Одни и те же симптомы могут быть признаками разных заболеваний, а болезнь может протекать не по учебнику. Не пытайтесь лечиться сами — посоветуйтесь с врачом.
Лекарственная терапия включает применение трех групп препаратов:
Нестероидные противовоспалительные препараты
Представителями нестероидных противовоспалительных препаратов являются
Эти препараты имеют минимальный побочный эффект и сохраняют высокую противовоспалительную и обезболивающую активность.
Мелоксикам (мовалис) в начале лечения при активности воспалительного процесса назначают по 15 мг/сут., а в дальнейшем переходят на 7,5 мг/сут. в качестве поддерживающей терапии.
Нимесулид назначается в дозе 100 мг два раза в сутки.
Целекоксиб (целебрекс) назначается по 100–200 мг два раза в сутки.
Для пожилых людей подбор дозировки препарата не требуется. Однако у пациентов с массой тела ниже средней (50 кг) желательно начинать лечение с самой низкой рекомендованной дозы.
Следует избегать комбинации двух или более нестероидных противовоспалительных препаратов, поскольку их эффективность остается неизменной, а риск развития побочных эффектов возрастает.
Базисные препараты
Базисные препараты рекомендуется применять сразу после установления диагноза.
Основными лекарственными средствами базисной терапии ревматоидного артрита являются:
- метотрексат,
- сульфазалазин,
- D-пеницилламин,
- аминохинолиновые препараты,
- циклофосфан,
- азатиоприн,
- циклоспорин А (сандиммун),
- ремикейд (инфликсимаб),
- энбрел (этанерцепт),
- лефлуномид (арава) и другие.
Неэффективные на протяжении 1,5–3 месяцев базисные препараты должны быть заменены или использованы их комбинации с гормонами в малых дозах, что позволяет снизить активность ревматоидного артрита.
Шесть месяцев – критический срок, не позднее которого должна быть подобрана действенная базисная терапия.
В процессе лечения базисными препаратами тщательно мониторируют активность болезни и побочные эффекты.
Использование высоких доз гормонов (пульс-терапия) в комбинации с медленно действующими средствами позволяет повысить эффективность последних.
Глюкокортикостероиды (гормоны)
При высокой степени активности воспаления используют гормоны, причем в случаях системных проявлений ревматоидного артрита – в виде пульс-терапии (только гормоны или в сочетании с цитостатиком – циклофосфамидом), без системных проявлений – в виде курсового лечения.
Гормоны также применяют как поддерживающую противовоспалительную терапию при неэффективности других лекарственных средств.
В ряде случаев гормоны используются в качестве местной терапии. Препаратом выбора является дипроспан, оказывающий продленное действие.
Мази, кремы, гели на основе нестероидных противовоспалительных препаратов (ибупрофен, пироксикам, кетопрофен, диклофенак) используют в виде аппликаций на воспаленные суставы.
Для усиления противовоспалительного эффекта аппликации вышеназванных мазевых форм препаратов сочетают с аппликациями раствора диметилсульфоксида в разведении 1:2–1:4.
Дополнительная терапия
При отсутствии ответа на стандартное лекарственное лечение у больных с высокой активностью ревматоидного артрита применяют плазмаферез, лимфоцитаферез.
Важным моментом в лечении ревматоидного артрита является профилактика остеопороза – восстановление нарушенного кальциевого баланса в направлении повышения всасывания его в кишечнике и уменьшения выведения из организма.
Для этого применяется диета с повышенным содержанием кальция.
Источниками кальция являются молочные продукты (особенно твердые сорта сыра, а также плавленый сыр; в меньшей степени творог, молоко, сметана), миндаль, лесные и грецкие орехи и пр., а также препараты кальция в сочетании с витамином D или его активными метаболитами.
Препаратом, который можно отнести к базисным антиостеопоретическим средствам, является миакальцик. Он выпускается для внутримышечного введения по 100 ME и в виде назального спрея; назначается по схеме совместно с препаратами кальция (кальцитонин) и производными витамина D.
При лечении ревматоидного артрита используется также лазерная терапия. Особенно при тяжелых обострениях ревматоидного артрита в последние годы широко используются внекорпоральные методы лечения (в первую очередь гемосорбция и плазмаферез).
Лазеротерапия особенно показана на ранней стадии процесса. Курс не более 15 процедур.
С целью уменьшения боли и устранения спазма околосуставных тканей применяется криотерапия (лечение холодом), на курс 10–20 процедур.
С целью воздействия на аллергические процессы, улучшения питания тканей и устранения воспаления применяют и другие физические методы лечения.
В ранней стадии ревматоидного артрита рекомендуется ультрафиолетовое облучение пораженных суставов, электрофорез диметилсульфоксида, кальция, салицилатов.
При появлении более стойких изменений в суставах и при отсутствии признаков высокой активности назначают фонофорез гидрокортизона, магнитотерапию, импульсные токи.
Лечебная физкультура и массаж назначаются всем больным с целью снятия мышечного спазма, быстрейшего восстановления функции суставов.
Все больные ревматоидным артритом должны систематически наблюдаться и обследоваться ревматологом.
Больные с медленно прогрессирующим течением без поражения внутренних органов должны появляться у ревматолога 1 раз в 3 месяца. При наличии поражения внутренних органов больные осматриваются ревматологом 1 раз в 2–4 недели.
Курортное лечение больных ревматоидным артритом рекомендуется осуществлять ежегодно вне фазы обострения.
При доброкачественном течении процесса без выраженных изменений суставов показано применение радиоактивных ванн в Цхалтубо и Белокурихе; при типичном прогрессирующем процессе – лечение сероводородными ваннами в Сочи, Серноводске, Пятигорске, Кемери; при выраженных деформациях и контрактурах – лечение грязевыми аппликациями в Евпатории, Саках, Пятигорске, Одессе.
Источник