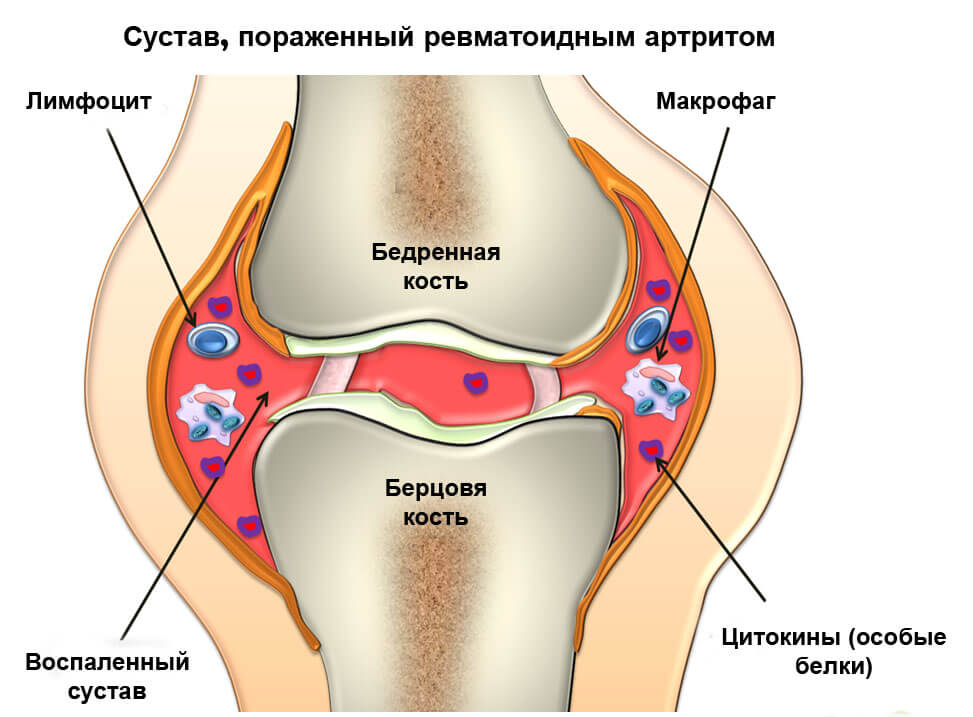
Диагностический алгоритм ревматоидный артрит
Диагностика ревматоидного артрита производится путём личного осмотра пациента врачом и дальнейшим анализом информации, которая поступает в виде заключений по лабораторным и инструментальным обследованиям. При этом процесс постановки диагноза, при сформировавшейся патологии, не вызывает сложностей. Определённые трудности определения болезни существуют на ранних стадиях патологии.
Диагностические признаки и критерии
Среди диагностических признаков заболевания отмечаются:
- АЦЦП (антитела к циклическому цитруллинированому пептиду);
- увеличение количества нейтрофилов и другие изменения синовиальной жидкости под воздействием воспаления;
- остеопороз в районе сустава и костная эрозия.
Протекание ревматоидного артрита характеризуется нижеследующими критериями диагностики, которые были выявлены американскими ревматологами в 1997 году:
- Наличие скованности в поражённых соединительных тканях в утренние часы (длительностью от одного часа, присутствующая в течение шести недель);
- Проявление артрита в трёх или более сочленённых соединениях;
- Чаще всего патология наблюдается:
- во втором и третьем пальце руки в межфаланговых областях, а также в области запястья;
- одновременно в коленях и запястьях;
- в локтевом и голеностопном сочленении.
- Наличие симметричного поражения суставов (при признаках боли в костных сочленениях левой руки, аналогичные боли проявляются в правой руке);
- Проявление внесуставных признаков:
- ревматоидные узелки;
- воспаление лимфоузлов;
- поражение внутренних органов.
- Положительная ревматологическая реакция в анализах крови;
- Характерные изменения на рентгеновских снимках.
Указанные диагностические критерии являются международным стандартом диагностики ревматоидного артрита.
Диагностирование болезни на ранней стадии

Обнаружение патологии на первоначальных этапах формирования позволяет приступить к своевременному курсу терапии. Это способствует предупреждению развития осложнений. Но процесс выявления воспалительной реакции соединительной ткани в начальной фазе обусловлен рядом сложностей. Это совпадение симптомов болезни с другими патологиями, а также отсутствие высокоэффективных лабораторных методик для распознавания диагноза на ранних этапах. Ещё одним немаловажным фактором является обращение пациента с первыми признаками болезни к терапевту. Данные специалисты, в отличие от ревматологов, не в состоянии сразу установить правильное заключение.
Начальной стадией болезни считается промежуток времени от проявления первых негативных признаков до начала деструктивного изменения хрящевой ткани. Как правило, такой период длиться около трёх месяцев. Значимой информацией для диагностики ревматоидного артрита на ранних стадиях заболевания являются полученные в ходе устного опроса пациента жалобы. Среди них выделяются:
- возникновение болей в суставах;
- формирование скованности и отёчности в области поражения;
- болевые ощущения при сжатии кистей рук или при ходьбе (боль отражается в голеностопном аппарате);
- снижение веса;
- повышение температуры;
- наличие быстротечной утомляемости;
- присутствие слабости организма в целом.
Широкое применение получила методика АЦЦП. Она помогает распознать присутствие указанных антител в организме больного заблаговременно. Что позволяет приступить к своевременному лечению на ранней стадии патологии.
Лабораторные и инструментальные методы диагностики
Для выявления ревматоидного артрита используют следующие лабораторные методы диагностики:
- Ревматоидный фактор
Данное исследование показывает наличие аутоиммунных расстройств в организме пациента. К ревматоидным факторам относятся аутоагрессивные антитела иммуноглобулинов. Наибольшее скопление указанных антител выявляется в костном мозге и синовиальной жидкости. По наличию аутоагрессивных антител можно сделать вывод о степени сформировавшегося заболевания. Соответственно при большом присутствии данных элементов патология имеет запущенную степень, а при малом наличии диагностируется ранняя стадия заболевания.
Данные исследования проводят следующими способами: гистохимическими, нефелометрическими, реакция латексагглютинации и Валера-Роза.
Диагностирование заболевания осложнено наблюдением ревматоидных факторов как у здоровой части населения (около пяти процентов), так и у людей с присутствием вируса гепатита С.
- АЦЦП
Титры антител к циклическому цитруллинированному пептиду являются передовым лабораторным исследованием, которое может выявить болезнь в начальной стадии прогрессирования. Присутствие АЦЦП в крови заболевшего, возможно, обнаружить заблаговременно. Они формируются в период от двенадцати до восемнадцати месяцев, до начала образования первых болевых признаков. При этом за нормативный показатель берётся 3 Ед/мл АЦЦП. В случае превышения данного параметра, диагностируется воспалительное заболевание соединительной материи.
- Общий и биохимический анализ крови
При детальном рассмотрении общего анализа крови может фиксироваться повышенное содержание лейкоцитов. Что может свидетельствовать об инфекционной природе патологии. При увеличении числа эозинофилов повышается вероятность аллергического типа заболевания.
По данным биохимического анализа крови вероятны нижеследующие заключения:
- присутствие чрезмерной концентрации фибриногена и сиаловой кислоты означает протекание активной воспалительной реакции;
- нарушение белкового метаболизма возможно при различных видах артрита;
- излишнее содержание мочевой кислоты характерно наличию подагры.
- Изучение синовиальной жидкости
При наличии патологии, в синовиальной жидкости выделяются следующие изменения:
- повышено количество лейкоцитов;
- помутнение жидкости;
- приобретение излишней вязкости;
- формирование рагоцитов.
К основным показателям лабораторного диагностирования указанной патологии относятся ревматоидные факторы и антицитруллиновые антитела. На базе данных исследований можно сделать заключение о наличие или отсутствии патологии. Остальные показатели являются важными для оценки тяжести болезни и дальнейшего назначения лечения.
Для более тщательного анализа заболевания применяют нижеследующие инструментальные методы диагностики:
- Артроскопия
Данный способ представляет собой визуальное исследование поражённого сустава при помощи специализированного оборудования. По данным артроскопии делается вывод о необходимости хирургической коррекции диартроза.
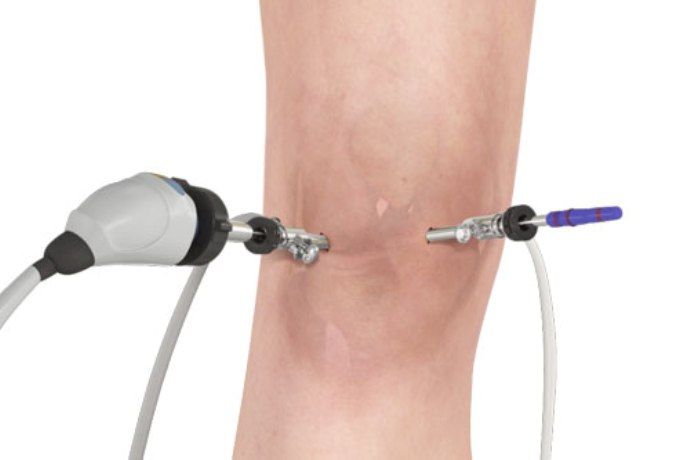
В процессе исследования выявляются нижеследующие характерные признаки заболевания:
- формирование белка фибрина на поражённой хрящевой материи;
- разрастание синовиальной ткани;
- пролиферация ворсинок синовиальной ткани, которая пагубно влияет на жидкость находящуюся внутри диартроза.
- Рентгенография
Использование данной методики на начальных этапах заболевания практически неэффективно. При длительном течении патологии рентгенография способна обнаружить перемены в костной ткани. Что позволяет специалистам поставить диагноз и назначить требуемый курс терапии.
Для ревматоидного артрита характерно обнаружение на рентгене симметричного поражения сочленённых соединений. Также происходит сужение межсуставных щелей или их сращивание.
- Сцинтиграфия
Относится к способам лучевого исследования. Осуществляется путём введения в организм радиоизотопов. Применяется для обнаружения патологических преобразований костной материи. Введённое вещество концентрируется в исследуемой области и явно визуализируется на рентгеновских снимках, при наличии воспалительной реакции в синовиальной поверхности.
Сцинтиграфия даёт возможность распознать патологию на ранних стадиях, но является более чувствительным способом инструментальной диагностики в сравнении с рентгенографией.
- МРТ
Магнитно-резонансная томография показывает результат, позволяющий структурно изучить состояние поражённого сочленённого соединения. За счёт применения электромагнитных волн является безопасным исследовательским методом, даже при неоднократном обследовании. Минусом данной методики является высокая стоимость.
- Ультразвук
Эффективность ультразвукового облучения наблюдается при исследовании больших диартрозов. Это обусловлено сложностью визуализации из-за высокой плотности костных тканей. Поэтому указанный метод диагностирования используется в качестве дополнительного.
Дифференциальная диагностика заболевания
Методика дифференциального подтверждения диагноза ревматоидного артрита требуется для исключения иных патологий соединительных материй суставов. Такое возможно при одновременном протекании различных болезней негативно воздействующих на поверхностную материю сустава.
Среди аналогичных по клиническим признакам болезней отмечаются:
- первичный остеоартроз;
- синдром Стилла;
- псориатический артрит;
- ревматизм;
- подагра;
- синдром Рейтера;
- инфекционные артриты;
- красная волчанка;
- склеродермия;
- реактивные артриты;
- болезнь Бехтерева.
Перечисленные выше заболевания, с различной степенью отрицательного воздействия, оказывают влияние на суставы. При этом каждая из патологий имеет свои характерные черты, которые можно выявить только дифференциальной диагностикой.
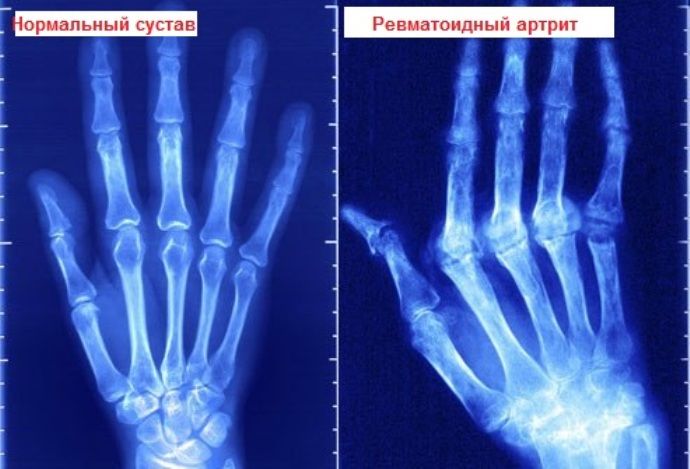
Основания для постановки диагноза
Основанием для постановки диагноза рассматриваемой болезни являются полученные в ходе обследования анализы, а также жалобы пациента с присутствием характерных признаков заболевания.
Диагноз подтверждается в случае наблюдения четырёх диагностических критериев, которые указаны ранее. При этом первые четыре признака из указанного списка должны наблюдаться на протяжении шести и более недель.
Диагностирование патологии представляет собой трудоёмкий процесс, включающий в себя множество лабораторных и инструментальных методик. Одной из приоритетных целей современных медицинских исследований является получение эффективных методик, способных решить вопрос, как определить ревматоидный артрит в начальной стадии.
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
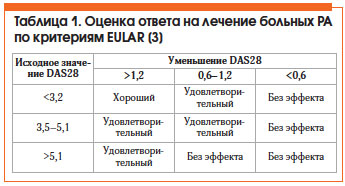
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

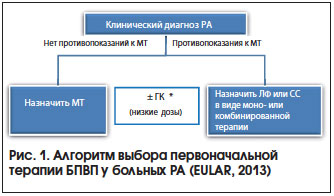
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
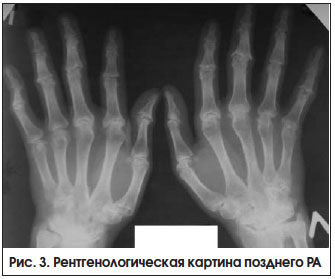
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
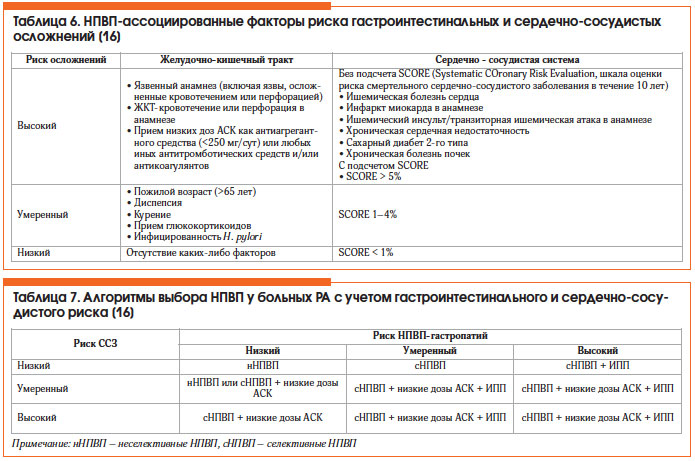
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник