Европейские рекомендации по лечению артроза
Остеоартроз (ОА) – хроническое прогрессирующее заболевание синовиальных суставов с поражением прежде всего гиалинового хряща и субхондральной кости в результате сложного комплекса биомеханических, биохимических и/или генетических факторов. ОА вовлекает в орбиту патологического процесса в первую очередь нагрузочные (коленные и тазобедренные) суставы и этим значительно ухудшает качество жизни больных, приводя к инвалидизации. Согласно последним эпидемиологическим исследованиям распространенность в популяции симптоматического ОА (остеоартрита) коленного сустава составляет примерно 10%, тазобедренного – 5–7% [5]. В ближайшее время распространенность этого заболевания будет неуклонно расти, что связано с увеличением продолжительности жизни населения и процентного соотношения лиц с ожирением в возрасте 60 лет и старше.
ОА представляет собой серьезную социально-экономическую проблему, являясь одной из ведущих причин стойкой потери трудоспособности. По данным EULAR (2003), риск нетрудоспособности вследствие ОА коленных суставов равен риску, связанному с заболеваниями сердца, ОА находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м месте – у мужчин [1]. Отдаленный прогноз этого заболевания у конкретных больных трудно определить в отношении выраженности отдельных клинических симптомов в динамике заболевания и прогрессирования рентгенологических (структурных) изменений с нарастающим нарушением качества жизни. Лечение этого заболевания приводит к значительным материальным затратам, что связано с самим характером болезни, постоянной терапией на протяжении многих месяцев и лет, стоимостью госпитализаций и хирургического лечения.
Диагноз ОА основывается на комбинации клинических симптомов и данных рентгенологического исследования суставов [2]. Изменения на рентгенограммах выявляются у каждого второго индивидуума без клинических симптомов остеопороза. Для распознавания этого заболевания наиболее широко используются диагностические критерии, предложенные Американской коллегией ревматологов (ACR) [3].
Индивидуализированная терапия ОА во многом обусловлена его фенотипом или гетерогенностью. Можно выделить следующие фенотипы этого заболевания – по:
• патогенезу (первичный (идиопатический), вторичный);
• локализации (гонартроз, коксартроз, ОА суставов кистей, полиостеоартроз);
• характеру прогрессирования;
• основной причине болевого синдрома;
• наличию, выраженности и локализации воспаления (синовит, периартериит);
• коморбидности;
• наличию и выраженности функциональной недостаточности и ее ведущей причины.
Одни и те же фармакологические агенты по-разному влияют на проявления и дальнейшее течение ОА в зависимости от его фенотипа. Так, глюкозамин сульфат активно подавляет симптоматику гонартроза и снижает темпы его прогрессирования, практически не влияя на такой же процесс в тазобедренных суставах, в то время как хондроитин сульфат проявляет свою терапевтическую активность в отношении всех основных локализаций первичного идиопатического ОА, а именно ОА коленного и тазобедренного суставов, а также ОА суставов кисти. В равной степени значение гетерогенности прослеживается при анализе естественного течения ОА [2]. У многих больных одна и та же рентгенологическая картина остается на протяжении многих лет без склонности к прогрессированию, в то время как у других наблюдается отчетливая отрицательная динамика с развитием тяжелой функциональной недостаточности в течение 1 года.
Влияние гетерогенности ОА на естественное течение этого заболевания документируют результаты изучения когорты СHEСК [4]. В этом 5-летнем наблюдении проведена комплексная оценка минимальной ширины суставной щели, угла варусной деформации, наличия и величины остеофитов, плотности костной ткани, выраженности боли и функции опорно-двигательного аппарата. На основании проведенного исследования были выявлены 5 вариантов прогрессирования ОА – от выраженного прогрессирования до его отсутствия в течение всего 5–летнего периода наблюдения. Эти данные свидетельствуют о том, что при выборе рациональной терапии ОА следует учитывать разнообразные факторы и что пока нет идеального препарата, который бы обладал значимым эффектом у всех больных с этим заболеванием.
В настоящее время предложено большое количество международных и национальных рекомендаций по лечению ОА. Наибольший интерес представляют рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (Тhe European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO), предложенные в 2014 г. [5]. Эти рекомендации являются первым опытом создания подробного алгоритма, который позволяет врачам различных специальностей ориентироваться в многочисленных методах лечения ОА и выбирать адекватную терапию на различных стадиях развития этого заболевания. В предыдущих рекомендациях далеко не всегда, иногда преднамеренно, учитывались отдельные терапевтические опции. Например, после данных о целесообразности образовательных программ, снижения веса и аэробных упражнений, а также применения парацетамола и нестероидных противовоспалительных препаратов (НПВП) сразу переходили к рекомендациям по хирургическому лечению ОА и не рассматривали возможность терапии структурными аналогами хряща.
В некоторых рекомендациях та или иная опция оценивается как «определенная», или условная, что соответствует слабому терапевтическому эффекту, и «неопределенная», означающая, что эффективность применяемого метода не доказана [6]. В последнюю входят все симптоматические препараты медленного действия. Авторы рекомендаций, представленных ACR, признают, что пока большинство рекомендаций остаются спорными. Интересно, что во многих работах критической оценке подвергается эффективность не только фармакологических препаратов, но и нефармакологических. Так, не рекомендуются к использованию акупунктура, ультразвуковая и лазерная терапия, применение магнитных браслетов, массаж, когнитивно-поведенческая терапия [7]. Следует отметить, что врачу в реальной клинической практике крайне трудно ориентироваться в таких рекомендациях, рациональная терапия в каждом конкретном случае от этого может страдать.
В специальную исследовательскую группу ESCEO вошли 13 международных экспертов (ревматологов, клинических эпидемиологов и специалистов по клиническим исследованиям). На первом этапе был разработан алгоритм терапии ОА, который в дальнейшем доработали еще 3 консультанта. Предложенный алгоритм суммирует доказательства по всем видам лечения этого заболевания, при этом рабочая группа полагает, что многочисленные исследования создали серьезную доказательную базу.
Как известно, практические рекомендации этого заболевания, основанные на доказательной базе терапевтических опций, предлагались и ранее. В данной работе представлен терапевтический алгоритм, который поможет врачу ориентироваться в назначении адекватной терапии в каждом конкретном случае, причем он основан на результатах многочисленных международных и европейских исследований. В рекомендациях ESCEO коленный сустав фигурирует как модель ОА.
Помимо общих принципов ведения больных с ОА – обучающие программы, снижение веса при наличии ожирения, программы аэробных упражнений – разработанный алгоритм предусматривает 4 мультимодальных шага.
В шаге 1 обосновано использование парацетамола в качестве исходного фармакологического препарата, при этом подчеркивается возможность развития разнообразных нежелательных явлений (НЯ), начиная от аллергических реакций, подчас тяжелых, например, по типу некротического эпидермолиза, заканчивая токсическим поражением почек и печени с острой атрофией. И все же парацетамол рассматривается как необходимый анальгетик, который следует назначать на фоне основного лечения симптом-модифицирующими препаратами медленного действия (Symptomatic Slow-Acting Drugs for OA – SYSADOAs), такими как глюкозамин сульфат или хондроитин сульфат, которые должны быть фармацевтически качественными и отпускаться по рецепту врача. Эти две соли: глюкозамин сульфат (в России в основном применяется препарат компании «Rottapharm») и хондроитин сульфат (в России основным препаратом этой молекулы является СТРУКТУМ («Pierre Fabre», Франция)) получили одобрение медицинских сообществ многих стран. Они являются единственными SYSADOAs, которые рекомендует исследовательская группа на основании веских клинических доказательств, включающих безопасность и доказанную эффективность, особенно у пациентов на ранней стадии заболевания. Наружные НПВП могут применяться для дополнительного обезболивания с учетом их кратковременного симптоматического эффекта, схожего с эффектом их пероральных форм, и хорошей локальной и системной безопасности. Кроме того, целесообразны назначение немедикаментозной терапии вне основной программы и присоединение ее в любой период применения алгоритма.
Шаг 2 предусматривает назначение пероральных селективных или неселективных НПВП, ингибирующих циклооксигеназу-2 (ЦОГ-2), пациентам с выраженными клиническими проявлениями, а именно с болевым синдромом или симптоматикой персистирующего воспаления в тканях сустава. Выбор НПВП базируется на наличии коморбидных состояний. Пациентам с рефрактерностью к предыдущей терапии назначается внутрисуставное введение пролонгированных глюкокортикоидов и препаратов гиалуроновой кислоты. Следует отметить, что на этом этапе центральную роль играет использование пероральных НПВП. Хотя нет четко выраженных различий в эффективности пероральных и локальных НПВП, как и SYSADOAs, исследовательская группа считает, что первые могут быть предпочтительны у более тяжелых больных. С другой стороны, пероральные НПВП могут использоваться в течение короткого периода, прерывисто или длительно, но при этом важен мониторинг их переносимости. Такие меры предосторожности ведут к различным принципам выбора неселективных или ЦОГ-2 селективных НПВП в зависимости от сопутствующих заболеваний ЖКТ, сердечно-сосудистой системы или почек.
Внутрисуставное введение препаратов требует обоснованных показаний. Как гиалуроновая кислота, так и глюкокортикоиды в большинстве были изучены у пациентов, у которых применявшаяся обезболивающая или противовоспалительная терапия была неэффективной. Оба вида терапии различаются по быстроте развития эффекта, который более выражен у внутрисуставных глюкокортикоидов, но менее продолжителен по сравнению с гиалуроновой кислотой, чей эффект менее выражен, но длится до 6 мес. после 1–3-недельного курса терапии.
Шаг 3 заключается в медикаментозном лечении перед хирургическим вмешательством и включает использование слабых пероральных опиоидов или антидепрессантов, эффективность которых частично доказана у нечувствительных к предыдущей терапии пациентов. Следует иметь в виду, что эти препараты вызывают НЯ и их длительное применение может привести к серьезным осложнениям.
Наконец, шаг 4 – хирургическое лечение, в основном представленное тотальным эндопротезированием, а также использование классических опиоидов как единственная альтернатива для пациентов, которым противопоказано хирургическое вмешательство.
Рекомендации ESCEO
• Предлагаемый алгоритм суммирует доказательства по всем видам лечения, при этом учитываются большинство существующих международных и национальных рекомендаций по лечению.
• Алгоритм является первой попыткой представить рекомендации по комплексной комбинированной терапии ОА.
• В основе предлагаемого алгоритма лежит мультимодальный (пошаговый) подход к терапии.
ШАГ 1
• Первым препаратом должен быть парацетамол. С учетом ограниченной его эффективности и возможных НЯ парацетамол следует назначать на фоне основного лечения медленно действующими симптоматическими препаратами: глюкозамин сульфатом или хондроитин сульфатом, которые должны быть фармацевтически качественными.
• Глюкозамин сульфат и хондроитин сульфат являются единственными препаратами среди SYSADOAs, которые рекомендуются для длительной терапии ОА. Такое заключение экспертами ESCEO cделано на основании веских клинических доказательств эффективности предлагаемых препаратов, особенно на ранней стадии заболевания, их хорошей переносимости и высокого уровня безопасности.
• Наружные НПВП могут быть дополнительно назначены для более эффективной анальгезии с учетом их кратковременного симптоматического эффекта.
• Методы немедикаментозной терапии возможны на любом этапе шага 1 (обучение, снижение массы тела у пациентов с избыточным весом, создание соответствующей программы упражнений).
ШАГ 2
• Центральную роль играет назначение пероральных НПВП.
• Пероральные НПВП не должны использоваться длительно, но могут применяться повторными курсами.
• При выборе НПВП следует учитывать коморбидность (заболевания ЖКТ, сердечно-сосудистой системы или почек).
• Возможно введение кристаллических пролонгированных глюкокортикоидов и препаратов гиалуроновой кислоты.
ШАГ 3
• Больным с далеко зашедшим ОА и выраженным болевым синдромом рекомендуется использование слабых пероральных опиоидов или антидепрессантов. Эффективность данных препаратов доказана у лиц, рефрактерных к предыдущей терапии.
• Следует проводить постоянный мониторинг возможных НЯ этой группы препаратов, которые могут приводить к серьезным осложнениям, часто может возникать необходимость отмены препаратов.
ШАГ 4
• Хирургическое лечение (эндопротезирование).
• Использование классических опиоидов как альтернативы для больных, которым противопоказано хирургическое вмешательство.
Важно отметить, что разработанный алгоритм является первой попыткой представить рекомендации по комплексной комбинированной терапии ОА. Исследовательская группа ESCEO полагает, что представленная здесь мультимодальная программа должна применяться у всех больных. Когда пациент переходит к шагу 2 и, соответственно, терапии пероральными НПВП, основное лечение, предусмотренное в шаге 1, должно продолжаться, т. к. оно по-прежнему влияет на течение заболевания и способно снизить потребность в НПВП. Аналогичным образом решение о внутрисуставном введении гиалуроновой кислоты и глюкокортикоидов при сохраняющейся симптоматике не должно автоматически приводить к отмене предыдущего лечения. Все становится сложнее, когда пациент переходит к шагу 3 из-за недостаточного контроля имеющейся симптоматики, при этом основные мероприятия шагов 1 и 2 могут быть продлены, т. к. возможен отсроченный положительный эффект.
В данных рекомендациях ESCEO рассмотрены все основные современные методы лечения ОА и включены в алгоритм с соответствующими комментариями. В алгоритме не представлены некоторые группы лекарств, включая бисфосфонаты, т. к. пока не закончена 3-я фаза клинических испытаний с ризедроновой кислотой по контролю симптомов и прогрессированию структурных изменений суставов и пока невозможно сделать вывод об их терапевтической активности, несмотря на благоприятные предварительные результаты. Миорелаксанты также не были включены в алгоритм из-за отсутствия соответствующих исследований при ОА.
Среди научных сообществ в области ревматологии ESCEO – единственное сообщество, которое изучает проблемы, связанные с остеопорозом и остеоартритом, что обосновано множеством биологических взаимосвязей между костью и суставом. Исследовательская группа, представляющая данный алгоритм, имеет солидный практический опыт изучения проблем ОА и фармакоэкономики ревматических заболеваний. Предложенный терапевтический алгоритм является основой для будущих рекомендаций по лечению ОА.
В каждом конкретном случае выбор рациональной терапии ОА определяется различными показателями, в частности сравнительной эффективностью и безопасностью вмешательств, предикторами ответа на проводимую терапию, темпами рентгенологического прогрессирования, параметрами, влияющими на прогноз, психологическими факторами, механизмами боли, социализацией, балансом риска и пользы и доступностью препаратов.
Литература
1. Jordan K.M., Arden N.K., Doherty M. et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann Rheum Dis. 2003. Vol. 62. Р. 1145–1155.
2. Arden N., Nevitt M.C. Osteoarthrosis: epidemiology // Best Pract Res Clin. 2006. Vol. 20 (1). Р. 3–25.
3. Bijlsma J.W., Berembaum F., Lafeber F.P. Osteoarthritis: an update with relevance for clinical practice // Lancet. 2011. Vol. 377 (9783). Р. 2115–2126.
4. Wesseling J., Dekker J., van den Berg W.B. et al. CHECK (Cohort Hip and Cohort Knee): similarities and differences with the Osteoarthritis Inivaties // Ann Rheum Dis. 2009. Vol. 68. Р. 1413–1419.
5. Bruyere O., Cooper C., Pelletier J.P. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Semin Arthritis Rheum. 2014. Vol. 44 (3). Р. 253–263.
6. Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee // Arthritis Care (Haboken). 2012. Vol. 64 (4). Р. 465–474.
7. Osteoarthritis Cartilage. 2014; doi:10.1016/j.joca.2014.01.003.
Источник
В статье представлены обновленные на основании доказательной системы GRADE и новых систематических обзоров и метаанализов клинические рекомендаций по лечению больных остеоартритом 2019 года.

Введение
Остеоартрит (ОА) — это хроническое прогрессирующее заболевание, при котором в зависимости от тяжести болезни требуется комплексный подход к лечению. ОА чаще возникает во второй половине жизни, и, по данным эпидемиологических исследований, частота его возрастает из-за увеличения продолжительности жизни человека. Второй, не менее важной, причиной его возникновения является «эпидемия» ожирения, которое не только ассоциируется с развитием ОА, но и обусловливает более быструю прогрессию болезни [1]. Эти факторы определяют и высокую коморбидность больного ОА, при которой наблюдается повышение риска развития кардиоваскулярных заболеваний (КВЗ), нежелательных явлений (НЯ) со стороны желудочно-кишечного тракта (ЖКТ), почек, влияющих на выбор антиостеоартритической терапии.
Современная модель доказательной медицины основывается на принципе использования баз данных, путем анализа которых принимаются клинические решения и рекомендации. Рекомендации, в свою очередь, создаются на основе баланса между относительной пользой и вредом от лечения, с одной стороны, и важности лечения для пациента и его предпочтений — с другой.
Работа над рекомендациями по лечению больных ОА крупных суставов берет свое начало в 1995 г., когда эксперты Американского колледжа ревматологов предложили клинические рекомендации по управлению ОА крупных суставов. Немного позже последовательно появились рекомендации, созданные под эгидой EULAR (European League Against Rheumatism — Европейская антиревматическая лига) по управлению ОА коленных, тазобедренных суставов и суставов кистей [2–4]. Далее были предложены совместные европейские и американские рекомендации по ведению больных ОА [5–7].
Углубленное изучение патогенетических путей развития болезни привело к пониманию того, что ОА включает в себя несколько подтипов болезни, которые можно гипотетически разделить, например, по установленным факторам риска развития ОА либо по первоначальным изменениям тех или иных тканей, образующих сустав (остеогенный, воспалительный и др.). И, безусловно, меняющееся представление об ОА ставит новые задачи по его лечению, а именно создание рекомендаций для определенного фенотипа ОА. Это обусловлено прежде всего весьма противоречивыми результатами многочисленных систематических обзоров и метаанализов, на основании которых разрабатываются клинические рекомендации по лечению ОА.
Подходы к лечению ОА
Первая попытка персонифицированного подхода к лечению ОА коленных суставов была предпринята экспертами OARSI (Osteoarthritis Research Society International — Международное общество по изучению остеоартрита) [8], которые предложили дифференцированный подход к лечению на основании выделения фенотипов ОА по локализации поражения и наличию или отсутствию коморбидности (рис. 1).
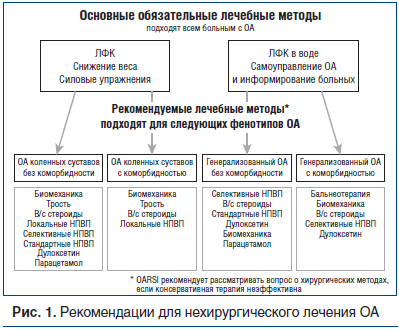
В июле 2014 г. [9] был опубликован алгоритм ведения больных ОА коленных суставов в реальной клинической практике, последовательно отражающий основные принципы лечения ОА. Он был создан комитетом, состоящим из клиницистов и ученых разных стран, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO), и учитывал эффективность и безопасность лечебных мероприятий.
Существующие многочисленные рекомендации по лечению ОА содержат данные по эффективности тех или иных методов лечения, но различные уровни доказательств относительно безопасности и НЯ терапии ОА. На очередном конгрессе ESCEO в 2019 г., состоявшемся в Париже, были обновлены прежние рекомендации на основании доказательной системы GRADE и новых систематических обзоров и метаанализов.
Лечение больных ОА должно проводиться с использованием комбинации нефармакологических и фармакологических методов. Нефармакологические методы помимо образовательных программ, лечебной физкультуры и снижения массы тела должны включать ортопедические приспособления для коррекции оси сустава. Интересно, что недавно появились рекомендации по немедикаментозным методам для врачей первичного звена (рис. 2), которые с учетом гетерогенности боли при ОА рекомендуют психосоциальные вмешательства и коррекцию нарушений сна [10].
![Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10] Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10]](https://www.rmj.ru/upload/medialibrary/a78/2-2.png)
Что касается медикаментозного лечения, то пошаговое назначение препаратов сохранено (рис. 3). Шаг 1 — это базисное лечение ОА. На первых этапах при небольших болях рекомендовался прием парацетамола. Парацетамол длительное время использовался в качестве анальгетического средства при ОА благодаря его безопасности, несмотря на относительно небольшой анальгетический эффект. В последние годы стало увеличиваться количество данных о повышении частоты развития КВЗ, НЯ со стороны ЖКТ, почек и печени при длительном его применении. Conaghan et al. [11] представили клинический обзор литературы по безопасности парацетамола, рекомендуя c осторожностью использовать его при хронической боли.
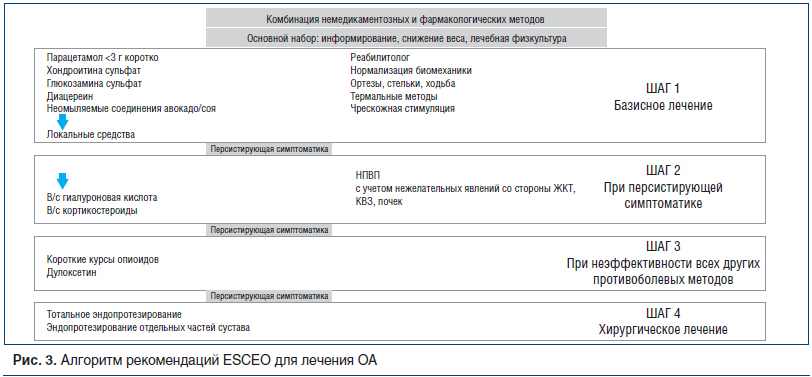
Симптоматические медленнодействующие препараты (SYSADOA) — класс разнообразных препаратов, которые положительно влияют на симптомы ОА и имеют доказательства болезнь-модифицирующего действия при их длительном применении [12–14]. Метаанализы плацебо-контролируемых исследований SYSADOA доказали, что глюкозамина сульфат (ГС), хондроитина сульфат (ХС) и диацереин, неомыляемые соединения авокадо/соя обладают положительным действием (от небольшого до умеренного) при ОА [14]. ESCEO рекомендуют использование этих препаратов, но только фармацевтически качественных, как первое базисное лечение ОА. Применение в нескольких исследованиях кристаллизованного ГС продолжительностью от 6 мес. до 3 лет при ОА доказало его преимущество перед плацебо по влиянию на боль (0,27 (95% доверительный интервал (95% ДИ): 0,12–0,43) и функцию суставов (0,33 (95% ДИ: 0,17–0,48) [15]. Другими словами, размер эффекта оказался таким же, как при применении коротких курсов нестероидных противовоспалительных препаратов (НПВП), а применение его в течение 3 лет замедляло прогрессирование ОА [16]. В России появились инъекционная и пероральная формы ГС — Сустагард®Артро, изучен синергизм препарата с 7 наиболее часто назначаемыми НПВП, его антитромботические эффекты, безопасность его применения при сопутствующем сахарном диабете, установлено синергичное действие ГС одновременно на транскриптом, протеом и реактом. Комплексное противовоспалительное действие ГС, снижающее синтез провоспалительных цитокинов и ослабляющее их воздействие на клетки, является фактором, влияющим на патогенез не только ОА, но и коморбидных ему патологий, сопровождающихся хроническим воспалением [17, 18].
ХС тоже способен замедлять прогрессирование ОА, кроме того, этот препарат обладает довольно выраженным действием на боль — размер анальгетического эффекта, по некоторым данным, достигает 0,75. Недавно опубликованное исследование показало эффективность ХС в отношении уменьшения структурных изменений в суставах с параллельным симптоматическим клинически значимым действием [19], что нашло подтверждение и в последующих работах. Эффективность и безопасность инъекционной формы ХС (Хондрогард®) изучались у 70 пациентов с ОА коленных суставов в ФГБНУ НИИР им. В.А. Насоновой. Терапия ХС в виде внутримышечных инъекций была эффективна у подавляющего большинства больных. Отмечено статистически значимое улучшение как отдельных показателей: боли, скованности, функциональной недостаточности (ФН), так и индекса WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) в целом. Из 63 пациентов, отметивших положительный эффект проводимой терапии, полностью прекратили прием НПВП 44% человек. Уменьшили дозу в 2 раза или стали принимать НПВП не чаще 1 раза в 3 дня 33% больных [20].
Несмотря на противоречивость некоторых рекомендаций по лечению ОА, SYSADOA широко с успехом используются во многих странах и как рецептурные препараты, и как продаваемые без рецепта. Профиль безопасности препаратов этой группы был представлен в систематическом обзоре и метаанализе исследований по сравнению SYSADOA с плацебо при ОА [21]. ХС и ГС, только фармацевтически качественные, рекомендуются как безопасные и эффективные SYSADOA. Ограниченные данные относительно безопасности представлены по неомыляемым соединениям авокадо/соя, которые содержат ингредиенты из многих натуральных растительных экстрактов, показана безопасность запатентованного препарата. Применение диацереина ассоциируется с отдельными небезопасными явлениями, поэтому польза препарата должна оцениваться для каждого пациента с учетом подходящей дозы и характеристик больного [22].
Локальные НПВП в целом рекомендуются до назначения пероральных НПВП, они обладают умеренным действием на боль, сравнимым с эффектом пероральных НПВП, но лучшим профилем безопасности благодаря низкой системной адсорбции. Эти данные систематического обзора и метаанализа представлены Honvo et al. [23]. Было отмечено незначимое увеличение кожных и подкожных НЯ, большинство из них относились к диклофенаку. Локальные НПВП могут рассматриваться как безопасное лечение, особенно по отношению к ЖКТ.
При персистирующей симптоматике назначаются системные НПВП. Их средняя эффективность при лечении боли ассоциируется с широким диапазоном токсичности со стороны ЖКТ, КВЗ и почек. В литературном обзоре Cooper et al. [24] представили резюме по безопасности неселективных НПВП с 2011 г. Отмечено, что токсичность как в отношении ЖКТ, так и в отношении сердечно-сосудистой системы присуща всем НПВП [25]. Практически все НПВП потенциально могут вызывать острое повреждение почек, и коморбидные больные ОА с такими патологиями, как сахарный диабет 1 типа, артериальная
гипертензия и сердечная недостаточность, имеют увеличенный риск развития НЯ.
Curtis et al. представили систематический обзор и метаанализ ингибиторов циклооксигеназы 2 типа
(ЦОГ-2) [26]. Хотя ингибиторы ЦОГ-2 были созданы для того, чтобы избежать НЯ со стороны верхних отделов ЖКТ, результаты этого анализа показали наличие повышенного риска со стороны указанных отделов, особенно абдоминальной боли, у всех препаратов данного класса. Эти препараты ассоциируются с увеличением риска КВЗ. Даже при удалении из метаанализа рофекоксиба риск развития сердечной недостаточности и отеков остается значимым, поэтому предлагается осторожный подход к использованию НПВП и ингибиторов ЦОГ-2 при выборе лечения, с учетом индивидуальных характеристик пациента и ограничением длительности применения препаратов — интермиттирующего или курсового — для минимизации НЯ.
Внутрисуставное введение гиалуроновой кислоты (ГК) рекомендуется в случае наличия противопоказаний для приема НПВП, у пожилых больных с коморбидностью или у больных, не ответивших на проводившуюся ранее терапию [27]. Несмотря на возрастающее количество доказательств эффективности ГК, особенно при ОА коленных суставов, и широкое использование ГК в клинической практике, все еще обсуждается соотношение польза/риск применения этих препаратов. Данные систематического обзора и метаанализа Honvo et al. [28] не позволяют определенно высказаться в отношении безопасности ГК (только низко- и среднемолекулярной), поэтому требуется дальнейшее накопление данных.
Опиоиды рассматриваются только как фармакологическое лечение ОА при наличии очень интенсивной боли, когда нет ответа на другие методы лечения, когда уже возникает вопрос о хирургическом лечении [27]. Систематический обзор и метаанализ, проведенный Fuggle et al. [29], подтверждают безопасность использования опиоидов при ОА, но они ассоциируются с увеличенным риском развития НЯ со стороны ЖКТ, кожи и центральной нервной системы, поэтому опиоиды рекомендуется назначать при неэффективности всех других противоболевых методов и только на короткий период времени.
При неэффективности терапевтического лечения и ухудшении качества жизни проводится оперативное лечение.
Заключение
Таким образом, обновленный алгоритм лечения больных ОА на основании принципов доказательной медицины предлагает комплексный подход к лечению ОА, с помощью системы доказательств GRADE обосновывает необходимость назначения базисной терапии препаратами SYSADOA уже на первом этапе лечения, с пошаговым назначением лекарственных препаратов, что, безусловно, будет полезным для практикующих врачей.
Источник


