G по ревматоидному артриту
Ревматоидный артрит (РА) считается одним из самых тяжелых хронических заболеваний человека. Заболевание характеризуется выраженным воспалением с пролиферацией синовиальной оболочки суставов, поражением внутренних органов и систем, многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. До последнего времени в течение первых 5 лет болезни более 40% больных РА становились инвалидами [1]. Кроме того, многими авторами сообщается, что РА снижает продолжительность жизни больных в среднем на 10 лет [2, 3].
Течение РА весьма вариабельно. Это связано со многими причинами. Больной может оказаться резистентным к лечению либо не переносить его. Задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) также ухудшает прогноз при РА. Кроме того, известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания. Известно, что в крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитруллинированному пептиду (АЦЦП) [4] (рис. 1).
Морфологическое исследование синовиальной оболочки, полученной у больных в первые месяцы дебюта артрита, показало, что не у всех выявляются признаки острого ревматоидного воспаления, – у части больных уже в первом биоптате наблюдаются отчетливые признаки хронического синовита [5]. Именно у этих больных отмечался далее более торпидный вариант РА с плохим ответом на терапию БПВП. Тяжесть состояния больного РА на каждом этапе зависит от уровня воспалительной активности, что определяет выраженность болей в суставах, скованность, функциональные нарушения. При адекватно проводимой терапии и подавлении активности до развития необратимых анатомических изменений в суставах (деструкция, деформации) функция суставов восстанавливается (рис. 2). А тяжелый вариант течения болезни встречается при неадекватно проводимой или неэффективной терапии, определяется степенью стойкой утраты функциональной способности больного не только к профессиональному труду, но и к самообслуживанию. Поэтому как можно более раннее начало противовоспалительной терапии имеет при РА принципиальное значение.
В последнее десятилетие в практику здравоохранения внедрены диагностические критерии ранних стадий РА [6] для своевременного направления больного к ревматологу и раннего начала терапии. А появление новых классификационных критериев ACR/EULAR 2010 г. позволило как можно раньше начинать лечение БПВП [7]. Идеальным должно считаться начало терапии БПВП сразу после появления первых симптомов воспаления в синовиальной оболочке: утренней скованности, боли в суставах и припухлости, что и отражено в данных критериях: наличие полиартрита с вовлечением мелких суставов имеет наибольший вес. На практике больной с дебютом РА проходит подчас длинный путь консультаций, диагностических мероприятий до встречи с ревматологом.
Кроме того, начало болезни может быть клинически слабо выражено, и симптомы болезни медленно нарастают, что затрудняет установление диагноза РА. По данным зарубежных авторов [8] и по нашим данным [9], при остром дебюте РА отдаленный исход болезни лучше, чем при постепенном начале заболевания. Вероятно, острое начало болезни заставляет пациента быстрее обращаться за врачебной помощью, а врач в этом случае быстрее определяется с диагнозом и начинает терапию. Наши данные свидетельствуют о лучшем исходе РА, оцененном через 15 лет болезни по степени сохранности функции опорно-двигательного аппарата, выраженности деструкции в суставах, частоте многолетних ремиссий и выживаемости больных, при назначении БПВП в первые 6 мес. от дебюта симптомов артрита [10].
Задержка с назначением БПВП приводит к более плохому ответу на эти препараты, что было показано в контролируемых исследованиях [11]. Препаратом первой линии считается метотрексат, другие БПВП (лефлуномид, сульфасалазин) в начале лечения используют при невозможности назначить метотрексат. Терапия БПВП у многих больных приводит к подавлению активности и прогрессирования РА, особенно при назначении их в первые месяцы болезни. Но и начало терапии в очень ранний период болезни (1–2 мес. болезни) не во всех случаях позволяет добиться выраженного эффекта (клинической ремиссии или поддержания низкой активности РА). Во-первых, больной может не ответить на БПВП; во-вторых, у многих больных эффективность БПВП уменьшается через 1–2 года терапии, у части больных происходит последовательная смена базисных препаратов из-за симптомов непереносимости.
При неэффективности и/или непереносимости последовательно назначаемых БПВП и развивается тяжелая форма РА. Наиболее значимыми параметрами для определения тяжести РА являются выраженность деструктивных изменений в суставах и степень стойкой утраты функциональной способности суставов вплоть до утраты больным способности к самообслуживанию.
Большое количество рандомизированных клинических исследований (РКИ) было посвящено выявлению наиболее эффективных терапевтических стратегий в лечении больных РА: сравнивались результаты лечения при последовательной монотерапии БПВП, при их комбинации как в дебюте болезни (стратегия «step-down»), так и после присоединения 2-го, 3-го препаратов при неэффективности первого средства (стратегия «step-up»). В последних рекомендациях EULAR 2013 [12] использование комбинации БПВП предлагается и в дебюте лечения, что основывается на результатах нескольких рандомизированных открытых исследований [13–15].
Оценка в сравнительном аспекте эффективности монотерапии метотрексатом, сульфасалазином, антималярийными препаратами, циклоспорином А, лефлуномидом и их комбинаций [16–23] не показала однозначного преимущества комбинированной терапии БПВП перед их применением в виде монотерапии. В ряде исследований было показано, что через 6, 12 и 24 мес. клинический эффект был более выражен при использовании комбинации БПВП (либо при «step-up», либо при «step-down» стратегии) [19, 21, 24–28]; по данным других авторов [29, 30] не отмечено достоверных отличий во влиянии на показатели активности монотерапии или комбинации БПВП. При продлении срока исследований (до 5 лет) преимущества во влиянии на активность РА комбинации БПВП перед монотерапией не отмечено [16, 28, 29]. Оценка рентгенологических изменений в суставах через 1–2 года не показала преимуществ комбинированного лечения в исследовании MASCOT [21], а комбинация циклоспорина А и метотрексата в 2-х исследованиях через 6 [31] и 12 [32] мес. в большей степени подавляла прогрессирование деструкции, чем монотерапия метотрексатом. В исследовании FIN-RACo изменение счета Ларсена было достоверно меньше при использовании комбинации БПВП через 2 года [19], но через 5 лет достоверных различий между комбинированной терапией и монотерапией уже не отмечалось [20]. Следует отметить, что комбинация БПВП была более эффективна по сравнению с монотерапией различными БПВП только в том случае, если в комбинации использовался метотрексат.
Кроме того, интересные данные были получены при оценке эффективности двойных комбинаций БПВП с тройной комбинацией: сравнивали эффективность метотрексата + сульфасалазин, метотрексата + гидроксихлорохин и комбинации всех 3-х препаратов [13]. По критериям эффективности ACR было получено превосходство тройной комбинации над двойными, но только в группе больных, которые ранее не получали метотрексат. В группе больных, ранее лечившихся метотрексатом, эффект тройной комбинации не превышал эффект совместного применения метотрексата и гидроксихлорохина.
Весьма интересны данные, полученные в результате исследования TICORA [17, 33], которое сравнило результаты 18-месячного лечения 2-х групп больных РА: в 1-й группе лечение проводилось со строгим ежемесячным контролем изменения активности РА по DAS («tight» контроль), и в соответствии с динамикой DAS корригировалась терапия («интенсивная» группа). Во 2-й группе лечение проводилось рутинным способом без такого жесткого контроля. К концу исследования ремиссия была достигнута у 65% больных 1-й группы и только у 16% больных 2-й группы. Увеличение числа эрозий было меньше в 1-й группе. Контролируемое лечение («интенсивная» группа) сопровождалось более частой коррекцией терапевтической тактики (использование комбинации БПВП, эскалация их дозы, использование внутрисуставных введений ГК). Авторы при анализе этих результатов пришли к выводу, что контроль за лечением обеспечивает наилучшие результаты вне зависимости от выбора БПВП.
Такой же вывод сделан J.M. Albers et al. [34] при оценке результатов 4-х различных режимов использования БПВП: жесткий контроль за успешностью лечения обеспечивает сходные результаты терапии различными БПВП. При оценке лечения метотрексатом пациентов с ранним РА (длительность болезни <1 года) в исследовании CAMERA [22, 23] также сделан вывод, что строгий ежемесячный контроль динамики активности болезни («tight» контроль) и своевременная коррекция терапии позволяют добиться достоверно лучшего результата за период 2-летнего наблюдения. Так, в группе интенсивного контроля (n=76) частота ремиссий составила 50%, а при рутинном способе лечения (n=55) – 37% (p=0,03) [23]. Эти данные совпадают с нашим мнением, основанным на результатах более длительного открытого исследования эффективности базисной терапии у 240 больных: улучшение исхода РА (функциональное состояние суставов, рентгенологическая картина) зависит не только от сроков начала лечения, но и от степени обеспечения постоянного контроля за ходом лечения [10]. Также эти данные создали предпосылки для разработки современной стратегии лечения РА «Лечение до достижения цели» («Treat to target»), когда основной целью лечения становится достижение ремиссии, а альтернативной целью – достижение низкой активности РА [35].
Но даже при грамотном подходе к терапии больных РА в соответствии с внедренной в нашей стране стратегией лечения «Лечение до достижения цели» классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности и прогрессирования болезни) все же развивается тяжелая форма РА. По нашим данным и данным литературы, у 15–25% больных последовательно назначаемые БПВП не приводят к выраженному эффекту (хороший эффект по критериям EULAR или более чем 50% улучшение по критериям ACR) либо приводят к возникновению побочных реакций и необходимости отмены БПВП. Создание генно-инженерных биологических препаратов (ГИБП) позволило в значительной степени оптимизировать лечение больных РА.
В настоящий момент в Российской Федерации зарегистрированы 5 блокаторов фактора некроза опухоли-α (ФНО-α): инфликсимаб, адалимумаб, цертолизумаб пэгол, голимумаб, этанерцепт, препарат ритуксимаб, связывающий CD20, ингибитор растворимых мембранных рецепторов к интерлейкину-6 – тоцилизумаб и абатацепт. Все эти препараты продемонстрировали высокую эффективность у больных с недостаточным эффектом БПВП, включая метотрексат. Лечение ритуксимабом, как правило, проводится при неэффективности ингибиторов ФНО-α, хотя препарат может использоваться как первый ГИБП при особых показаниях (например, проживание в эндемичном по туберкулезу районе), что также отмечено в последних рекомендациях EULAR (2013) [12]. Остальные ГИБП могут быть первыми представителями этой группы, назначаемыми при отсутствии эффекта от БПВП.
С учетом высокой стоимости лечения ГИБП важным представляется вопрос отбора больных для терапии ГИБП. Как было показано в исследовании BEST [13], при неэффективности 2-х последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы и в России одним из критериев отбора больных для назначения ГИБП является неэффективность 2-х БПВП, одним из которых должен быть метотрексат. Как показывает анализ РКИ, начало терапии сразу с комбинации ГИБП и метотрексата не имеет преимуществ перед последовательным усилением терапии при недостаточном эффекте метотрексата [36]. Однако при наличии факторов неблагоприятного прогноза (высокая активность с вовлечением большого количества суставов, высокая концентрация РФ и АЦЦП, прогрессирование деструкции суставов) вопрос о применении ГИБП обсуждается после неэффективности первого БПВП.
Классические БПВП способны в дебюте РА оказать выраженное действие и подавить рентгенологическое прогрессирование деструкции у значительного количества пациентов. В нашей практике больным с установленным диагнозом РА сразу назначается метотрексат, при наличии противопоказаний индивидуально обсуждается выбор БПВП. Далее пациент наблюдается ежемесячно до выраженного эффекта с коррекцией терапии, проводимой индивидуализированно. В течение первых 3-х мес. лечения должно быть установлено, имеется ли эффект, какова его выраженность. Такой контроль за степенью подавления активности позволяет своевременно корректировать терапию, если это требуется. При 50% (и более) улучшении далее в течение первого года терапии оценивается, есть ли подавление прогрессирования эрозивного артрита. Недостаточный противовоспалительный эффект или появление новых эрозий в суставах кистей и стоп, развитие деструкции крупных суставов, сохранение внесуставных проявлений должны приводить к изменению терапии: увеличению дозы метотрексата или переходу на его подкожные инъекции, смене БПВП, комбинации БПВП или их комбинации с ГИБП. Увлечение симптоматической терапией, стремление подавить активность заболевания с помощью частых внутрисуставных или в/в введений глюкокортикоидов при отсутствии достаточного и стабильного эффекта БПВП не предупреждают развития тяжелой формы РА. Эти мероприятия могут быть только дополнением к лечению БПВП, но не подменять его.
Таким образом, для предупреждения утраты функции у больных РА, т. е. для предупреждения развития тяжелой формы болезни врач должен обеспечить следующее:
- раннее назначение БПВП всем больным РА;
- провести обучение больного с объяснением целей терапии, необходимости длительного (многомесячного и многолетнего) лечения, мониторинга переносимости препаратов;
- постоянный контроль за степенью подавления активности и прогрессирования болезни с объективной оценкой количественной выраженности суставного синдрома и деструктивных изменений в суставах, за переносимостью терапии;
- при неэффективности 2-х последовательно назначенных БПВП поставить вопрос о необходимости назначения ГИБП.
Для объективного контроля за активностью РА на каждом этапе лечения врач должен регистрировать число болезненных и припухших суставов, выраженность боли по оценке больным, общее состояние по оценке больным и врачом с использованием визуальной аналоговой шкалы, а также лабораторные параметры (СОЭ и С-реактивный белок). Контроль за успешностью терапии с использованием составного индекса DAS28 позволяет объективизировать контроль изменения активности РА.
Таким образом, внедрение новых классификационных критериев РА, наличие активных БПВП и арсенала ГИБП, безусловно, создает предпосылки для значимого улучшения исходов РА, сохранения качества жизни больных.
Источник
Диагностика ревматоидного артрита производится путём личного осмотра пациента врачом и дальнейшим анализом информации, которая поступает в виде заключений по лабораторным и инструментальным обследованиям. При этом процесс постановки диагноза, при сформировавшейся патологии, не вызывает сложностей. Определённые трудности определения болезни существуют на ранних стадиях патологии.
Диагностические признаки и критерии
Среди диагностических признаков заболевания отмечаются:
- АЦЦП (антитела к циклическому цитруллинированому пептиду);
- увеличение количества нейтрофилов и другие изменения синовиальной жидкости под воздействием воспаления;
- остеопороз в районе сустава и костная эрозия.
Протекание ревматоидного артрита характеризуется нижеследующими критериями диагностики, которые были выявлены американскими ревматологами в 1997 году:
- Наличие скованности в поражённых соединительных тканях в утренние часы (длительностью от одного часа, присутствующая в течение шести недель);
- Проявление артрита в трёх или более сочленённых соединениях;
- Чаще всего патология наблюдается:
- во втором и третьем пальце руки в межфаланговых областях, а также в области запястья;
- одновременно в коленях и запястьях;
- в локтевом и голеностопном сочленении.
- Наличие симметричного поражения суставов (при признаках боли в костных сочленениях левой руки, аналогичные боли проявляются в правой руке);
- Проявление внесуставных признаков:
- ревматоидные узелки;
- воспаление лимфоузлов;
- поражение внутренних органов.
- Положительная ревматологическая реакция в анализах крови;
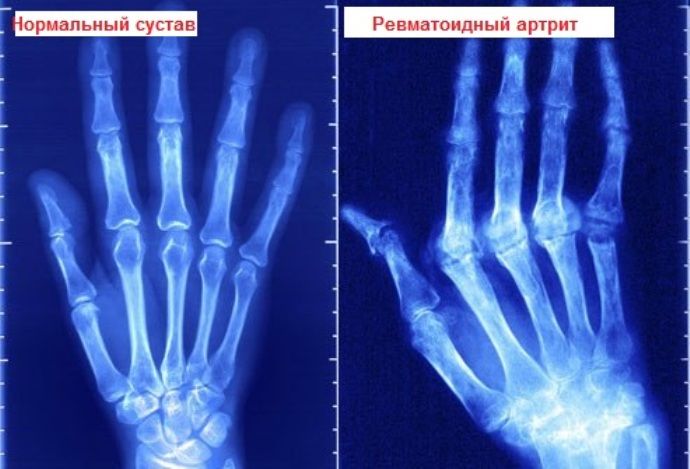
- Характерные изменения на рентгеновских снимках.
Указанные диагностические критерии являются международным стандартом диагностики ревматоидного артрита.
Диагностирование болезни на ранней стадии

Обнаружение патологии на первоначальных этапах формирования позволяет приступить к своевременному курсу терапии. Это способствует предупреждению развития осложнений. Но процесс выявления воспалительной реакции соединительной ткани в начальной фазе обусловлен рядом сложностей. Это совпадение симптомов болезни с другими патологиями, а также отсутствие высокоэффективных лабораторных методик для распознавания диагноза на ранних этапах. Ещё одним немаловажным фактором является обращение пациента с первыми признаками болезни к терапевту. Данные специалисты, в отличие от ревматологов, не в состоянии сразу установить правильное заключение.
Начальной стадией болезни считается промежуток времени от проявления первых негативных признаков до начала деструктивного изменения хрящевой ткани. Как правило, такой период длиться около трёх месяцев. Значимой информацией для диагностики ревматоидного артрита на ранних стадиях заболевания являются полученные в ходе устного опроса пациента жалобы. Среди них выделяются:
- возникновение болей в суставах;
- формирование скованности и отёчности в области поражения;
- болевые ощущения при сжатии кистей рук или при ходьбе (боль отражается в голеностопном аппарате);
- снижение веса;
- повышение температуры;
- наличие быстротечной утомляемости;
- присутствие слабости организма в целом.
Широкое применение получила методика АЦЦП. Она помогает распознать присутствие указанных антител в организме больного заблаговременно. Что позволяет приступить к своевременному лечению на ранней стадии патологии.
Лабораторные и инструментальные методы диагностики
Для выявления ревматоидного артрита используют следующие лабораторные методы диагностики:
- Ревматоидный фактор
Данное исследование показывает наличие аутоиммунных расстройств в организме пациента. К ревматоидным факторам относятся аутоагрессивные антитела иммуноглобулинов. Наибольшее скопление указанных антител выявляется в костном мозге и синовиальной жидкости. По наличию аутоагрессивных антител можно сделать вывод о степени сформировавшегося заболевания. Соответственно при большом присутствии данных элементов патология имеет запущенную степень, а при малом наличии диагностируется ранняя стадия заболевания.
Данные исследования проводят следующими способами: гистохимическими, нефелометрическими, реакция латексагглютинации и Валера-Роза.
Диагностирование заболевания осложнено наблюдением ревматоидных факторов как у здоровой части населения (около пяти процентов), так и у людей с присутствием вируса гепатита С.
- АЦЦП
Титры антител к циклическому цитруллинированному пептиду являются передовым лабораторным исследованием, которое может выявить болезнь в начальной стадии прогрессирования. Присутствие АЦЦП в крови заболевшего, возможно, обнаружить заблаговременно. Они формируются в период от двенадцати до восемнадцати месяцев, до начала образования первых болевых признаков. При этом за нормативный показатель берётся 3 Ед/мл АЦЦП. В случае превышения данного параметра, диагностируется воспалительное заболевание соединительной материи.
- Общий и биохимический анализ крови
При детальном рассмотрении общего анализа крови может фиксироваться повышенное содержание лейкоцитов. Что может свидетельствовать об инфекционной природе патологии. При увеличении числа эозинофилов повышается вероятность аллергического типа заболевания.
По данным биохимического анализа крови вероятны нижеследующие заключения:
- присутствие чрезмерной концентрации фибриногена и сиаловой кислоты означает протекание активной воспалительной реакции;
- нарушение белкового метаболизма возможно при различных видах артрита;
- излишнее содержание мочевой кислоты характерно наличию подагры.
- Изучение синовиальной жидкости
При наличии патологии, в синовиальной жидкости выделяются следующие изменения:
- повышено количество лейкоцитов;
- помутнение жидкости;
- приобретение излишней вязкости;
- формирование рагоцитов.
К основным показателям лабораторного диагностирования указанной патологии относятся ревматоидные факторы и антицитруллиновые антитела. На базе данных исследований можно сделать заключение о наличие или отсутствии патологии. Остальные показатели являются важными для оценки тяжести болезни и дальнейшего назначения лечения.
Для более тщательного анализа заболевания применяют нижеследующие инструментальные методы диагностики:
- Артроскопия
Данный способ представляет собой визуальное исследование поражённого сустава при помощи специализированного оборудования. По данным артроскопии делается вывод о необходимости хирургической коррекции диартроза.
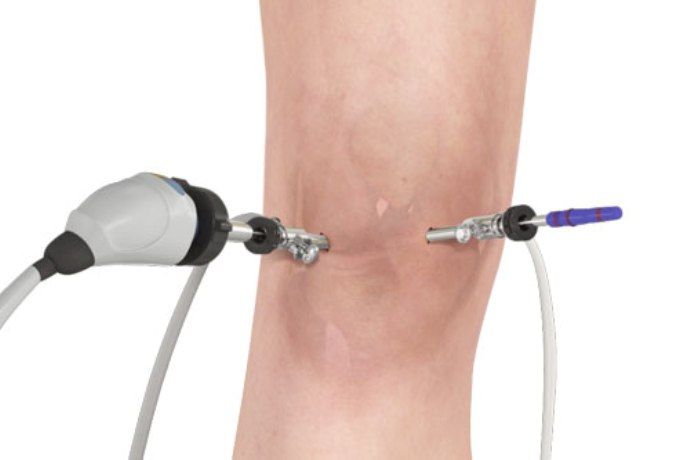
В процессе исследования выявляются нижеследующие характерные признаки заболевания:
- формирование белка фибрина на поражённой хрящевой материи;
- разрастание синовиальной ткани;
- пролиферация ворсинок синовиальной ткани, которая пагубно влияет на жидкость находящуюся внутри диартроза.
- Рентгенография
Использование данной методики на начальных этапах заболевания практически неэффективно. При длительном течении патологии рентгенография способна обнаружить перемены в костной ткани. Что позволяет специалистам поставить диагноз и назначить требуемый курс терапии.
Для ревматоидного артрита характерно обнаружение на рентгене симметричного поражения сочленённых соединений. Также происходит сужение межсуставных щелей или их сращивание.
- Сцинтиграфия
Относится к способам лучевого исследования. Осуществляется путём введения в организм радиоизотопов. Применяется для обнаружения патологических преобразований костной материи. Введённое вещество концентрируется в исследуемой области и явно визуализируется на рентгеновских снимках, при наличии воспалительной реакции в синовиальной поверхности.
Сцинтиграфия даёт возможность распознать патологию на ранних стадиях, но является более чувствительным способом инструментальной диагностики в сравнении с рентгенографией.
- МРТ
Магнитно-резонансная томография показывает результат, позволяющий структурно изучить состояние поражённого сочленённого соединения. За счёт применения электромагнитных волн является безопасным исследовательским методом, даже при неоднократном обследовании. Минусом данной методики является высокая стоимость.
- Ультразвук
Эффективность ультразвукового облучения наблюдается при исследовании больших диартрозов. Это обусловлено сложностью визуализации из-за высокой плотности костных тканей. Поэтому указанный метод диагностирования используется в качестве дополнительного.
Дифференциальная диагностика заболевания
Методика дифференциального подтверждения диагноза ревматоидного артрита требуется для исключения иных патологий соединительных материй суставов. Такое возможно при одновременном протекании различных болезней негативно воздействующих на поверхностную материю сустава.
Среди аналогичных по клиническим признакам болезней отмечаются:
- первичный остеоартроз;
- синдром Стилла;
- псориатический артрит;
- ревматизм;
- подагра;
- синдром Рейтера;
- инфекционные артриты;
- красная волчанка;
- склеродермия;
- реактивные артриты;
- болезнь Бехтерева.
Перечисленные выше заболевания, с различной степенью отрицательного воздействия, оказывают влияние на суставы. При этом каждая из патологий имеет свои характерные черты, которые можно выявить только дифференциальной диагностикой.
Основания для постановки диагноза
Основанием для постановки диагноза рассматриваемой болезни являются полученные в ходе обследования анализы, а также жалобы пациента с присутствием характерных признаков заболевания.
Диагноз подтверждается в случае наблюдения четырёх диагностических критериев, которые указаны ранее. При этом первые четыре признака из указанного списка должны наблюдаться на протяжении шести и более недель.
Диагностирование патологии представляет собой трудоёмкий процесс, включающий в себя множество лабораторных и инструментальных методик. Одной из приоритетных целей современных медицинских исследований является получение эффективных методик, способных решить вопрос, как определить ревматоидный артрит в начальной стадии.
Источник