Иммунограмма при реактивном артрите
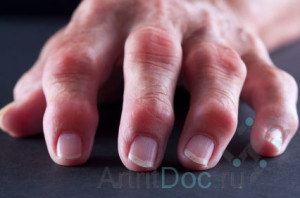 Реактивный артрит – острое негнойное воспаление суставов, возникающее на фоне или после перенесенной инфекции. При этом возбудители заболевания редко проникают внутрь суставной сумки, и синовиальная жидкость может оставаться стерильной.
Реактивный артрит – острое негнойное воспаление суставов, возникающее на фоне или после перенесенной инфекции. При этом возбудители заболевания редко проникают внутрь суставной сумки, и синовиальная жидкость может оставаться стерильной.
↑
Причины развития реактивного артрита
Ведущий механизм, вызывающий реактивный артрит суставов, — это не воздействие болезнетворных микроорганизмов, а патологическая реакция иммунной системы человека против собственных тканей: суставного хряща, синовиальной сумки, сухожилий. Такие изменения иммунитета развиваются вследствие общности антигенного состава некоторых возбудителей инфекции и соединительнотканных клеточных структур кожи, суставов, слизистых оболочек.
Во время кишечной инфекции (сальмонеллеза, иерсинеоза, дизентерии, клостридиоза, кампилобактериоза), урогенитального хламидиоза или заболеваний дыхательных путей, вызванных микоплазмой или хламидией, иммунная система активизируется. Она вырабатывает избыточное количество антител-киллеров и уничтожает возбудителя болезни. В организме, в том числе и внутри суставов, сохраняются лишь «спрятавшиеся» внутрь клеток организма человека дремлющие формы микробов и остатки неиспользованных антител против них. Они и прикрепляются к сходным по антигенному составу структурам суставов, вызывая их повреждение и воспаление. Кроме того, они резко активизируют повторную выработку новых антител, жертвой которых из-за отсутствия микробов снова становятся клетки хряща и синовиальных оболочек. В результате возникает порочный круг, вырваться из которого можно только с помощью врача-ревматолога, знающего, как лечить артрит в реактивной форме.
↑
Симптомы заболевания
Независимо от микроорганизма, запустившего реактивный артрит, заболевание имеет общие характерные черты:
- Возникает спустя 2-4 недели после кишечной, урогенитальной или респираторной инфекции.
- В процесс вовлекается чаще один сустав, реже – до шести. Это коленные, голеностопные, крестцово-подвздошные, межпозвоночные, межфаланговые сочленения с одной стороны.
- Пораженные суставы отекают, увеличиваются в объеме. Кожа над ними красная и горячая по сравнению с окружающими здоровыми тканями. Движения болезненны и резко ограничены. Возможно распространение воспаления на сухожилия, расположенные рядом с синовиальной сумкой.
- Возникновение артрита сопровождается выраженным нарушением общего состояния: повышением температуры тела, потливостью, головной болью, слабостью.
- Процесс в большинстве случаев заканчивается полным выздоровлением, но может возникнуть снова при повторных инфекциях.
↑
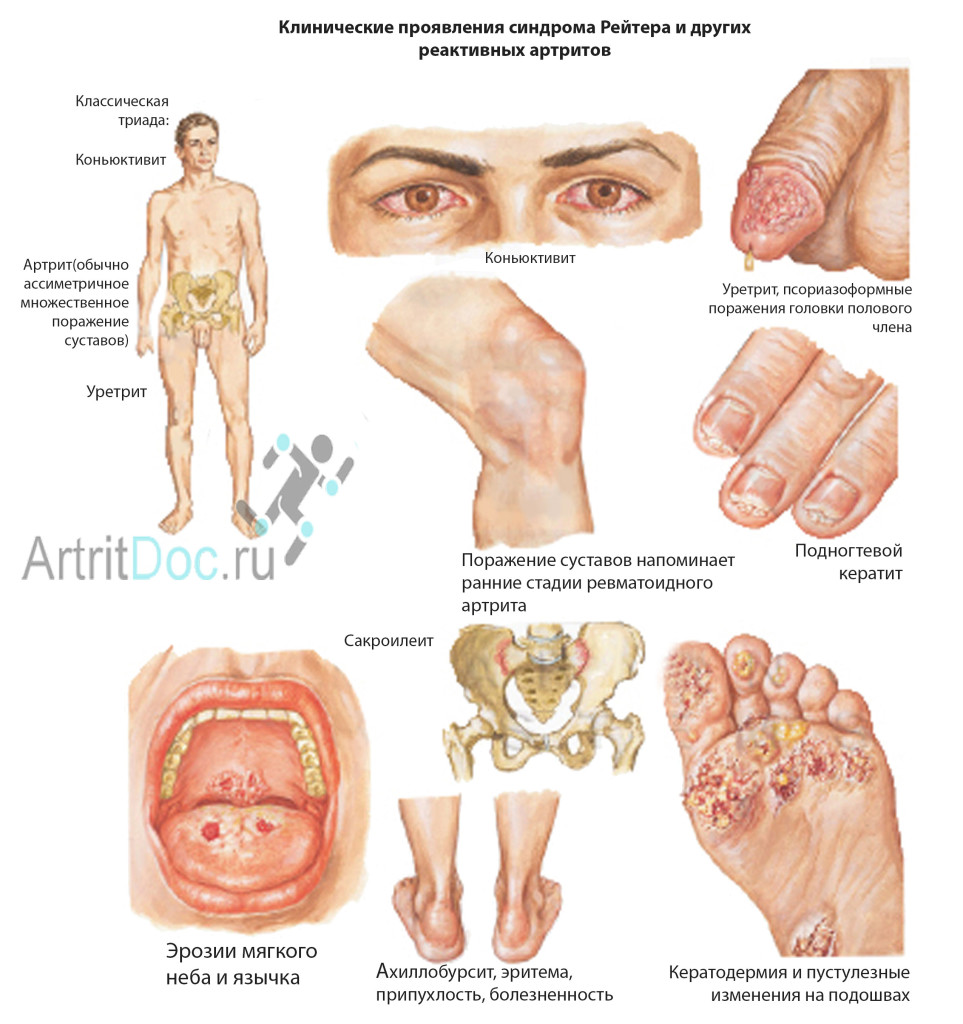
Другие специфические проявления реактивного артрита
Любой реактивный артрит может сопровождаться воспалением кожи, сердца, почек, плевры, регионарных лимфатических узлов, нервных стволов. Возможно появление эрозий на слизистой шейки матки, мочеиспускательного канала, полости рта.
Воспаление может возникать попеременно в разных суставах («летучие боли»), и никогда нет утренней скованности. Это в корне различает реактивный и ревматоидный артрит. При ревматоидном поражении суставов лечение реактивного артрита антибиотиками может резко ухудшить течение заболевания.
Реактивный артрит у детей, значительно реже — у подростков и у взрослых, может быть ранним симптомом ревматизма. Это грозное осложнение после перенесенной стрептококковой инфекции: ангины, стрептодермии, скарлатины, рожи. Опасность состоит в общности антигенной структуры микроба стрептококка с сердечными клапанами, нервными клетками и клубочками почек. Уже первая ревматическая атака может запустить формирование приобретенного клапанного порока сердца или тяжелого гломерулонефрита. Вот почему говорят, что «ревматизм суставы лижет, а сердце кусает».
Особо выделяют реактивный артрит – синдром Рейтера, когда иммунное воспаление суставов обязательно сочетается с поражением слизистой оболочки глаз (кератитом, иритом) и с воспалением мочеполовых органов (уретритом). Причиной заболевания служит чаще всего перенесенная дизентерия, а также длительное персистирование (сохранение) внутриклеточных форм хламидий или гонококков – возбудителей урогенитальной инфекции. Болезнь выявляется преимущественно у молодых людей.
↑
Способы диагностики недуга
Прежде чем будет назначено лечение, врач-ревматолог обязательно проводит тщательное обследование пациента. Это важно для определения возбудителя заболевания и степени активности патологического процесса, а также для выявления произошедшей поломки в иммунной системе. Доктору могут понадобиться:
- общий и биохимический (ревмопробы) анализ крови;

В оздоровительных целях уделяйте 15-20 минут гимнастическим упражнениям
- иммунограмма;
- определение титра антител к хламидиям, гонококкам, возбудителям кишечных инфекций;
- общий и микробиологический анализ мочи
- рентгенография суставов;
- пункционная биопсия с микробиологическим исследованием синовиальной жидкости;
- артроскопия;
- магнитно-резонансная томография.
- Результаты обследования помогут уточнить истинную природу поражения суставов, выбрать правильный диагноз из множества артритов и назначить эффективную терапию.
↑
Реактивный артрит – лечение
На период выраженного воспаления суставов назначается постельный режим. Щадящая двигательная активность рекомендуется вплоть до полного исчезновения болей, припухлости и ограничения объема движений. Из питания исключают высокоаллергенные продукты. При условии отсутствия осложнений со стороны сердца, почек или мочевыводящих путей никаких других диетических ограничений не требуется.
Медикаментозное лечение реактивного артрита включает:
- Курс антибиотиков (макролидов, фторхинолонов, цефалоспоринов, тетрациклинов) для уничтожения внутриклеточных форм патогенных микробов, поддерживающих активность воспаления.
- Подавление агрессивности иммунной системы с помощью специальных иммуносупрессивных лекарственных препаратов или глюкокортикоидных гормонов.
- Нестероидные противовоспалительные средства. Представители этой многочисленной группы снижают боль, ускоряют стихание местных воспалительных проявлений и улучшают общее самочувствие.
Необходима особая осторожность с препаратами из группы иммуномодуляторов и иммуностимуляторов. При реактивном артрите организм может дать на них непредсказуемую по эффекту реакцию, вплоть до усиления аутоиммунного воспаления суставов.
Источник
ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
- Авторы
- Резюме
- Файлы
- Ключевые слова
Пачкунова М.В.
У 80 больных ревматоидным артритом исследовано относительное и абсолютное содержание лимфоцитарных рецепторов CD3+, CD4+, CD8+, CD19+ крови, используя иммуноцитохимический субпопуляционный анализ лимфоцитов и уровень интерферона гамма сыворотки крови методом твердофазного иммунноферментного анализа. Проанализированы взаимосвязи между Т-,В-лимфоцитами и уровнем интерферона гамма крови. Определено состояние лимфоцитарных рецепторов и интерферона гамма крови в зависимости от степени активности ревматоидного артрита.
ревматоидный артрит
CD-рецепторы
интерферон гамма
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
В группе больных РА по сравнению с группой контроля определено достоверное снижение относительного содержания CD19+ (22,51±0,53 % и 24,63±1,0 % соответственно, р<0,05) без изменения их абсолютной численности (0,49±0,03*109 /л и 049±0,04*109 /л соответственно, р>0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
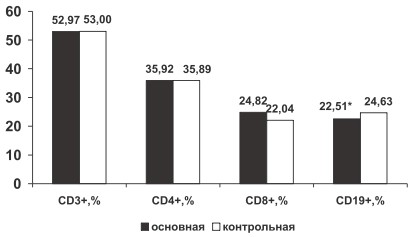
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р<0,05)
У больных РА по сравнению с группой здоровых лиц определена тенденция к росту абсолютного содержания молекулярных рецепторов лимфоцитов крови CD3+, CD4+, CD8+ (р>0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р<0,05).
Было исследовано состояние CD3+, CD4+, CD8+, CD19+ и IFNγ крови у больных РА в зависимости от активности воспалительного процесса. Относительное содержание изучаемых молекулярных рецепторов (р>0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
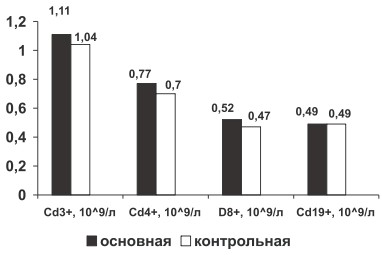
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Показатель | 1 группа здоровые n =25 | Степень активности | ||
2 группа 1 степень n =5 | 3 группа 2 степень n= 36 | 4 группа 3 степень n= 39 | ||
1 | 2 | 3 | 4 | 5 |
CD3 +,% | 53,0±0,99 | 55,4±2,58 р(2,1) >0,05 | 52,81±0,8 р(3,1) >0,05 р(3,2) >0,05 | 52,77±0,86 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD4 +,% | 35,89±1,23 | 35,2±1,93 р(2,1) >0,05 | 35,47±0,61 р(3,1) >0,05 р(3,2) >0,05 | 36,42±0,8 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD8 +,% | 23,74±0,95 | 23,6±2,58 р(2,1) >0,05 | 24,84±0,51 р(3,1) >0,05 р(3,2) >0,05 | 24,97±0,66 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD19 +,% | 24,63±1,0 | 21,8±2,17 р (2,1) >0,05 | 22,31±0,78 р (3,1) >0,05 р (3,2) >0,05 | 22,77±0,8 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
ИРИ CD4+%/ CD8+% | 1,54±0,07 | 1,55±0,19 р (2,1) >0,05 | 1,44±0,03 р (3,1) >0,05 р (3,2) >0,05 | 1,48±0,05 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD3 +,109/л | 1,04±0,09 | 1,06±0,18 р (2,1) >0,05 | 1,23±0,11 р (3,1) >0,05 р (3,2) >0,05 | 1,02±0,09 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD4 +,109/л | 0,7±0,06 | 0,66±0,1 р (2,1) >0,05 | 0,85±0,08 р (3,1) >0,05 р (3,2) >0,05 | 0,7±0,06 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD8 +, 109/л | 0,47±0,05 | 0,4±0,09 р (2,1) >0,05 | 0,57±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,49±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD19 +,109/л | 0,49±0,04 | 0,41±0,07 р (2,1) >0,05 | 0,53±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,46±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
IFNγ, пг/мл | 73,89±6,55 | 139,33±23,04 р (2,1) <0,05 | 191,58±31,03 р (3,1) <0,05 р (3,2) <0,05 | 319,53±68,46 р (4,1) <0,05 р (4,2) <0,05 р (4,3) <0,05 |
Примечания: р ‒ уровень значимости различия групп с соответствующими номерами, n ‒ количество обследованных
При 3-й степени активности РА по сравнению со 2-й степенью, несмотря на нарастание тяжести заболевания, наблюдается тенденция к снижению CD3+, CD4+, CD8+, CD19+ и нарастанию ИРИ, что, вероятно, свидетельствует о срыве компенсаторных реакций и нарастании иммунодефицита (р>0,05).
При всех степенях активности РА по сравнению с нормой определено достоверное увеличение уровня IFNγ (p <0,05, таблица), что, вероятно, связано с воздействием этого существенного показателя аутоиммунизации на развитие и прогрессирование заболевания. У больных РА по мере повышения степени активности РА выявлено закономерное увеличение содержания IFNγ крови (p<0,05, таблица). Мы считаем, что это связано с нарастанием процессов иммунного воспаления по мере усиления активности РА.
При проведении корреляционного анализа нами обнаружена прямая взаимосвязь между активностью воспаления у больных РА, с одной стороны, и IFNγ, с другой,
(r= 0,27, p<0,05). Не выявлены корреляционные взаимосвязи между активностью воспаления при РА и относительным и абсолютным содержанием изучаемых молекулярных рецепторов (р>0,05). Мы считаем, что динамика клеточных субпопуляций лимфоцитов не отражает напрямую активности иммуновоспалительного процесса.
Был проведен корреляционный анализ между показателями лимфоцитарной и цитокиновой систем при РА. Выявлены прямые корреляционные связи между относительным содержанием CD3+%, с одной стороны, и относительным содержанием CD4+% (r=0,56, p<0,0001), CD8+% (r=0,38, p<0,01), с другой, как и между CD4+%, с одной стороны, и CD8+% (r=0,31, p<0,03) и ИРИ (r=0,37, p<0,01), с другой. Определена обратная сильная корреляция между CD8+%, с одной стороны, и ИРИ (r= -0,75, p<0,001), с другой. Определена умеренная обратная корреляционная связь между ИРИ, с одной стороны, и CD19+% (r= -0,32, p<0,03), с другой, что свидетельствует об увеличении миграции В-лимфоцитов в очаг воспаления при снижении относительного содержания цитотоксических лимфоцитов в периферической крови. Выявлены высокодостоверные прямые корреляционные связи между абсолютным содержанием изучаемых молекулярных рецепторов: CD3+, с одной стороны, и CD4+, CD8+, CD19+ (r=0,9, p<0,0001), с другой, как и между CD4+ с одной стороны, и CD8+, CD19+ (r= 0,9, p<0,0001) с другой, и между CD8+, с одной стороны и CD19+ (r=0,9, p<0,0001), с другой. Таким образом, обнаруженная выраженная зависимость между лимфоцитарными рецепторами свидетельствует об имеющемся взаимном влиянии Т- и В- лимфоцитов. Т-хелперы посредством когнатной помощи и путем выработки IFNγ влияют на дифференцировку В-лимфоцитов в плазматические клетки, антителопродукцию, способствуют созреванию цитотоксических лимфоцитов, активируют макрофаги. В-лимфоциты способны презентировать антигены Т-клеткам, активировать аутореактивные CD4+, CD8+ лимфоциты, продуцировать провоспалительные цитокины. CD8+ лимфоциты осуществляют основной клеточный механизм иммунорегуляции, оказывая ингибирующее влияние на Т-хелперы как путем контактных взаимодействий, так и через выделение гуморальных факторов. Выявлена умеренная прямая корреляционная связь между абсолютным содержанием CD19+с, одной стороны, и IFNγ крови (r= 0,36, p<0,01), с другой, что объясняется усилением дифференцировки В-лимфоцитов, их превращением в плазматические клетки с последующим синтезом антител под действием IFNγ.
Выводы
Таким образом, у больных РА имеет место активация лимфоцитарной системы, сопровождающаяся миграцией В-лимфоцитов из периферической крови в очаг воспаления и нарушением функции цитотоксических лимфоцитов. При 3-й степени активности заболевания по сравнению со 2-й, определена тенденция к снижению абсолютного содержания лимфоцитарных рецепторов, вероятно, вследствие нарастания иммунодефицита. Выявлено взаимное прямое влияние между Т- и В-лимфоцитами у больных РА. Миграция В-лимфоцитов из периферической крови в очаг воспаления увеличивается при снижении относительного содержания CD8+ крови. Увеличение уровня IFNγ крови приводит к увеличению содержания в крови абсолютного содержания В-лимфоцитов.
Достоверное повышение уровня IFNγ в сыворотке крови больных РА по сравнению с контрольной группой является, вероятно, признаком дисрегуляции с избыточными иммунными реакциями и последующим нарушением функции клеток общевоспалительного назначения. Концентрация IFNγ достоверно связана с активностью воспалительного процесса. Определение уровня IFNγ может быть использовано в качестве информативного критерия для определения степени активности РА с последующей перспективой применения антител к IFNγ.
Список литературы
- Лукина Г.В. Перспективы антицитокиновой терапии ревматоидного артрита // Вестник Российской академии медицинских наук. ‒ 2003. ‒ №.7. ‒ С.23-27.
- Насонова В.А., Лукина Г.В., Сигидин Я.А. Нейтрализация ИФ-γ ‒ новое направление в терапии ревматоидного артрита // Терапевтический архив. ‒ 2008. ‒ Т. 80, №. 5. ‒ С. 30-37.
- Олюнин Ю.А., Балабанова Р.М. Комбинированная иммуномодулирующая терапия ревматоидного артрита // Терапевтический архив. ‒ 1996. ‒ Т.68, №5. ‒ С. 13-16.
- Порядин П.В., Казимирский А.Н. Иммунная система и воспаление // Сборник трудов 5-го конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». ‒ Т.1. ‒ М., 2002. ‒ С. 269-280.
- Ревматология, национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. ‒ М.: ГЭОТАР-Медиа, 2008. ‒ 714 с.
- Сучков С.В., Хитров А.М., Наумова Т.Е. и др. Современная модель патогенеза ревматоидного артрита и её место в клинической практике // Терапевтический архив. ‒ 2004. ‒ Т. 76, № 12. ‒ С. 83-87.
- Bank I., Coheu L., Monallem M. T cell subsets in patients with arthritis and chronic neutropenia // Ann Rheum Dis. ‒ 2002. ‒ Vol.61, №5. ‒ Р. 438-443.
- Dolhain R.J., ter Haar N.T., Hoefakker S. Increased expression of interferon (IFN)-gamma together with IFN-gamma receptor in the rheumatoid synovial membrane comparedwith synovium of patients with osteoarthritis // Br J Rheumatol. ‒ 1996. ‒ Vol. 35, № 1. ‒ Р. 24-32.
- Klimiuk P.A., Sierakowski S., Latosiewicz R et al. Mistological patterns of synovitis and serum chemokines in patients with rheumatoid arthritis // J Rheumatol. ‒ 2005. ‒ Vol. 32, №9. ‒ P. 1666-1672.
Рецензент:
Кратнов Андрей Евгеньевич, д.м.н., профессор, зав. кафедрой терапии педиатрического факультета Ярославской государственной медицинской академии.
Библиографическая ссылка
Пачкунова М.В. ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Фундаментальные исследования. – 2011. – № 1. – С. 148-156;
URL: https://fundamental-research.ru/ru/article/view?id=15821 (дата обращения: 15.01.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


