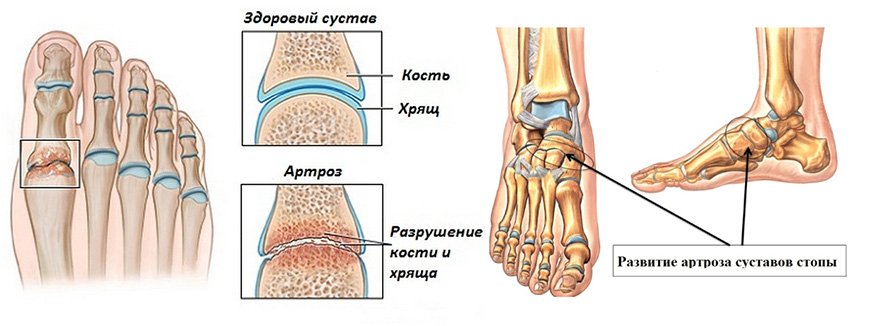
Иммунотерапия при ревматоидном артрите
За последние два десятилетия было сделано много улучшений в лечении ревматоидного артрита (РА). Исследователи теперь считают, что иммунотерапия при ревматоидном артрите является одним из лучших способов предотвращения прогрессирования заболевания. Иммунотерапия и ее несколько форматов существенно останавливают реакцию иммунной системы пациента на атакующую здоровую суставную ткань.
Не позволяя иммунной системе вызывать воспаление, иммунотерапия помогает пациентам с ревматоидным артритом испытывать больший период не активности или ремиссии. При меньшем числе активных состояний симптомов заболевания, пациенты с РА могут продолжать жить высокого качества жизни и испытывать меньшую хроническую боль. Методы диагностики РА.
Что такое иммунотерапия при ревматоидном артрите
При РА иммунная система организма активируется, чтобы атаковать здоровую суставную ткань. Эти приступы вызывают воспаление и вызывают хроническую боль и другие тяжелые симптомы. Стремясь остановить аутоиммунные атаки у пациентов с РА, исследователи разработали методы иммунотерапии, которые защищают организм от собственных атак, прерывая аутоиммунные реакции.
Иммунотерапевтические процедуры, называемые модификаторами биологического ответа, являются одними из наиболее эффективных лекарств, используемых для профилактики иммунных приступов у пациентов с ревматоидным артритом. Они являются частью типа лекарств, называемых анти — ревматическими препаратами, модифицирующими болезнь, и часто используются как можно раньше на курсе болезни.
Исследования показали, что чем раньше может начаться агрессивное лечение иммунотерапией, тем лучше будет перспектива для пациента. Лечение иммунотерапией может предотвратить прогрессирование заболевания до такой степени, когда потребуется хирургическая операция, и на карту поставлена мобильность. Медикаментозное лечение.
Как работает иммунотерапия при ревматоидном артрите
Ревматоидная артритная иммунотерапия или биологическая терапия работает путем лечения или восстановления иммунной системы организма, чтобы она могла бороться с инфекцией или болезнью. Препараты иммунотерапии принимают части иммунной системы и лечат участников аутоиммунного заболевания.
Во многих иммунотерапиях применяются модификаторы биологического ответа, которые являются естественными веществами, продуцируемыми организмом в ответ на инфекцию и заболевание. Лабораторная технология может производить эти модификаторы биологического ответа и вводить их в большем количестве пациентам, борющимся с такими заболеваниями, как ревматоидный артрит.
Биологические препараты могут вступать в силу в разные промежутки времени. Некоторые биологические препараты начинают работать быстро, в то время как другие могут занять недели или даже месяцы. Время отклика полностью зависит от конкретного пациента. В зависимости от времени ответа врачи могут назначать другие препараты в сочетании с биологическими препаратами для уменьшения воспаления и облегчения боли.
Когда используется иммунотерапия
Модификаторы биологического ответа, часто используются, когда у пациентов возникают проблемы с традиционными базовыми противоревматическими препаратами (БПРП). Традиционные БПРП могут работать не так, как ожидалось, для всех пациентов и иногда вызывать побочные эффекты.
Некоторые из проблем, с которыми сталкиваются пациенты с традиционными БПРП, включают:
- Серьезные побочные эффекты, такие как проблемы с печенью. Базисные противоревматические препараты.
- Низкий допуск для БПРП, таких, как метотрексат.
- Только метотрексат недостаточно эффективен и будет сильнее в сочетании с биологией.
- Опасения по поводу воздействия метотрексата и другими базисными препаратами может воздействовать на беременность.
Поскольку биологические исследования представляют собой новый класс иммунотерапии ревматоидного артрита, часто пациентам назначают как можно скорее традиционные БПРП, а затем проводят биологические процедуры.
Как проводится иммунотерапия
Большинство препаратов для лечения ревматоидного артрита назначают пациентам путем инъекции. Инъекции производятся либо под кожу, либо непосредственно в вену.
Есть несколько новых вариантов терапии ревматоидного артрита, которые можно принимать перорально. Этот препарат иммунотерапии известен как ингибитор JAK, который нацелен на специфический путь фермента в иммунной системе, чтобы препятствовать аутоиммунным атакам.
Типы иммунотерапии.
В настоящее время существует множество различных биологических препаратов. Каждый из них модифицирует иммунную систему пациента в какой-то степени, чтобы прекратить атаки на суставную ткань. Вот некоторые из форматов препаратов для лечения РА и как они действуют:
- Анти-ФНО (фактор некроза опухоли).
- Ингибиторы активации Т-клеток (Т-лимфоциты).
- Ингибиторы JAK (Janus kinase).
- В — клеточные ингибиторы.
- Ингибиторы интерлейкина.
Вот некоторые из доступных биологических препаратов для пациентов с ревматоидным артритом, а также их фирменные наименования:
- Тоцилизумаб.
- Этанерцепт.
- Адалимумаб.
- Анакина.
- Инфликсимаб.
- Ритуксимаб.
- Голимумаб.
- Тофацитиниб. Эфирные масла при ревматоидном артрите.
Часто пациенты будут иметь положительные результаты при приеме определенного вида биологических препаратов только для того, чтобы остановить. В этом случае может потребоваться перейти на другую форму препарата для лечения ревматоидного артрита. Это может быть довольно распространенным явлением и является частью процесса поиска соответствующей стратегии лечения.
Результаты иммунотерапии
Доказано, что иммунотерапия, подобная модификаторам биологического ответа, очень эффективна при лечении многих пациентов с ревматоидным артритом.
Вот некоторые из положительных ожидаемых результатов использования модификаторов биологического ответа для лечения РА:
- Замедление прогрессирования повреждения суставов.
- Остановить дальнейший совместный ущерб.
- Достижение ремиссии.
- Уменьшить боль и жесткость.
- Избегайте болезненных и рискованных операций по замене суставов.
Важно знать, что, как и любые БПРП, Иммунотерапия при ревматоидном артрите, такая как биологические, ослабляет иммунную систему. Это оставляет пациента восприимчивым к инфекциям, поэтому важно осознавать любые признаки болезни, такие как лихорадка, озноб, тошнота и мышечные боли. Поскольку биологические препараты обычно вводят путем инъекций, также возможно, чтобы у пациентов развилось раздражение кожи в месте инъекции.
Побочные эффекты зависят в основном от конкретного пациента, а также от форм биологических препаратов. В то время как побочные эффекты могут быть неудобством во многих случаях, наиболее важным аспектом лечения ревматоидного артрита является то, чтобы контролировать болезнь и защищать общее самочувствие пациента.
Источник
Принципиально новым направлением в лечении РА, особенно его резистентных форм, является антицитокиновая терапия. В частности, отмечен хороший клинический эффект при применении антител к ФНО — а, ИЛ-1р и у — ИНФ. В то же время назначение больным с РА рекомбинантных форм а — ИНФ (интрона — А, реаферона, виферона, роферона — А) и у — ИНФ (инфлагенома, полиферона) в комбинации с НПВП и базисными препаратами также оказывало положительный клинический эффект, проявляющийся уменьшением длительности утренней скованности, числа воспаленных суставов, а также снижением иммунологической активности заболевания. Существует несколько схем применения препаратов ИФН при РА:
— 3 000 000 ME внутримышечно через день в течение 1месяца, затем в последующие 2 месяца — 1 раз в неделю;
— 3 000 000 ME внутривенно через день, 10 инъекций, а затем в качестве поддерживающей терапии 1 раз в неделю внутримышечно;
— пульс-терапия: 3 000 000 ME внутривенно 3 дня подряд с интервалом 1 месяц.
Следует подчеркнуть, что проведение только одного курса терапии этими препаратами во многих случаях оказывалось недостаточно эффективным, в то же время у 87,8% больных с РА, получавших повторные курсы интерферонотерапии, удавалось стабилизировать течение заболевания с достижением клинико-лабораторной ремиссии или улучшения. При введении рекомбинантных интерферонов, как и при использовании других биологических препаратов, во многих случаях наблюдались различной интенсивности побочные реакции в виде лихорадки, мышечных болей, общей слабости и сонливости.
Перспективным направлением терапии РА является использование в комплексе с НПВП и базисными препаратами также индукторов интерферона, в частности, циклоферона. Препарат обладает широким спектром биологической активности, оказывая противовоспалительный, противовирусный и иммуномодулирующий эффекты. Основными клетками-продуцентами ИНФ после введения циклоферона являются моноциты — макрофаги, Т — и В — лимфоциты.
Препарат выпускается в виде 12,5% водного раствора в ампулах по 2 мл. Назначается внутримышечно по 2 мл двумя курсами по 5 дней с интервалом в 5-7 дней. Хорошо переносится больными, побочного действия при применении не выявлено.
Осложнения базисной терапии
При применении базисных препаратов существует риск развития различных гематологических осложнений, и, в частности, угнетения гемопоэза при длительном их использовании без должного врачебного контроля. При лечении препаратами золота, D-пеницилламином, цитостатиками и циклоспорином А возможно развитие апластической анемии, парциальной красно — клеточной аплазии, нейтропенических состояний и инфекционных осложнений, нередко заканчивающихся летально. Другие побочные эффекты менее значимы, однако также являются одной из причин отмены базисных препаратов.
По результатам собственных исследований, полученных при обследовании 283 больных РА, различные побочные эффекты базисной терапии наблюдались у 32,9% больных. Наиболее часто диагностировались диспепсические расстройства (тошнота, рвота, боли в эпигастральной области), аллергические проявления, а также изменения со стороны периферической крови и мочи.
Функциональные нарушения со стороны желудочно — кишечного тракта у обследованных пациентов развивались на фоне приема салазопиридазина, метотрексата и хлорбутина. При появлении диспепсических расстройств больным назначалась симптоматическая терапия (мотилиум, церукал) и изменялся режим приема препарата, при возникновении энтерита цитостатический препарат отменялся. У ряда больных на фоне приема метотрексата отмечалось появление язв на слизистой оболочке щек, что также потребовало отмены препарата с последующим назначением другого базисного средства.
Развитие аллергического дерматита зафиксировано у 12,9%больных РА на фоне кризотерапии, приема салазопиридазина и хлорбутина. Лекарственная нефропатия у больных РА также наиболее часто развивалась на фоне кризотерапии.
У 9,7% больных РА цитостатическая терапия спровоцировала обострение очагов хронической инфекции, при этом наиболее часто инфекционный процесс локализовался в ЛОР — органах (синусит, гайморит, тонзиллит), зубах (пульпит, периодонтит) и желчном пузыре (холецистит). Таким больным проводилась антибактериальная терапия с последующей санацией очагов хронической инфекции
У 16,1% больных с PA наблюдался гепатотоксический эффект цитостатической терапии, что проявлялось развитием диспепсических расстройств (тошноты, горечи и металлического привкуса во рту), повышением уровня печеночных ферментов (АлАТ, АсАТ, у — глутамилтранспептидазы, лейцинаминопептидазы), щелочной фосфатазы, а также содержания общего билирубина. Наиболее часто изменение биохимических показателей крови наблюдалось при применении метотрексата, циклофосфана и сочетанной химиотерапии.
Как известно, иммуносупрессивный эффект цитостатиков реализуется через повреждение быстро пролиферирующих иммунокомпетентных клеток. Вместе с тем в некоторых тканях наблюдается постоянная высокая пролиферативная клеточная активность (миелоидная и лимфоидная ткани, эпителий извитых семенных канальцев, волосяные фолликулы и др.), в связи с чем при применении цитостатических средств существует риск их повреждения.
Таким образом, токсичность цитостатиков — это следствие их недостаточной избирательности в отношении пролиферирующих клеток. При этом многие проявления токсичности различных цитостатических средств сходны, однако в зависимости от специфики действия препарата и особенностей его метаболизма тот или иной фактор в определенных условиях приобретает ведущее значение. Одним из наиболее частых гематологических осложнений у больных с РА является цитопенический синдром.
Развитие гематологических нарушений существенно ограничивало их дальнейшее использование. Для оценки гематологической токсичности мы пользовались шкалой токсичности, предложенной Европейской Организацией Изучения и Лечения Рака — EORTC.
Снижение количества лейкоцитов периферической крови на фоне цитостатической терапии было зафиксировано у 18,3%больных с РА, при этом первая степень гематологической токсичности наблюдалась в 41,2% случаев, вторая и третья — в17,6% и четвертая степень токсичности — в 23,6%. Следует отметить, что третья и четвертая степени гематологической токсичности развилась у больных с сочетанием РА и онкогематологического заболевания после проведения полихимиотерапии.
Лейкопения, как проявление миелосупрессии, при приеме цитостатических препаратов развивается наиболее часто. Это связано с тем, что клетки-предшественники нейтрофильных гранулоцитов имеют короткий период полужизни (6-12 ч), и, как результат, гранулоцитарный росток подавляется цитостатиками раньше и в большей степени, чем другие ростки гемопоэза. Период полужизни тромбоцитов значительно больше (5-10 дней) и постцитостатическая тромбоцитопения развивается в 3-4 раза реже, чем лейкопения.
У 12 больных РА наблюдались двух — и трех ростковые цитопении, при этом у 4 больных с РА была диагностирована гипоплазия костного мозга (у 3 больных на фоне приема хлорбутина в дозе 6 мг/сут в течение 2-6 месяцев, одна больная длительно принимала азатиоприн в дозе 150 мг/сут). Диагноз был подтвержден результатами цитологического и гистологического исследования костного мозга.
Развитие эозинофилии у обследованных больных РА было связано с назначением препаратов золота и салазопроизводных, при этом содержание эозинофилов периферической крови колебалось от 12%до 24%. Высокая эозинофилия всегда требует проведения дифференциального диагноза с лейкемоидной реакцией по эозинофильному типу.
Анемический синдром, развивающийся в результате подавления цитостатиками созревания костномозговых клеток-предшественников эритропоэза, теоретически также может встречаться у больных, получающих базисную терапию, однако он обычно не имеет клинического значения, так как продолжительность жизни эритроцитов составляет в среднем 120 дней. Более вероятной причиной анемии у больных РА может быть прямое токсическое действие цитостатических препаратов на костномозговое микроокружение, принимающее непосредственное участие в регуляции гемопоэза.
В связи с частым развитием гематологической токсичности у больных РА, принимающих цитостатические препараты, важным является вопрос их ранней диагностики. При этом сами больные, длительно получающие иммуносупрессивную терапию, должны быть ознакомлены с признаками и симптомами возможных осложнений (инфекции, кровоизлияния и др.), а также проинструктированы о срочном обращении к врачу при их появлении.
Для своевременного выявления изменений со стороны периферической крови у обследованных больных обще клинический анализ крови мы проводили через каждые 10-14 дней после назначения иммуносупрессивного агента, затем этот период увеличивался до 1 месяца В случае развития у больных РА лейкопении, сдвига лейкоцитарной формулы влево, тромбоцитопении и др. цитостатический препарат отменялся и в необходимых случаях проводилось цитологическое (гистологическое) исследование костного мозга для более точной диагностики возникших нарушений. Это связано с тем, что изменения показателей периферической крови в некоторых случаях могут быть синдромами более тяжелых заболеваний (апластической анемии, анемии Фанкони, острого лейкоза и др.). Поздняя диагностика, а, следовательно, отсроченная терапия этих заболеваний существенно сказывается на их прогнозе.
Для профилактики инфекционных осложнений таким больным проводились стандартные организационные и гигиенические мероприятия (изоляция больного в бокс с кондиционированием воздуха и его стерилизацией кварцевой лампой; использование медперсоналом стерильного операционного белья и перчаток при посещении бокса и др.).
С первого дня госпитализации пациентам проводилась инфузионная дезинтоксикационная терапия и селективная деконтаминация кишечника (бисептол 480 мг 2 раза в сутки или таривид 400 мг в день + низорал 200 мг в день или нистатин 500мг 4 раза в сутки). При повышении у обследуемых больных температуры тела выше 38,5 °С исключалось развитие инфекционных осложнений, для чего выполнялась рентгенография органов грудной клетки, бактериоскопия мазков из зева, а также посевы крови, мокроты, мочи на микрофлору с определением чувствительности к антибиотикам.
При диагностировании инфекционных осложнений проводимая инфузионная и дезинтоксикационная терапия дополнялась назначением двух антибактериальных препаратов, вводимых внутривенно (гентамицин + цефазолин, клафоран гентамицин или другие комбинации в зависимости от результатов бактериологического исследования крови и мочи), трансфузией компонентов крови и симптоматической терапией.
Бактериальные осложнения мы классифицировали как клинически или микробиологически идентифицированную локальную инфекцию или не идентифицированную инфекцию (при наличии симптомов системной реакции на инфекцию, прежде всего повышения температуры тела более 38,5°С, необъяснимой течением основного заболевания и проводимым лечением, и отсутствии признаков локальной инфекции и бактериального сепсиса).
После нормализации показателей периферической крови больному рекомендовалось возобновить прием цитостатического препарата или же ему назначался базисный препарат с другим механизмом действия с обязательным проведением клинико-лабораторного мониторинга.
В заключение еще раз необходимо акцентировать внимание на том, что цитостатическая терапия, проводимая больным РА, достаточно часто сопровождается развитием побочных эффектов, в том числе нарушением клеточного состава периферической крови, вплоть до развития агранулоцитоза и гипоплазии костного мозга. Опасность нейтропенических состояний заключается в высоком риске развития инфекционных осложнений, частота которых значительно увеличивается при развитии агранулоцитоза. С учетом этих данных назначение цитостатических препаратов больным РА рекомендуется проводить после углубленного стационарного обследования с последующим постоянным клинико-лабораторным контролем. При возникновении гематологических осложнений больные должны быть осмотрены врачом-гематологом и при необходимости госпитализированы в специализированный стационар для проведения адекватной терапии.
Осложнения глюкокортикоидной терапии.
Ревматоидный артрит, как системное заболевание, ассоциируется с высоким риском развития системного остеопороза, при этом терапия ГКС является дополнительным фактором этого процесса. Большинство авторов считают, что применение малых доз ГКС (менее 10 мг/день) не только способствует более быстрому снижению минеральной плотности кости, но и увеличивает риск возникновения компрессионных переломов тел позвонков. Причем динамический контроль за данной категорией пациентов показывает, что наибольшие потери костной массы наблюдаются в первые 6 месяцев от начала глюкокортикоидной терапии с последующим замедлением этого процесса. По результатам собственных исследований, у больных РА, не получавших ГКС, остеопенический синдром наблюдался в 38%случаев, а остеопороз — в 16%, в то время как у пациентов, принимающих преднизолон в дозе 5-10 мг/сут, эти показатели составляли соответственно 40% и 30%. Отсутствие различий в частоте развития остеопении у этих групп больных РА, вероятно, связано с тем, что основными причинами снижения минеральной плотности костей у данной категории пациентов являются системный воспалительный процесс и поражение суставов. Увеличение частоты развития остеопороза у больных РА, получающих ГКС, можно объяснить дополнительным влиянием последних на минеральный обмен и метаболизм костной ткани в целом. Так, у больных с РА на фоне лечения преднизолоном увеличивалась экскреция кальция с мочой, что постепенно приводило к развитию гипокальциемии. Установлена также прямая корреляционная связь между длительностью приема ГКС и выраженностью гипокальциемии. Необходимость ранней профилактики системного остеопороза при РА диктуется высоким риском переломов костей скелета у больных, длительно принимающих ГКС. Так, из 300 опрошенных больных с РА, когда-либо принимавших ГКС в течение 6 месяцев и более, у 7% в анамнезе имелись переломы различных костей скелета (ключицы, ребер, лучевой кости в типичном месте, лодыжки) без учета компрессионных переломов тел позвонков, которые часто могут протекать бессимптомно. При этом в структуре профилактических мероприятий целесообразно выделить несколько направлений. Во-первых, это регулярная коррекция дозы ГКС для поддержания ее на минимальном уровне, контролирующем течение РА. При этом попытки использования альтернирующего способа приема ГКС не оправдали возложенных надежд. Во-вторых, больные с РА должны хорошо знать, что регулярные дозированные физические нагрузки способствуют не только профилактике развития тугоподвижности и контрактур суставов, но и непосредственно замедляют потерю костной массы. При этом длительность выполняемых пациентами комплексов упражнений должна составлять не менее 30-60 мин в день.
Третье направление — сбалансированное питание с включением в рацион продуктов с высоким содержанием кальция. Однако только с помощью диеты, как правило, не удается достичь адекватного потребления кальция больными РА, принимающими ГКС, так как средняя доза должна составлять около 1500 мг вдень. Это становится возможным (четвертое направление) при использовании медикаментозных препаратов, содержащих соли кальция, кальцитонинов, бисфосфонатов, витамина D, а также заместительной гормональной терапии у женщин в постменопаузальном периоде
Больным РА, в комплексной терапии которых используется преднизолон в дозе 5-10 мг/сут в течение 6 месяцев и более, рекомендуется назначение активных метаболитов витамина D, в частности, оксидевита или Альфа — Оз — Тева в дозе 0,25 мгк утром и вечером. Если концентрация общего кальция в сыворотке крови не достигает средней нормальной величины в течение одного месяца, а суточная экскреция кальция не превышает 7,5 ммоль/сут, то суточная доза препарата увеличивается на 0,25 мкг. Применение оксидевита или препарата Альфа — Вз — Тева в комплексной терапии больных с РА приводит к улучшению минерализации костной ткани и способствует снижению повышенной костной резорбции, т. е. восстанавливает нарушенную метаболическую функцию костной ткани.
При уже развившемся остеопорозе показано назначение кальцитонинов, биологическое действие которых состоит в уменьшении выхода Са2+ из костей, подавлении активности остеокластов и угнетении остеолиза (миакальцик, сибакальцин, кальципгрин) или бисфосфонатов, обладающих способностью накапливаться преимущественно в местах костной резорбции и снижающих активность и число остеокластов (фосамакс, дидронел, ксидифон) Миакальцик назначают интраназально по 50 ME 2раза в день курсами по 3 месяца с 3-месячными перерывами под контролем остеоденситометрических исследований. Фосамакс принимают ежедневно внутрь натощак, за 30 мин до еды, в дозе10 мг длительными курсами под контролем содержания кальция в сыворотке крови Побочные действия этих препаратов относительно редки и слабо выражены тошнота, рвота, метеоризм, головокружение, аллергические кожные реакции.
Применение препаратов витамина D возможно как для профилактики стероидного остеопороза, так и для его лечения. Привлекательность такого подхода обосновывается тем, что основной механизм действия данного витамина направлен на нормализацию минерального обмена за счет усиления кишечной абсорбции кальция, которая нарушена вследствие приема ГКС. В частности, в рекомендациях по профилактике и лечению стероидного остеопороза, подготовленных рабочей группой Американской Коллегии по ревматологии, указано, что всем пациентам, которым ГКС назначены впервые или такая терапия уже проводится, необходимо одновременно рекомендовать прием препаратов кальция и витамина D, причем такая терапевтическая тактика не зависит от степени снижения минеральной плотности кости, определяемой при денситометрическом обследовании
Источник