Кардио артрит что это
Ревматоидный артрит — наиболее часто встречающаяся форма хронического воспалительного полиартрита. У 70% пациентов с ревматоидным артритом (РА) в крови выявляется ревматоидный фактор (РФ), чего, однако, недостаточно для диагноза «ревматоидный артрит», поскольку этот маркер достаточно часто встречается и при других заболеваниях, в т.ч. при хроническом вирусном гепатите и бактериальном эндокардите.
В настоящее время еще одним маркером, активно используемым в серологической диагностике ревматоидного артрита (РА), является уровень антител к циклическому цитруллинированному пептиду. Этот маркер обладает более высокой чувствительностью и специфичностью, поэтому его используют при дифференциальной диагностике у пациентов с неясной клинической картиной (у РФ-положительных пациентов с гепатитом С и артритом он не определяется).
Системные проявления ревматоидного артрита (РА): перикардит, плеврит, васкулит, периферическая полинейропатия, интерстициальное поражение легких, атеросклеротическое поражение сердца и сосудов, синдромы Sjogren и Felty. Отмечено также небольшое повышение частоты возникновения лимфом, что имеет значение при оценке риска развития у пациентов с РА лекарственно-индуцированных лимфопролиферативных заболеваний.
а) Эпидемиология. Распространенность РА составляет 1-3% в популяции. Заболевание встречается во всех возрастных группах, но более часто — среди женщин (> 2:1) в течение третьей или пятой декады жизни. У РФ-положительных пациентов или пациентов с HLA DR4 более вероятно развитие выраженных эрозивных изменений в суставах и внесуставных поражений.
б) Патогенез. Причина развития РА неизвестна. Существует генетическая предрасположенность к этому заболеванию, но она, по-видимому, полигенна. Не исключается триггерное влияние инфекционных факторов, однако конкретные инфекционные агенты так и не были выявлены в качестве основной причины заболевания.
Нарушение Т-клеточного иммунного ответа приводит к активации макрофагов, а провоспалительные цитокины, в т.ч. ФНО и ИЛ-1, поддерживают хронический воспалительный процесс, в результате чего нарушаются процессы ангиогенеза, пролиферации синовиальной ткани и костного ремоделирования.
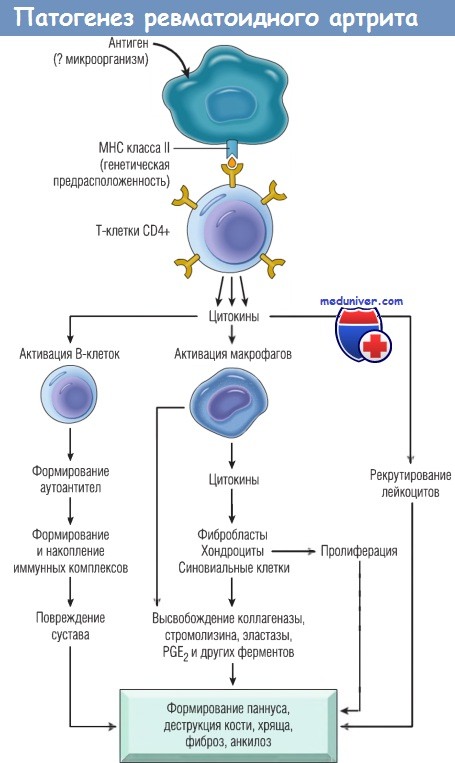
Иммунопатогенез ревматоидного артрита.
МНС — главный комплекс гистосовместимости;
PG — простагландин.
в) Клиническая картина. Ревматоидный артриит (РА) — это хронический симметричный полиартрит, при котором поражаются мелкие и крупные суставы, преимущественно пястно-фаланговые и лучезапястные. В патологический процесс могут вовлекаться и суставы грудного и поясничного отделов позвоночника, а также дистальные межфаланговые суставы. У большинства пациентов появляются характерные изменения в суставах, которые можно с помощью МРТ выявить на ранней стадии заболевания.
У 40% пациентов с РА в патологический процесс вовлекается перикард, что подтверждается результатами ЭхоКГ и аутопсий, причем более часто встречается бессимптомный хронический экссудативный перикардит, реже — острый. Вместе с тем при обследовании 41 амбулаторного пациента с тяжелым РА частота развития хронического экссудативного перикардита, сопровождающегося клинической симптоматикой, составила < 0,5%. До применения современных «агрессивных» терапевтических стратегий бессимптомная патология перикарда наблюдалась чаще.
Ревматоидный перикардит обычно развивается в пожилом возрасте и после длительного течения РА. У пациентов с хроническим ревматоидным перикардитом, как правило, нет отклонений на ЭКГ, однако при остром перикардите могут наблюдаться характерные изменения. Нередко перикардит сопровождается небольшим плевральным выпотом, являющимся проявлением ревматоидного серозита или самого перикардита. Также встречается кальцификация перикарда, которая, в свою очередь, может маскировать туберкулезный перикардит, что, впрочем, наблюдается нечасто.
О характере перикардиального выпота данных немного. В основном перикардиальный выпот описывают как жидкость кровянистого цвета, которая содержит лейкоциты > 30 000/мм3, обычно с преобладанием нейтрофилов. Уровень глюкозы в перикардиальной жидкости, как и в плевральном выпоте, может быть низким в сравнении с таковым в сыворотке крови. Присутствие РФ в перикардиальном выпоте не подтверждает ревматоидное происхождение перикардита.
Описаны случаи развития спаечного перикардита, который необходимо отличать от рестриктивной КМП (редкого осложнения вторичного амилоидоза у больных с длительным течением ревматоидного артрита (РА)).
Лечение клинически выраженного перикардита включает назначение НПВС, системной иммуносупрессивной терапии, инъекций ГКС в полость перикарда; в случае нарушения гемодинамики выполняют пункцию перикарда. Если системная терапия неэффективна или ее уже проводят достаточно интенсивно, пациентам с рецидивирующим экссудативным перикардитом может понадобиться фенестрация перикарда. При развитии констриктивного перикардита нужно хирургическое лечение.
Назначение «агрессивной» лекарственной терапии на ранних стадиях РА позволяет снизить частоту внесуставных проявлений РА, в т.ч. поражения перикарда.
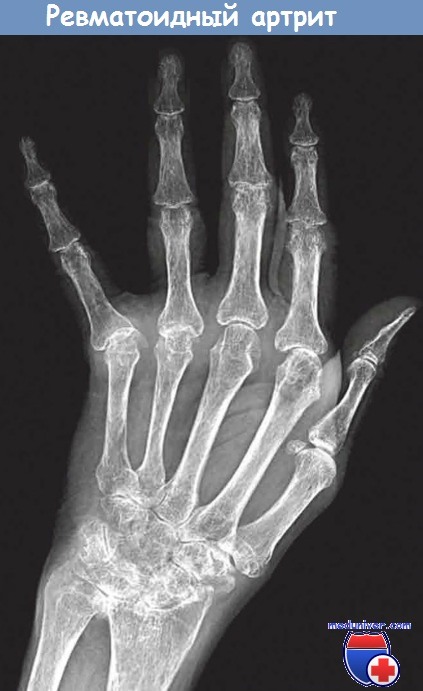
Ревматоидный артрит.
Диффузная остеопения, выраженное сужение межсуставных щелей запястных, пястных,
фаланговых и межфаланговых суставов, перисуставные эрозии костей и ульнарная девиация пальцев.
Обычно РА не приводит к развитию клинически значимого миокардита, однако у больных с РА отмечается увеличение частоты ХСН. Вторичный амилоидоз, являющийся редким осложнением РА, может вызывать КМП и приводить к развитию АВ-блокады. При ревматоидном перикардите нередко наблюдаются различные тахиаритмии. В литературе также описаны случаи локального повреждения миокарда ревматоидными узелками, сопровождающиеся нарушениями проводимости сердца, например блокадой проведения импульса на разных уровнях, резистентной к противовоспалительной и иммуносупрессивной терапии.
Специалисты отмечают, что у больных РА увеличивается риск смерти и чаще возникает необходимость в госпитализации вследствие развития тяжелой ХСН. Однако в клинических исследованиях среди больных, получающих высокие дозы инфлексимаба (препарата, содержащего антитела к ФНО), таких пациентов не было. Подобные осложнения не наблюдались и при лечении стандартными дозами этанерсепта, блокирующего рецепторы ФНО и являющегося альтернативным препаратом.
При аутопсийных исследованиях отмечено частое вовлечение в патологический процесс клапанов сердца и Ао, но эти находки редко сопровождались клиническими проявлениями. Дело в том, что медленно прогрессирующий гранулематозный вальвулит сложно отличить от поражения клапанов, причиной которого не является РА. Однако в литературе описаны случаи быстро прогрессирующего аортального вальвулита с развитием выраженной аортальной регургитации, когда понадобилась замена клапана менее чем через 5 лет от начала заболевания.
Ревматоидный аортит, протекающий с вовлечением АК, также является нечастой находкой, в т.ч. и во время аутопсии. При РА не развивается первичная ЛГ, но вследствие ревматического поражения легких может появиться вторичная ЛГ.
У пациентов с РА отмечена более низкая продолжительность жизни, чем в популяции. Ведущая причина смерти — ССЗ, относительный риск развития которых как минимум в 2 раза выше, чем в сопоставимой по возрасту контрольной группе. Потенциальными ФР развития ИБС у пациентов с РА, ускоряющими развитие атеросклероза, являются хронический системный воспалительный процесс, увеличение фракции провоспалительных ЛВП, прием селективных и неселективных НПВС, ГКС и недостаточное использование аспирина. До сих пор до конца не изучен вклад этих факторов в ускорение развития ИБС, ее осложнений, в т.ч. и в возрастающую частоту развития ХСН.
Клинические проявления ИБС могут быть выражены слабо из-за низкой физической активности пациентов с тяжелыми проявлениями РА. Особое внимание следует уделять тем пациентам с РА, которым планируют некардиохирургические вмешательства. Согласно рекомендациям АНА, длительно протекающий РА необходимо рассматривать как дополнительный ФР при оценке общего предоперационного риска аналогично почечной недостаточности. Артериит КА является достаточно редким осложнением РА.
г) Дифференциальная диагностика ревматоидного артрита (РА). Ревматоидный артрит (РА) в отсутствие характерных рентгенологических изменений остается диагнозом исключения. Необходимо проводить дифференциальную диагностику с заболеваниями, сопровождающимися возникновением симметричного полиартрита мелких и крупных суставов, такими как хронические гепатиты В и С, СКВ, некоторые васкулиты (УП, гранулематоз Wegener) и кристаллические артропатии. При РА в ранней фазе или с острым началом нужна дифференциальная диагностика с бактериальным эндокардитом и такими инфекциями, как парвовирус или краснуха.
Болезнь Lyme (боррелиоз) может привести к заболеваниям проводящей системы сердца и сопровождаться развитием олигоартрита крупных суставов, что не характерно для РА.
д) Лечение. Современной стратегией лекарственного лечения РА является «агрессивная» базовая противовоспалительная терапия сразу после установления диагноза. Часто используют комбинации таких препаратов, как метотрексат, сульфасалазин, лефлуномид, гидроксихлорохин, с низкими дозами преднизона.
НПВС в настоящее время не являются основными лекарственными средствами в силу следующих причин: (1) не останавливают прогрессирование деструкции суставов; (2) прием ассоциируется с нарастанием риска желудочно-кишечных кровотечений; (3) постоянное использование ингибиторов ЦОГ-1 и ЦОГ-2 ведет к увеличению частоты развития ССО.
Антагонисты ФНО являются достаточно эффективными лекарственными средствами, однако их использование немного ограничивают их высокая стоимость и отсутствие сведений об отдаленных эффектах. Своевременное назначение эффективной терапии может ассоциироваться со снижением частоты возникновения внесуставных проявлений РА. Вызывает тревогу значительное увеличение частоты ССЗ и показателей смертности при использовании инфликсимаба у некоторых пациентов с тяжелым РА. В настоящее время нет четких рекомендаций по назначению антагонистов ФНО при СН, поэтому при назначении препаратов этого ряда необходимо проявлять особую бдительность.
В связи с увеличением частоты ССЗ среди пациентов с РА даже в отсутствие типичных ФР необходимо обращать внимание на образ жизни пациента, контролировать его АД и уровень ЛНП.
д) Список литературы:
1. Raza K, Thambyrajah J, Townsend JN, et al: Suppression of inflammation in primary systemic vasculitis restores vascular endothelial function: Lessons for atherosclerotic disease? Circulation 102:1470-1472, 2000.
2. deLeeuw K, Sanders J-S, Stegeman C, et al: Accelerated atherosclerosis in patients with Wegener’s granulomatosis. Ann Rheum Dis 64:753-759, 2005.
3. Kitas G, Banks MJ, Bacon PB: Cardiac involvement in rheumatoid disease. Clin Med 1:18-21, 2001.
4. Solomon DH, Karlson EW, Rimm EB, et al: Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis. Circulation 11:1307-1307, 2003.
5. Sarzi-Puttini P, Atzeni F, Shoenfeld Y, Ferraccioli G : TNF-a, rheumatoid arthritis, and heart failure: A rheumatological dilemma. Autoimmunity Rev 4:153-161, 2005.
— Читать «HLA-B27-ассоциированные спондилоартропатии в кардиологии: причины, диагностика, лечение»
Редактор: Искандер Милевски. Дата публикации: 11.3.2019
Оглавление темы «Васкулиты в кардиологии.»:
- Узелковый полиартериит в кардиологии: причины, диагностика, лечение
- Ревматоидный артрит в кардиологии: причины, диагностика, лечение
- HLA-B27-ассоциированные спондилоартропатии в кардиологии: причины, диагностика, лечение
- Системная красная волчанка (СКВ) в кардиологии: причины, диагностика, лечение
- Антифосфолипидный синдром (АФС) в кардиологии: причины, диагностика, лечение
- Склеродермия в кардиологии: причины, диагностика, лечение
- Полимиозит и дерматомиозит в кардиологии: причины, диагностика, лечение
- Саркоидоз в кардиологии: причины, диагностика, лечение
Источник
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
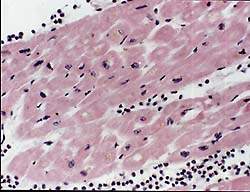 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
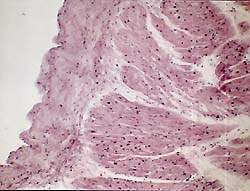 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник


