Новые рекомендации по лечению ревматоидного артрита eular 2013
1. Conn DL. Resolved: low-dose prednisone is indicated as a standard treatment in patients with rheumatoid arthritis. Arthritis Rheum. 2001;45(5):462–7. DOI: https://dx.doi.org/10.1002/1529-0131(200110)45:5%3C462::AID-ART366%3E3.0.CO;2-V.
2. Saag KG. Resolved: low-dose glucocorticoids are neither safe nor effective for longterm treatment of rheumatoid arthritis. Arthritis Rheum. 2001;45(5):468–71. DOI: https://dx.doi.org/10.1002/1529-0131(200110)45:5%3C468::AID-ART367%3E3.0.CO;2-A.
3. Moreland LW, O’Dell JR. Glucocorticoids and rheumatoid arthritis. Back to the future? Arthritis Rheum. 2002;46(10):2553–63. DOI: https://dx.doi.org/10.1002/art.10567.
4. Conn DL, Lim SS. New role for an old friend; prednisone is a disease-modifying agent in early rheumatoid arthritis. Curr Opin Rheumatol. 2003;15(3):193–8. DOI: https://dx.doi.org/10.1097/00002281-200305000-00004.
5. Насонов ЕЛ. Лечение ревматоидного артрита: роль глюкокортикоидов. Клиническая медицина. 1999;4:4–8. [Nasonov EL. Lechenie revmatoidnogo artrita: rol’ glyukokortikoidov. Klinicheskaya meditsina. 1999;4:4–8. (In Russ.)]
6. Pincus T, Sakka T, Stein CM. Are longterm very low doses of prednisolon for patients with rheumatoid arthritis as helpful as high doses are harmful? Ann Intern Med. 2002;136(1):76–8. DOI: https://dx.doi.org/10.7326/0003-4819-136-1-200201010-00013.
7. Bijsma JW, Boers M, Saag KG, Furst DE. Glucocorticoids in the treatment of early and late RA. Ann Rheun Dis. 2003;62(11):1033–7. DOI: https://dx.doi.org/10.1136/ard.62.11.1033.
8. Hench PS, Kendall EC, Slocumb CH, Polley HF. The effect of a hormone of the adrenal cortex (17-hydroxy-11-dehydrocortisone; compound E) and the pituitary adrenocorticotropic hormone on rheumatoid arthritis. Proc Staff Meet Mayo Clin. 1949;24:181.
9. Report by the Joint Committee of the Medical Research Council an Nuffield Foundation on Clinical Trials of cortisone? ACTH/ and other therapeutic measures in chronic rheumatic diseases. A comparison of prednisolone with aspirin or other analgesics in the treatment of rheumatoid arthritis [first report]. Ann Rheum Dis. 1959;18:173–87. DOI: https://dx.doi.org/10.1136/ard.18.3.173.
10. Report by the Joint Committee of the Medical Research Council an Nuffield Foundation on Clinical Trials of cortisone? ACTH/ and other therapeutic measures in chronic rheumatic diseases. A comparison of prednisolone with aspirin or other analgesics in the treatment of rheumatoid arthritis [second report]. Ann Rheum Dis. 1960;19:331–7. DOI: https://dx.doi.org/10.1136/ard.19.4.331.
11. Bollet AJ, Black R, Bunim JJ. Major undesirable effects resulting from prednisolone and prednisone. J Am Med Assoc. 1955;158(6):459–63. DOI: https://dx.doi.org/10.1001/jama.1955.0296006 0017005.
12. Saag KG, Criswell LA, Sems KM, et al. Low-dose corticosteroids in rheumatoid arthritis: a meta-analysis of their moderateterm effectiveness. Arthritis Rheum. 1996;39(11):1818–25. DOI: https://dx.doi.org/10.1002/art.1780391107.
13. Wolfe F, Mitchell DM, Sibley JT, et al. The mortality of rheumatoid arthritis. Arthritis Rheum. 1994;37(4):2529–33. DOI: https://dx.doi.org/10.1002/art.1780370408.
14. Van Gestel AM, Laan RF, Haagsma CJ, et al. Oral steroids as bridge therapy in rheumatoid arthritis patients starting with parenteral gold: a randomized double-blind placebo-controlled trial. Br J Rheumatol. 1995;34(4):347–51. DOI: https://dx.doi.org/10.1093/rheumatology/34.4.347.
15. Pincus T, Marcum SB, Callahan LF. Long-term drug therapy in rheumatoid arthritis in seven rheumatology ptivat practice: II. Second line drugs and prednisolone. J Rheumatol. 1992;19(12):1885–94.
16. Caplan L, Russell AS, Wolfe F. Steroids for rheumatoid arthritis: the Honeymoon revisited (once again). Editorial. J Rhematol. 2005;32(10):1863–5.
17. Gotzsche PC, Johansen HK. Meta-analysis of short-term low dose prednisolone versus placebo and non-steroidal anti-inflammatory drugs in rheumatoid arthritis. BMJ. 1998;316(7134):811–8. DOI: https://dx.doi.org/10.1136/bmj.316.7134.811.
18. Criswell LA, Saag KG, Sems KM, et al. Moderate-term, low-dose corticosteroids for rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue 2. Chichester, UK: John Wiley & Sons, Ltd.; 2004.
19. Gorter SL, Bijlsma H, Cutolo M, et al. Current evidence for the management of rheumatoid arthritis with glucocorticoids:
20. a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2010;69(6):1010–4. DOI: 10.1136/ard.2009.127332. Epub 2010 May 6.
21. Smolen J, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis. 2010;69(6):964–75. DOI: 10.1136/ard.2009.126532. Epub 2010 May 5.
22. Van Everdingen AA, Jacobs JW, Siewertsz van Reesema DR, et al. Low-dose prednosone therapy for patients with early active rheumatoid arthritis: clinical efficacy, diseasemodifying properties, and side effects: a randomized, double-blind, placebo-controlled clinical trial. Ann Intern Med. 2002;136:1–12. DOI: https://dx.doi.org/10.7326/0003-4819-136-1-200201010-00006,
23. Kirwan JR, Bijlsma JW, Boers M, et al. Effects of glucocorticoids on radiological progression in rheumatoid arthritis. Cochrane Database Syst Rev. 2007;(1):CD006356.
24. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 2014;73(3):492–509. DOI: 10.1136/annrheumdis-2013-204573. Epub 2013 Oct 25.
25. Buttgereit F, da Silva JA, Boers M, et al. Standartised nomenclature for glucocorticoids dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann Rheum Dis. 2002;61(8):718–22. DOI: https://dx.doi.org/10.1136/ard.61.8.718.
26. Gaujoux-Viala C, Nam JL, Ramiro S, et al. Efficacy of conventional synthetic disease-modifying antirheumatic drugs, glucocorticoids and tofacitinib — a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2014;73(3):510–5. DOI: 10.1136/annrheumdis-2013-204577. Epub 2014 Jan 7.
27. Bakker MF, Jacobs JW, Welsing PM, et al. Low-dose prednisone inclusion in a methotrexate-based, tight control strategy for early rheumatoid arthritis: a randomized trial. Ann Intern Med. 2012;156(5):329–39. DOI: 10.7326/0003-4819-156-5-201203060-00004.
28. Swensson B, Boonen A, Albertsson K, et al. Low-dose prednisolone in addition to the initial disease-modifying drug in patients with early active rheumatoid arthritis reduces joint destruction and increase the remission rate: a two-year andomized trial. Arthritis Rheum. 2005;52(11):3360–70. DOI: https://dx.doi.org/10.1002/art.21298.
29. Landewe RB, Boers M, Verhoeven AC, et al. COBRA combination therapy in patients with early rheumatoid arthritis: long-term structural benefits of a brief intervention. Arthritis Rheum. 2002;46(2):347–56. DOI: https://dx.doi.org/10.1002/art.10083.
30. Wassenberg S, Rau R, Steinfeld P, et al. Very low-dose prednisolone in early rheumatoid arthritis etard radiographic progression over two years: a multicenter, double-blind, placebo-controlled trial. Arthritis Rheum. 2005;52(11):3371–3380. DOI: https://dx.doi.org/10.1002/art.21421.
31. Goekoop-Ruiterman YP, De Vries-Bouwstra JK, Allaart CF, et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BEST study): a randomized, controlled trial. Arthritis Rheum. 2005;52(11):3381–90. DOI: https://dx.doi.org/10.1002/art.21405.
32. Heimans L, Wevers-de Boer KV, Visser K, et al. A two-step treatment strategy trial in patients with early arthritis aimed at achieving remission: the IMPROVED study. Ann Rheum Dis. 2013 May 28. [Epub ahead of print]. DOI: 10.1136/annrheumdis-20130203243.
33. De Silva JA, Jacobs JW, Kirwan JR, et al. Safety of low dose glucocorticoid treatment in rheumatoid arthritis: published evidence trial data. Ann Rheum Dis. 2006;65(3):285–93.DOI: https://dx.doi.org/10.1136/ard.2005.038638. Epub 2005 Aug 17.
34. Hoes JN, Jacobs JW, Boers M, et al. EULAR evidence-based recommendations on the management of systemic glucocorticoids therapy in rheumatic diseases. Ann Rheum Dis. 2007;66(12):1560–7. DOI: https://dx.doi.org/10.1136/ard.2007.072157. Epub 2007 Jul 27.
35. Ramiro S, Gaujoux-Viala C, Nam JL, et al. Safety of synthetic and biological DMARDs – a systematic literature review informing the 2013 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2013;73(3):529-35. DOI: 10.1136/annrheumdis-2013-204575. Epub 2014 Jan 8.
36. Dixon WG, Bansback N. Understanding the side effects of glucocorticoid therapy: shininh a light on a drug everyone thinks they know. Ann Rheum Dis. 2012;71(11):1761–4. DOI: 10.1136/annrheumdis-2012-202021. Epub 2012 Jul 31.
37. Volkman ER, Rezai S, Tarp S, et al. We still don’t` know how to taper glucocorticoids in rheumatoid arthritis, and we can do better. J Rheumatol. 2013;40(10): 1646–9. DOI: 10.3899/jrheum.130019.
38. Насонов ЕЛ, Каратеев ДЕ, Чичасова НВ. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая харак-
39. теристика и дискуссионные проблемы. Научно-практическая ревматология. 2013;51(6):609–22. [Nasonov EL, Karateev DE, Chichasova NV. EULAR recommendations for the treatment of rheumatoid arthritis – 2013: general characteristics and disputable problems. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2013;51(6):609–22. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2013-609-22.
40. Van Tuyl LYD, Boers M, Lems WF, et al. Survival, comorbidities and join damage 11 years after COBRA combination therapy trial in early rheumatoid arthritis. Ann Rheum Dis. 2010;69(5):807–12. DOI: 10.1136/ard.2009.108027. Epub 2009 May 17.
41. Graudal N, Jurgens G. Similar effects of disease-modifying antirheumatic drugs, glucocorticoids, and biologic agents on radiographic progression in rheumatoid arthrits. Meta-analysis of 70 randomized placebocontrolled or drug controlled studies, including 112 comparison. Arthritis Rheum. 2010;62(10):2852–63. DOI: 10.1002/art.27592.
42. Smolen JS, Aletaha D, Bijsma JWJ, et al. For the T2T Expert Committee. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis. 2010;69(4):631–7. DOI: 10.1136/ard.2009.123919. Epub 2010 Mar 9.
43. Wolfe F, Caplan L, Michaud K. Treatment for rheumatoid arthritis and the risk of hospitalisation for pneumonia: association with prednisone, disease-modifying drugs, anti tumor necrosis factor therapy. Arthrits Rheum. 2006;54(2):628–34. DOI: https://dx.doi.org/10.1002/art.21568.
44. Crowson CS, Hoganson DD, Fitz-Gibbon PD, Matteson EL. Development and validation of a risk score for serious infection in patients with rheumatoid arthritis. Arthritis Rheum. 2012;64(9):2847–55. DOI: 10.1002/art.34530.
45. Staa TP, Geusens P, Bijlsma JW, et.al. Clinical assessment of the long-term ris of fracture in patients with rheumatoid arthritis. Arthritis Rheum. 2006;54(10):3104–12. DOI: https://dx.doi.org/10.1002/art.22117.
46. Panoulas VF, Douglas KM, Stavropoulos-Kalinoglou A, et al. Long-term exposure to medium-dose glucocortocoid therapy associates with hypertension in patients with rheumatoid arthritis. Rheumatology (Oxford). 2008;47(1):72–5. DOI: https://dx.doi.org/10.1093/rheumatology/kem311.
47. Чичасова НВ, Владимиров СА, Имаметдинова ГР и др. Функциональные исходы ревматоидного артрита при различных видах противовоспалительной терапии. Научно-практическая ревматология. 2010;48(2):30–6. [Chichasova NV, Vladimirov SA, Imametdinova GR, et al. Functional outcomes of rheumatoid arthritis during various proceduresof anti-inflammatory therapy. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2010;48(2):30–6. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2010-1413.
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
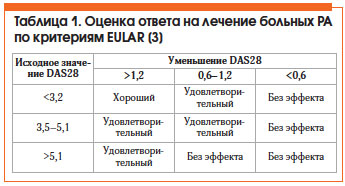
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

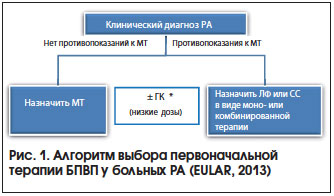
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
III. Пациент с поздним РА и остеопоротическими переломами
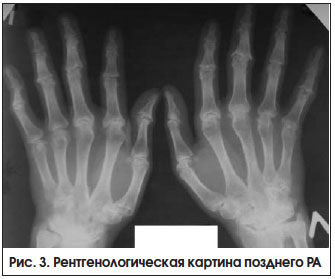
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
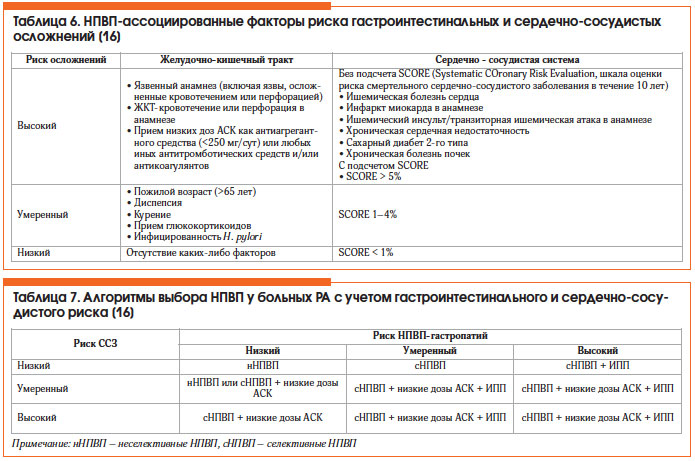
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник


