Проект рекомендаций по лечению ревматоидного артрита
Ревматоидный артрит – тяжелое аутоиммунное заболевание суставов. Клинические рекомендации по диагностике, лечению, реабилитации и профилактике.
 Ревматоидный артрит – ревматическое аутоиммунное заболевание, предпосылки которого остаются неизвестными современной медицине.
Ревматоидный артрит – ревматическое аутоиммунное заболевание, предпосылки которого остаются неизвестными современной медицине.
Патология проявляется хроническим эрозивным артритом и системным поражением внутренних органов.
Все это зачастую становится причиной ранней инвалидности и сокращения продолжительности жизни больных.
Диагнозы РА по классификации МКБ-10:
M05 Серопозитивный ревматоидный артрит
M06 Другие ревматоидные артриты
Рассмотрим, что такое ревматоидный артрит, клинические рекомендации по его диагностике и лечению.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
Ревматоидный артрит: клинические рекомендации
Клинические рекомендации по ревматоидному артриту были приняты Российской Ассоциацией ревматологов в 2018 году. Они будут действительны еще в течение 4 лет.
Разработана следующая клиническая классификация РА:
- Ревматоидный артрит серопозитивный.
- Ревматоидный артрит серонегативный.
- Ревматоидный артрит вероятный.
- Особые клинические формы ревматоидного артрита:
- Синдром Фелти;
- Болезнь Стилла взрослых.
Серопозитивность и серонегативность ревматоидного артрита зависит от обнаружения ревматоидного фактора и/или антитела циклическим цитруллинированным белкам (АЦБ), для выявления которых применяются стандартизированные лабораторные методики.
✔ Классификационные критерии ревматоидного артрита, таблица в Системе Консилиум.

Скачать таблицу
Диагностика по клинрекомендациям
Манифестация заболевания вариативна. Чаще всего оно начинается с полиартрита, в более редких случаях признаки артрита могут быть умеренными, однако преобладают следующие симптомы:
- боли и скованность в суставах,
- ухудшение общего состояния;
- слабость, утомляемость;
- потеря веса;
- повышение температуры до субфебрильных значений;
- увеличение лимфатических узлов.
Все это может предшествовать клинически выраженному поражению суставов.
В статье вы найдете только несколько готовых образцов и шаблонов.
В Системе «Консилиум» их более 5000.
Успеете скачать всё, что нужно, по демодоступу за 3 дня?
Активировать
Согласно клиническим рекомендациям по ревматоидному артриту 2017 и 2018 годов, всем больным с этим заболеванием или подозрением на него показан общетерапевтический осмотр, позволяющий выявить патологические состояния:
- кожи;
- ЖКТ;
- мышечного корсета;
- бронхолегочной системы;
- сердечно-сосудистой системы;
- мочевыделительной системы;
- эндокринной системы.
Оценка внешнего вида больного позволяет выявить:
- Дефицит массы тела.
- Гипергидроз.
- Генерализованную амиотрофию.
- Воспаление слизистой оболочки глаз.
- Лимфаденит, лимфаденопатию.
- Патологии кожи — ревматоидные узелки, утолщение, гипотрофию.
- Дигитальный артериит, иногда с развитием гангрены пальцев.
- Микроинфаркты в области ложа ногтей.
Ревматоидный артрит характеризуется симметричным множественным поражением мелких суставов стоп и кистей.
При остром начале и активном воспалении околосуставной остеопороз и единичные кисты выявляются в течение месяца с начала патологического процесса, в то время как множественные кисты, сужение суставных щелей и единичные эрозии выявляются лишь через 3-6 месяцев от начала заболевания, особенно при отсутствии терапевтических мероприятий.
Оценка активности ревматоидного артрита, скачайте методы определения в Системе Консилиум.
Лечение
Лечение РА направлено на достижение стойкой ремиссии снижение активности заболевания. Это позволяет стабилизировать функциональные возможности больного, сохранить качество его жизни и трудоспособность.
На сегодняшний день стратегия лечения ревматоидного артрита основана на принципах «Лечения до достижения цели».
Это предполагает:
- активное использование противовоспалительных препаратов с момента диагностирования;
- частый и объективный контроль состояния больного;
- коррекцию схемы терапии ожидаемого ответа вплоть до достижения целей лечения;
- постоянное динамическое наблюдение.
Лечение пациентов с РА проводит врач-ревматолог или врач-терапевт (в порядке исключения). Основа терапии – использование противовоспалительных средств.
Использование противоревматических препаратов связано с частым развитием нежелательных побочных эффектов, ухудшающих течение болезни, а потому требующих скорейшего выявления и корректировки.
Медикаментозная терапия предполагает использование следующих препаратов:
- нестероидные противовоспалительные препараты (НПВП);
- глюкокортикоиды (ГК);
- базисные противовоспалительные препараты (БПВП).
Прием БПВП пациентами с РА, имеющими онкологические патологии и проходящими курс химио- или радиотерапии, крайне нежелателен.
Исключение составляют препараты на основе гидроксихлорохина и сульфасалазина. Лечение таких больных проводится при консультативной поддержке врача-онколога.
☆ Памятка пациентам: артрит ревматоидный, в Системе Консилиум
Не рекомендован прием базисных противовоспалительных средств больными с РА, ранее перенесшими немеланомный рак кожи или имеющими солидные опухоли в анамнезе. Генно-инженерные биологические препараты в этом случае должны применяться с большой осторожностью.
Нежелателен также прием гидроксихлорохина, сульфасалазина, ритуксимаба, ингибиторов ФНО-а у пациентов с ревматоидным артритом, имеющих в анамнезе лимфопролиферативные заболевания – хронический лимфолейкоз, волосатоклеточный лейкоз, внекостномозговые опухоли и др. Другие БПВП и генно-инженерные биопрепараты таким больным назначаются с осторожностью.
Побочные эффекты лечения генно-инженерными биологическими препаратами
Терапия ГИБП является достаточно безопасным методом лечения, хотя в ряде случаев возможны различные нежелательные (вплоть до тяжелых) реакции, требующие тщательного наблюдения – системные иммунные реакции, реакции гиперчувствительности (включая анафилаксии), тяжелые инфекции (включая скрытую туберкулезную инфекцию), а также местные реакции при подкожном введении препарата.
☆ Стандарт первичной медико-санитарной помощи при ревматоидном артрите. Медицинские мероприятия для диагностики заболевания в Системе Консилиум.
Скачать таблицу
Тактика лечения после достижения ремиссии
Постепенное тщательно контролируемое снижение дозы или отмена ГИБП возможны в случае достижения стойкой ремиссии после отмены глюкокортикоидов или продолжении их приема в дозе менее 5 мг в сутки.
Отмена генно-инженерных препаратов более вероятна у больных с ранним РФ/АЦЦП негативным вариантом ревматоидного артрита.
Согласно клиническим рекомендациям по ревматоидному артриту 2018 года, поддержание ремиссии после отмены ГИБП требует проведения терапии метотрексатом (в том числе подкожной формы данного препарата).
В некоторых случаях на фоне отмена или уменьшения дозировки генно-инженерных биопрепаратов у больного развивается обострение, что требует немедленного повторного назначения тех же или других ГИБП.
Как правило, эта мера приводит к быстрому подавлению активности воспаления у большинства пациентов.
Обострение на фоне отмены ГИБП или снижения их дозы чаще всего развивается при развернутом РФ/АЦЦП позитивном варианте ревматоидного артрита.
Лечащий врач должен рассмотреть возможность уменьшения дозы или отмены стандартных базисных противовоспалительных средств при достижении длительной стойкой ремиссии после завершения лечения генно-инженерными препаратами.
У больных с развернутой формой заболевания отмена базисных препаратов обычно провоцирует обострение, а потому не рекомендуется.

Хирургическое лечение
Хирургические лечение ревматоидного артрита проводится в травматолого-ортопедическом стационаре.
Показания к нему:
- Синовит, устойчивый к медикаментозному лечению.
- Деформации суставов, нарушение их функций.
- Хронический болевой синдром.
Разновидности хирургического лечения:
- артроскопическая и открытая синовэктомия;
- дебридмент;
- остеотомия;
- остеопластика;
- эндопротезирование суставов.
Оперативное вмешательство приводит к улучшению функциональных способностей больного в среднесрочной перспективе.
В периоперационном периоде пациентам с ревматоидным артритом показано лечение цитостатиками, в частности, метотрексатом.
Его отмена может спровоцировать обострение РА в послеоперационном периоде и значительно ухудшить итоги проведенного вмешательства. Противопоказанием к применению метотрексата является лишь наличие тяжелых почечных патологий у больного.
Перед операцией лечение генно-инженерными биопрепаратами прерывается на время, зависящее от их фармакокинетических свойств.
Срок прекращения лечения зависитот:
- периода полувыведения препаратов – в 3–5 раз больше периода их полужизни;
- индивидуальных особенностей пациента;
- характера предстоящей операции.
Терапия возобновляется, если отсутствуют сведения о наличии инфекции, а операционная раневая поверхность заживает и находится в удовлетворительном состоянии.
Гормональная терапия продолжается в послеоперационном периоде в прежней дозировке. В день операции больному с ревматоидным артритом показано назначение заместительной терапии (в/в вливания гидрокортизона 25–100 мг или 6-МПРЕД – 5–30 мг в зависимости от тяжести вмешательства).
✔ Диспансерное наблюдение пациентов с ревматоидным артритом, скачайте алгоритм в Системе Консилиум.
Реабилитация
ЛФК назначается больному сначала под руководством инструктора, затем он может заниматься ей дома с профессиональной поддержкой.
Пациенту РА с момента установления диагноза показаны умеренные силовые нагрузки, а также комплексы упражнений для повышения ловкости и развития моторики кистей.
Динамические, силовые и аэробные нагрузки с учетом потребностей и возможностей пациента развивают мышечную силу, аэробные возможности, способствуют улучшению настроения, психологического состоянияв целом, а также общего физического статуса без усиления активности заболевания и деструкции суставов в краткосрочной перспективе.
При ограничении функций суставов больным показана эрготерапия, дополняющая лечение медикаментами. Он способствует повышению функционального и психологического статусов, повышает «самоэффективность» и уровень бытовой активности, адаптацию в социальной и профессиональной сфере.
Пациентам с деформацией суставов стоп показано ношение ортопедической обуви и стелек. Для снятия боли, повышения функционального статуса и «самоэффективности» больным с ревматоидным артритом рекомендовано бальнеологической лечение.
Немедикаментозные методы профилактики, лечения и медицинской реабилитации РА, в Системе Консилиум.
Профилактика
Всем больным РА показаны:
- Регулярные физические нагрузки.
- Отказ от вредных привычек.
- Регулярный контроль веса.
- Тщательная гигиена полости рта.
- Устранение факторов, способных вызвать обострение процесса (стрессы, инфекции и др.).
Первичной профилактики ревматоидного артрита не существует. Табакокурение, избыточная масса тела и пародонтит относятся к факторам риска развития и прогрессирования заболевания, снижения эффективности медикаментозного лечения и увеличения смертности, в том числе вызванной болезнями сердца и сосудов.
Регулярные занятия лечебной физкультурой улучшают функциональный статус и способствует сохранению способности пациентов трудиться.
Пациенты с ревматоидным артритом находятся на постоянном диспансерном учете врача-ревматолога, который осуществляет мониторинг активности заболевания, эффективности и переносимости лечения, оценивает прогрессирование деструкции суставов и при необходимости корректирует терапевтическую схему.
Оценка эффективности лечения с использованием стандартизированных индексов проводится до достижения ремиссии – не реже раза в три месяца, а при достижении стойкой ремиссии – раз в полгода.
Смотреть список литературы
Материал проверен экспертами Актион Медицина
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
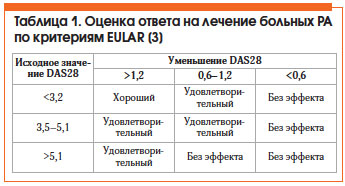
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

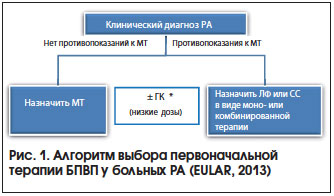
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
III. Пациент с поздним РА и остеопоротическими переломами
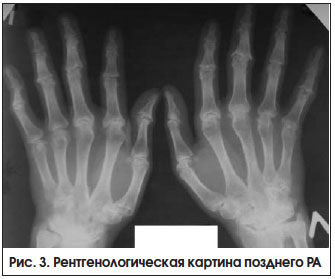
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
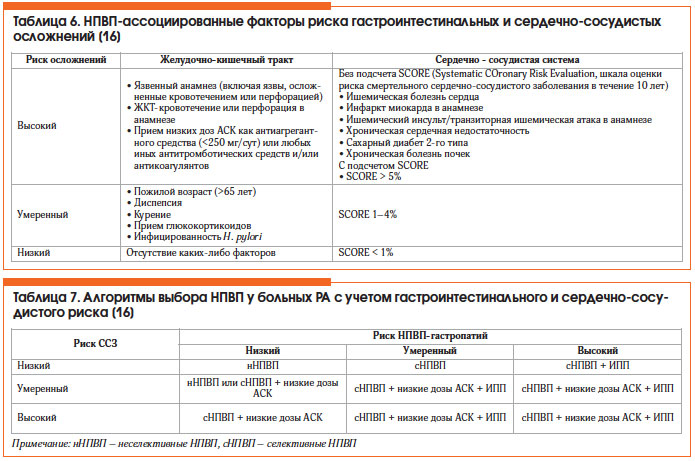
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник