Рекомендации eular по ревматоидному артриту
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
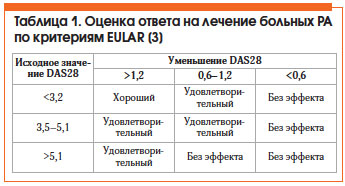
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

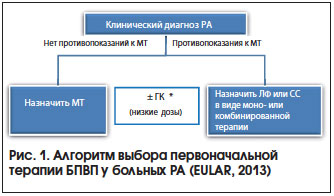
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
III. Пациент с поздним РА и остеопоротическими переломами
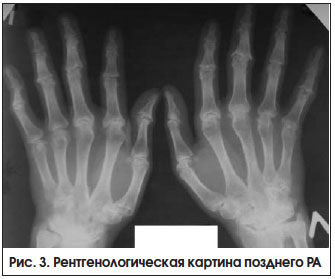
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
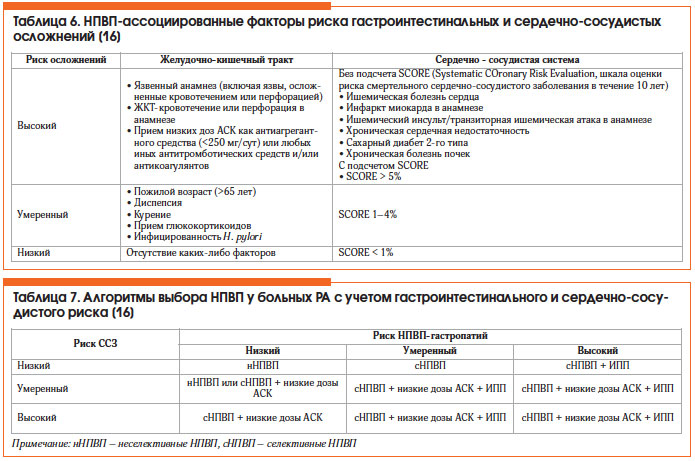
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
Европейская противоревматическая лига (EULAR) выпустила новые рекомендации по лечению ревматоидного артрита (РА), направленные на использование традиционных базисных болезнь-модифицирующих препаратов (DMARDs), биопрепаратов и биосимиляров, а также целевых синтетических препаратов, таких как ингибиторы Jak (янус-киназ).
«Обновление рекомендации EULAR в 2016 году основаны на самых последних исследованиях в лечении РА и на обсуждениях крупной и широкомасштабной международной рабочей группой. Эти рекомендации синтезируют нынешнее мышление о приближении к лечению РА в целом ряде всеобъемлющих принципов и рекомендаций», пишет Йозеф С. Смолен, доктор медицинских наук, председатель отделения ревматологии Венского медицинского университета в «Анналах ревматических заболеваний».
Рекомендации были в последний раз обновлены в 2013 году, и с тех пор было несколько новых утвержденных методов лечения и уточнений в терапевтических стратегиях и оценке клинических результатов, которые, в свою очередь, побудили целевую группу представить обновленную информацию об этих принципах и рекомендациях.
«Эксперты EULAR, как правило, разрабатывают достаточно простые указания, которые очень практичны, без некоторых уровней детализации, которые часто встречаются в рекомендациях ACR и других групп», — отметил Сааг в интервью MedPage Today. «Рекомендаций не много и они достаточно просты, и это действительно отражает процесс, который использует EULAR, что представляет собой смесь систематического обзора, синтеза доказательств и экспертного консенсуса».
Общие принципы
Четыре основополагающих принципа, лежащих в основе лечения, состоят в том, что:
- управление РА должно опираться на совместное принятие решений между пациентом и ревматологом;
- решения о лечении должны основываться на активности, повреждении, сопутствующих заболеваниях и безопасности;
- ревматологи играют ведующую роль в ведении больных РА;
- следует учитывать высокие индивидуальные, медицинские и социальные издержки РА.
Целевая группа сформулировала 12 рекомендаций, призванных помочь клиницистам обеспечить оптимальный уход за пациентами на основе наилучших имеющихся доказательств.
Первые 2 рекомендации:
- Терапия традиционными базисными болезнь-модифицирующими препаратами (DMARDs) должна быть начата, как только диагноз РA будет установлен;
- Лечение должно быть направлено на достижение цели — устойчивой ремиссии или низкой активности болезни у каждого пациента.
Эти рекомендации основаны на большом количестве фактических данных, свидетельствующих о том, что раннее вмешательство и подход к лечению могут радикально изменить течение РА. В целом, значительное улучшение должно быть очевидным через 3 месяца, а цель лечения – в течение 6 месяцев.
Общение с пациентом для уточнения и согласования цели лечения и средств для достижения этой цели имеет первостепенное значение.
Следующая рекомендация гласит, что если эти 3-месячные и 6-месячные цели не выполнены, то лечение должно быть скорректировано, и тщательный мониторинг должен продолжаться, пока болезнь активна.
Традиционные базисные болезнь-модифицирующие препараты (DMARD) и другие:
Следующая группа рекомендаций сосредоточена на конкретных методах лечения, начиная с метотрексата, которые должны быть включены в первоначальную стратегию. Основываясь на своей эффективности, безопасности (особенно с приемом фолиевой кислоты), возможности индивидуализации дозы и способа введения, а также относительно низких затратах, метотрексат продолжает оставаться основным (первым) препаратом для лечения пациентов с РА как в виде монотерапии, так и в сочетании с другими препаратами.
Однако, для пациентов с противопоказаниями или с непереносимостью метотрексата, первоначальное лечение может включать либо сульфасалазин, либо лефлуномид. Альтернативные препараты DMARD можно использовать, если у пациента нет неблагоприятных прогностических факторов, таких как большое количество опухших суставов, серопозитивность или высокий уровень острофазных показателей крови.
Что касается глюкокортикоидов: рабочая группа посоветовала рассмотреть возможность использования, когда инициируются традиционные DMARD или меняются и должны быть отменены так же быстро, как только это клинически осуществимо, чаще всего в течение 3 месяцев.
Затем в рекомендациях были рассмотрены вопросы, связанные с биологической терапией или целевыми синтетическими DMARD, что указывает на то, что они являются вариантами после отказа от первого обычного DMARD у пациентов с плохими прогностическими факторами. Однако авторы отмечают, что в настоящее время предпочтение отдается таким биологическим агентам, как ингибиторы фактора некроза опухолей (анти-ФНО), абатацепту (Оренциа), блокаторам интерлейкина -6 Тоцилизумабу (Актемра) и анти-B клеточному агенту Ритуксимабу (Мабтера).
В рекомендациях также отмечается, что возможны и другие варианты: Сарилумаб, Клазакизумаб и Сирукумаб, а также Тофацитиниб (Xeljanz) и другие ингибиторы янус-киназ, такие как барицитиниб.
Кроме того, биосимиляры должны быть предпочтительнее, если они действительно значительно дешевле, чем другие целевые агенты.
Если лечение биологическими или целевыми препаратами не удалось, можно рассмотреть другой биологический или таргетный агент, и если неудавшийся биологический препарат был из группы ингибиторов ФНО, можно попробовать либо другой ингибитор ФНО, либо агент с другим механизмом действия. Однако пока неясно, может ли второй ингибитор янус-киназ (Jak) или блокатор ИЛ-6 быть полезным после неудачи первого.
Смотреть вперед
Наконец, в рекомендациях рассматривалась возможность сужения терапии, если пациенты находятся в стойкой ремиссии. Например, после того, как глюкокортикоиды будут отменены, можно было бы рассмотреть возможность сужения биологической терапии, особенно если пациент также получает традиционный DMARD. Эта конусность может включать снижение дозы или увеличение интервала между дозами.
Можно было бы также рассмотреть сужение традиционного DMARD, хотя многие члены целевой группы считали, что терапия этими препаратами не должна останавливаться.
Целевая группа также разработала ряд приоритетных исследований, которые будут рассмотрены в ближайшие несколько лет, в том числе:
- Может ли индукционная терапия с помощью биологического препарата+ метотрексата с последующим изъятием биологического, привести к устойчивой ремиссии?
- Могут ли быть определены предикторы ответа на различные биологические и целевые синтетические методы лечения?
- Какое воздействие оказывают традиционные DMARD, биологические и целевые синтетические препараты на сердечно-сосудистые исходы?
Перевод и адаптация: Мирослава Кулик
По материалам: https://www.medpagetoday.com/mastery-of-medicine/rheumatology-mastery-in-ra/63697
Мирослава Кулик
Врач-терапевт, ревматолог

Источник
