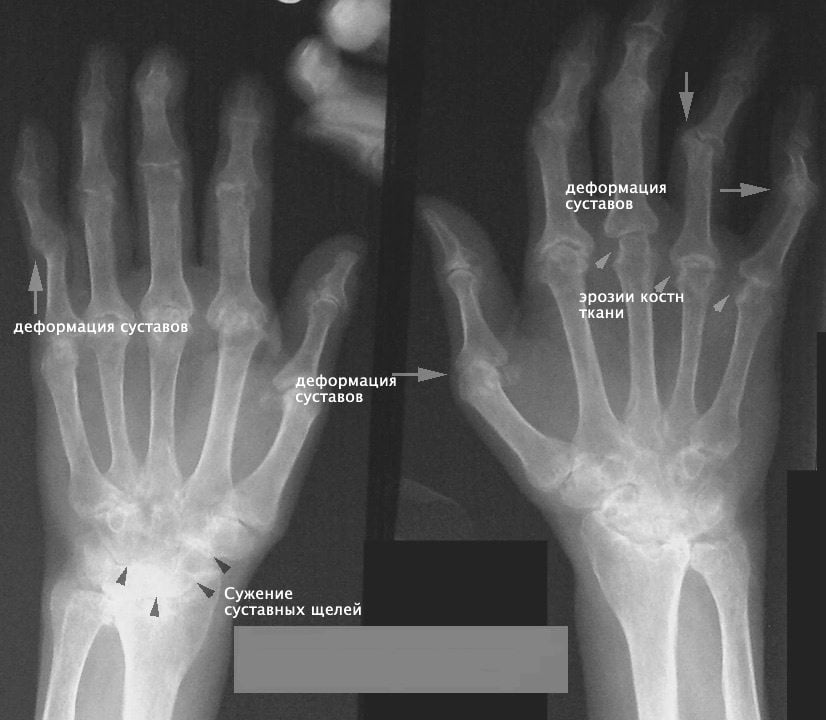
Ревматоидный артрит национальное руководство 2015
Анкилозирующий спондилит (Болезнь Бехтерева)
![]()
Версия: Клинические рекомендации РФ (Россия)
МКБ-10: Анкилозирующий гиперостоз форестье (M48.1), Анкилозирующий спондилит (M45), Другие уточненные воспалительные спондилопатии (M46.8)
Раздел медицины: Ревматология
Антифосфолипидный синдром
![]()
Версия: Клинические рекомендации РФ (Россия)
Альтернативное название: Коагуляционные дефекты, связанные с наличием «волчаночных антикоагулянтов»
МКБ-10: Другие уточненные нарушения свертываемости (D68.8)
Раздел медицины: Ревматология
Болезнь Бехчета
![]()
Версия: Клинические рекомендации РФ (Россия)
МКБ-10: Болезнь бехчета (M35.2)
Раздел медицины: Ревматология
Болезнь Шегрена
![]()
Версия: Клинические рекомендации РФ (Россия)
Альтернативное название: болезнь шёгрена
МКБ-10: Другие перекрестные синдромы (M35.1), Прогрессирующий системный склероз (M34.0), Системный склероз (M34), Сухой синдром [шегрена] (M35.0)
Раздел медицины: Ревматология
Остеоартроз
![]()
Версия: Клинические рекомендации РФ (Россия)
МКБ-10: Артрозы (M15-M19)
Раздел медицины: Ревматология
Остеопороз
![]()
Версия: Клинические рекомендации РФ (Россия)
МКБ-10: Остеопороз без патологического перелома (M81), Остеопороз при болезнях, классифицированных в других рубриках (M82*), Остеопороз с патологическим переломом (M80)
Раздел медицины: Ревматология
Лечение за рубежом
Пройти лечение в Корее, Израиле, Германии, США
Лечение за рубежом
Пройти лечение в Корее, Турции, Израиле, Германии и других странах
Выбрать иностранную клинику
Бесплатная консультация по лечению за рубежом! Оставьте заявку ниже
Источник
Ревматоидный артрит (РА) является одним из наиболее распространенных ревматических заболеваний. Его особенностями являются непрерывно прогрессирующее течение, приводящее к инвалидизации пациента, значительная коморбидность и уменьшение продолжительности жизни в среднем на 10 лет [1]. Поэтому важным является установить этот диагноз как можно раньше для раннего назначения адекватной терапии.
В течение долгого времени врачи пользовались критериями, разработанными ACR в 1987 г. [2]. Но данные критерии (табл. 1) позволяют верифицировать РА на развернутой или поздней стадии, когда возможности терапии значительно упущены.
В 2010 г. Американской коллегией ревматологов (American College of Rheumatology (ACR)) и Европейской антиревматической лигой (European League Against Rheumatism (EULAR)) разработаны [3] новые критерии диагностики РА, позволяющие поставить этот диагноз на более ранней стадии (табл. 2). Но, несмотря на современные достижения в изучении этого заболевания, диагностика на ранних этапах РА до сих пор встречает затруднения.

Приводим клиническое наблюдение.
Пациент Б., 38 лет. Впервые обратился к ревматологу с жалобами на боли и отечность в суставах в течение последних 2 мес. Боли преимущественно механического характера (при физической нагрузке, к вечеру) в обоих коленных суставах, правом голеностопном суставе, иногда мелких суставах кистей. Отечность в левом коленном суставе, правом голеностопном суставе. Небольшая утренняя скованность (20–30 мин). Объективно: признаки синовита в левом коленном суставе, правом голеностопном суставе. Других изменений нет. Из лабораторных исследований только общий анализ крови: гемоглобин – 163 г/л, лейкоциты – 6,1×109/л, лейкоформула – без отклонений, СОЭ – 11 мм/ч, тромбоциты – 207×109/л. Рентгенологическое исследование не проведено.
На основании преимущественно механического характера боли, поражения крупных суставов, отсутствия воспалительных изменений в общем анализе крови ревматологом выставлен предварительный диагноз: «Остеоартроз». Но для исключения дебюта других ревматических заболеваний было назначено дополнительное лабораторное и инструментальное обследование: выявление инфекций, передающихся половым путем, протеинограмма, СРБ, РФ, АЦЦП, ЦИК, иммуноглобулины, рентгенография коленных суставов, мелких суставов кистей и стоп.
Хотелось бы обратить внимание на то, что нормальные СОЭ, СРБ, протеинограмма не должны препятствовать постановке диагноза РА, т. к., по данным литературы, в первые 2–3 мес. заболевания эти показатели в норме не менее чем у 50% больных [4]. Пациенту назначен диклофенак 100 мг/сут.
На повторном визите пациент отметил эффективность НПВП (диклофенак) в виде снижения интенсивности болей и небольшого уменьшения отечности в суставах. Дополнительное исследование выявило следующие изменения: протеинограмма – небольшое повышение содержания α1 и α2 глобулинов (5,8 и 13%); незначительное повышение уровня СРБ – до 7,30 мг/л (норма – 0–5 мг/л); незначительное повышение РФ – до 45,10 МЕ/мл (норма – 0–30 МЕ/мл); повышение АЦЦП – до 859 Ед/мл (норма – не более 20 Ед/мл). На рентгенограммах изменений не выявлено.
В соответствии с новыми классификационными критериями РА 2010 г., у пациента насчитывается 6 баллов (артриты 2 крупных суставов, высокоположительный АЦЦП, повышенный уровень СРБ, длительность симптоматики ≥ 6 нед.), что позволяет поставить диагноз «Ранний РА».
Обнаружение АЦЦП в сыворотке крови [5] служит предиктором развития РА у здоровых (ОР 15,9) и у пациентов с ранним недифференцированным артритом; причем наличие высокого титра АЦЦП является прогностически неблагоприятным фактором: маркером тяжелого эрозивного поражения суставов при РА. Это требует раннего назначения базисной терапии с быстрым подбором эффективной дозы [6]. Препаратом первого выбора является метотрексат.
Пациенту дополнительно к терапии диклофенаком назначен метотрексат для подкожного введения 1 р./нед. в дозе 10 мг, рекомендован контроль эффективности и переносимости каждые 3–4 нед., при необходимости – увеличение дозы метотрексата.
Через 2 нед. после начала терапии метотрексатом пациент обратился с жалобами на появившуюся припухлость (рис. 1, 2) и болезненность в мелких суставах кистей. Пациенту был отменен диклофенак, назначен нимесулид (Найз®) 100 мг 2 р./сут после еды.
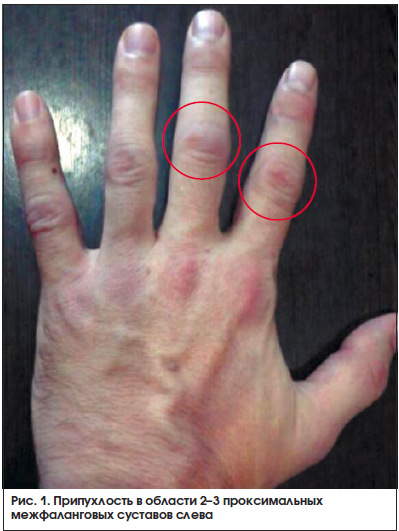
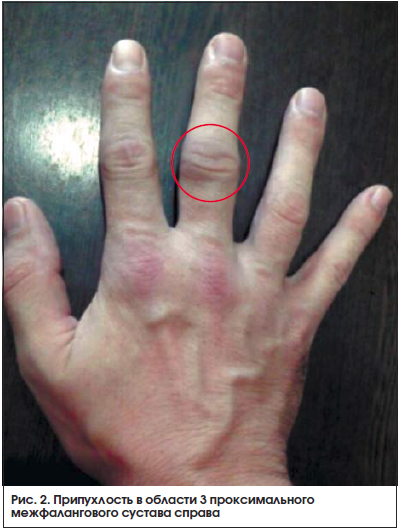
На фоне приема нимесулида через 3 дня пациент отметил положительную клиническую динамику в виде уменьшения отечности, скованности и болезненности в мелких суставах кистей.
Нестероидный противоспалительный препарат (НПВП) нимесулид зарекомендовал себя как препарат с выраженным анальгетическим и противовоспалительным эффектом при различных ревматических заболеваниях, он относится к группе противовоспалительных препаратов с умеренной селективностью [7], за счет чего реже вызывает диспепсию и бессимптомные язвы. Показана высокая эффективность нимесулида не только при РА, но и при подагре, анкилозирующем спондилите, остеоартрозе, энтезитах, бурситах и тендинитах, при острой боли в нижней части спины; при послеоперационном обезболивании [8–10]. Возможно, это связано с наличием центрального анальгетического эффекта в дополнение к основному механизму – блокаде ЦОГ-2 [8]. Таким образом, этот препарат сочетает в себе высокую эффективность с хорошей переносимостью.
Кроме более привычных для врачей вариантов начала РА (симметричный полиартрит с постепенным (в течение нескольких месяцев) нарастанием боли и скованности, преимущественно в мелких суставах кистей; острый полиартрит с преимущественным поражением суставов кистей и стоп, выраженной утренней скованностью) существуют следующие варианты дебюта РА [11]:
− моно- или олигоартрит коленных или плечевых суставов с последующим быстрым вовлечением в процесс мелких суставов кистей и стоп, который и наблюдался в приведенном клиническом случае;
− острый моноартрит крупных суставов, напоминающий септический или микрокристаллический артрит;
− острый олиго- или полиартрит с системными явлениями (фебрильная лихорадка, лимфаденопатия, гепатоспленомегалия). Чаще наблюдают у молодых пациентов (напоминает болезнь Стилла у взрослых);
− палиндромный ревматизм. Характерны рецидивирующие атаки острого симметричного полиартрита суставов кистей, реже – коленных и локтевых суставов, длительностью до нескольких часов или дней с последующим полным выздоровлением;
− рецидивирующий бурсит и теносиновит обычно лучезапястных суставов;
− острый полиартрит у лиц пожилого возраста с множественным поражением мелких и крупных суставов, выраженными болями, диффузным отеком и ограничением подвижности суставов. Получил название «RS3PE-синдром» (remitting seronegative symmetric synovitis with pitting edema – ремиттирующий серонегативный симметричный синовит с подушкообразным отеком);
− генерализованная миалгия, скованность, депрессия, двусторонний синдром запястного канала, похудание. Обычно наблюдают в пожилом возрасте. Напоминает ревматическую полимиалгию. Появление характерных клинических признаков РА отмечают позднее.
При изучении частоты различных вариантов дебюта РА [12] получены следующие данные: у пациентов до 45 лет заболевание чаще начинается с поражения крупных суставов, у лиц старше 45 лет – с мелких суставов. Наиболее часто выявлялись варианты: асимметричные моно- и олигоартрит; симметричное поражение крупных суставов; симметричный артрит мелких суставов кистей и стоп; полиартрит по типу реактивного.
Таким образом, начало РА может иметь разнообразную клиническую картину (поражение не только мелких, но и крупных суставов, моно- и олигоартриты), в дебюте может отсутствовать лабораторная активность (повышение СОЭ, уровня СРБ), поэтому таким пациентам необходимы лабораторное обследование на РФ и АЦЦП, рентгенологическое исследование суставов и динамическое наблюдение у ревматолога.
Источник
1. Насонов ЕЛ, Каратеев ДЕ, Балабанова РМ. Ревматоидный артрит. В кн.: Насонов ЕЛ, Насонова ВА, редакторы. Ревматология. Национальное руководство. Москва: ГЭОТАР-Медиа; 2008. С. 290-331 [Nasonov EL, Karateev DE, Balabanova RM. Rheumatoid arthritis. In: Nasonov EL, Nasonova VA, editors. Revmatologiya. Natsional’noe rukovodstvo [Rheumatology. National guidelines]. Moscow: GEOTAR Media; 2008, P. 290-331].
2. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. New Engl Med. 2012;365:2205-19. doi: 10.1056/NEJMra1004965
3. Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016. doi: 10.1016/S)140-6736(16)30173-7
4. Насонов ЕЛ, редактор. Генно-инженерные биологические препараты в лечении ревматоидного артрита. Москва: ИМАПРЕСС; 2013 [Nasonov EL, editor. Genno-inzhenernye biologicheskie preparaty v lechenii revmatoidnogo artrita [Genetically engineered biological agents in the treatment of rheumatoid arthritis]. Moscow: IMA-PRESS; 2013].
5. McInnes IB, Buckley CD, Isaaacs JD. Cytokines in theumatoid arthritis – shaping the immunological landscape. Nat Rev Rheumatol. 2016;12:63-8. doi: 10.1038/nrrheum.2015.171
6. Sokka T, Pincus T. Rheumatoid arthritis: strategy more important than agent. Lancet. 2009;374:430-2. doi: 10.1016/S0140-6736(09)61432-X
7. Pincus T, Kathryn A, Gibson MD, Castrejon I. Update on methotrexate as the anchor drug for rheumatoid arthritis. Bull Hosp Joint Dis. 2013;71(Suppl. 1):S9-19.
8. Smolen JS, Aletaha D, Bijsma JWJ, et al. For the T2T Expert Committee. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis. 2010;69:631-7. doi: 10.1136/ard.2009.123919
9. Smolen JS, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target: 2014 update the recommendations of an international task force. Ann Rheum Dis. 2016;75:305. doi: 10.1136/annrheumdis-2015-207524
10. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis. 2010;69:964-75. doi: 10.1136/ard.2009.126532
11. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 2014;73:492-509. doi: 10.1136/annrheumdis-2013-204573
12. Насонов ЕЛ, Каратеев ДЕ, Чичасова НВ. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая характеристика и дискуссионные проблемы. Научнопрактическая ревматология. 2013;51(6):609-22 [Nasonov EL, Karateev DE, Chichasova NV. EULAR recommendations for the treatment of rheumatoid arthritis – 2013: General characteristics and disputable problems. Nauchno-Prakticheskaya Revmatologiya= Rheumatology Science and Practice. 2013;51(6):609-22 (In Russ.)]. doi: 10.14412/1995-4484-2013-609-22
13. Насонов ЕЛ, Каратеев ДЕ, Чичасова НВ. Новые рекомендации по лечению ревматоидного артрита (EULAR, 2013): место метотрексата. Научно-практическая ревматология. 2014;52(1):8-26 [Nasonov EL, Karateev DE, Chichasova NV. New recommendations for the management of rheumatoid arthritis (EULAR, 2013): The role of methotrexate. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(1):8-26 (In Russ.)]. doi: 10.14412/1995-4484-2014-8-26
14. Насонов ЕЛ. Новые рекомендации по лечению ревматоидного артрита (EULAR, 2013) – место глюкокортикоидов. Научно-практическая ревматология. 2015;53(3):238-50 [Nasonov EL. New guidelines for the management of rheumatoid arthritis (EULAR, 2013): The place of glucocorticoids. Nauchno-Prakticheskaya Revmatologiya =Rheumatology Science and Practice. 2015;53(3):238-50 (In Russ.)]. doi: 10.14412/1995-4484-2015-238-250
15. Singh JA, Saag KG, Bridges SL Jr, et al. 2015 American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Rheum. 2016;68:1-26. doi: 10.1002/art.39489
16. Насонов ЕЛ, Мазуров ВИ, Каратеев ДЕ и др. Проект рекомендаций по лечению ревматоидного артрита Общероссийской общественной организации «Ассоциация ревматологов России» – 2014 (часть 1). Научно-практическая ревматология. 2014;52(5):477-94 [Nasonov EL, Mazurov VI, Karateev DE, et al. Project: Recommendations on treatment of rheumatoid arthritis developed by All-Russian Public Organization «Association of Rheumatologists of Russia» – 2014 (Part 1). Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(5):477-94 (In Russ.)]. doi: 10.14412/1995-4484-2014-477-494
17. Nasonov EL, Karateev DE. Does Russia need a treat-to-target initiative. Rheumatology (Oxford). 2015;54: 381-2. doi: 101093/rheumatology/keu156
18. Guyatt GH, Oxman AD, Kunz R, et al. GRADE guidelines: 2. Framing the question and deciding on important outcome. J Clin Epidemiol. 2011;64:395-400. doi: 10.1016/j.jclinepi.2010.09.012
19. Насонов ЕЛ. Метотрексат при ревматоидном артрите – 2015: новые факты и идеи. Научно-практическая ревматология. 2015;53(4):421-33 [Nasonov EL. Methotrexate in rheumatoid arthritis – 2015: New facts and ideas. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(4):421-33 (In Russ.)]. doi: 10.14412/1995-4484-2015-421-433
20. Visser K, van der Heijde D. Optimal dosage and rout of administration of methotrexate in rheumatoid arthritis: a systemic review of the literature. Ann Rheum Dis. 2009;68:1094-9. doi: 10.1136/ard.2008.092668
21. Shea B, Swinden MV, Ghogomu ET, et al. Folic acid and folinic acid for reducing side effects in patients receiving methptrexate for rheumatoid arthritis. J Rheumatol. 2014;41:1049-60. doi: 10.3899/jrheumatol.130738
22. Molina JT, Garcia FJB, Alen JC, et al. Recommendations for the use of methotrexate in rheumatoid arthritis: up and down scaling of the dose and administration routes. Rheumatol Clin. 2015;11:3-8.
23. Насонов ЕЛ. Лечение ревматоидного артрита 2012: место метотрексата. Научно-практическая ревматология. 2012;51(Прил.):1-24 [Nasonov EL. Treatment of rheumatoid arthritis 2012: place of methotrexate. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2012;51(Suppl.):1-24 (In Russ.)].
24. Smolen JS, Aletaha D. Rheumatoid arthritis therapy reappraisal: straregies, opportunities and challenges. Nat Rev Rheumatol. 2015 May;11(5):276-89. doi: 10.1038/nrrheum.2015.8. Epub 2015 Feb 17.
25. Schett G, Emery P, Tanaka Y, et al. Tapering biologic and conventional DMARD therapy in rheumatoid arthritis: current evidence and future directions. Ann Rheum Dis. 2016;75:1428-37. doi: 10.1136/annrheumdis-2016-209201
26. Popkova TV, Novikova DS, Gasparyan AY, Nasonov EL. Cardiovascular effects of methotrexate in rheumatoid arthritis. Curr Med Chem. 2015;22:1903-10. doi: 10.2174/0929867322666150415122039
27. Kremer JM. Can methotrexate prevent knee arthroplasties in patients with rheumatoid arthritis. J Rheumatol. 2015;42:2217-8. doi: 10.3899/jrheum.151104
28. McLean-Tooke A, Aldridge C, Waugh A, et al. Methotrexate, rheumatoid arthritis and infection risk – what is the evidence? Rheumatology. 2009;48:867-71. doi: 10.1093/rheumatology/kep101
29. Conway R, Low C, Coughlan RJ, et al. Methotrexate and lung disease in rheumatoid arthritis – a meta-analysis of randomized controlled trials. Arthritis Rheum. 2014;66:803-12. doi: 10.1002/art.38322
30. Conway R, Low C, Coughlan RJ, et al. Methotrexate use and risk of lung disease in psoriasis, psoriatic arthritis, and inflammatory bowel disease: systemic literature review and meta-analysis of randomized controlled trials. BMJ. 2015;350:h1269. doi: 10.1136/bmj.h1269
31. Conway R, Low C, Coughlan RJ, et al. Risk of liver injury among methotrexate users: a meta-analysis of randomized controlled trials. Semin Arthritis Rheum. 2015;45(2):156-62. doi: 10.1016/j.semarthrit.2015.05.003
32. Bourre-Tessier J, Haraou B. Methotrexate drug interactions in the treatment of rheumatoid arthritis: a systemic review. J Rheumatology. 2010;37:1416-21. doi: 10.3899/jrheum.090153
33. Yazici Y, Bata Y. Parenteral methotrexate for the treatment of rheumatoid arthritis. Bull Hosp Joint Dis. 2013;71(Suppl 1):S46-48.
34. Cipriani P, Ruscitti P, Carubbi F, et al. Methotrexate in rheumatoid arthritis: optimizing therapy among different formulations. Current and emerging paradigms. Clin Ther. 2014;36:427-35. doi: 10.1016/j.clinthera.2014.01.014
35. Li D, Yang Z, Kang P, Xie X. Subcutaneous administration of methotrexate at high doses makes a better performance in the treatment of rheumatoid arthritis compared with oral administration of methotrexate: A systematic review and meta-analysis. Semin Arthritis Rheum. 2015: S0049-0172(15)00282-6. doi: 10.1016/j.semarthrit.2015.11.0
36. Jay R. Methotrexate revisited: considerations for subcutaneous administration in RA. Clin Rheumatol. 2015 Feb;34(2):201-5. doi: 10.1007/s10067-014-2830-9. Epub 2014 Nov 30.
37. Goodman SM, Cronstein BN, Bykerk VP. Outcomes related to methotrexate dose and route of administration in patients with rheumatoid arthritis: a systematic literature review. Clin Exp Rheumatol. 2015;33:272-8. Epub 2014 Dec 23.
38. Braun J, Kästner P, Flaxenberg P, et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis: results of a six-month, multicenter, randomized, double-blind, controlled, phase IV trial. Arthritis Rheum. 2008;58:73-81. doi: 10.1002/art.23144
39. Hazlewood GS, Thorne JC, Pope JE, et al. The comparative effectiveness of oral versus subcutaneous methotrexate for the treatment of early rheumatoid arthritis. Ann Rheum Dis. 2015 May 15. pii: annrheumdis-2014-206504. doi: 10.1136/annrheumdis-2014-206504
40. Islam MS, Haq SA, Islam MN, et al. Comparative efficacy of subcutaneous versus oral methotrexate in active rheumatoia arthritis. Mymensingh Med J. 2013;22:483-8.
41. Bakker MF, Jacobs JW, Welsing PM, et al. Are switches from oral to subcutaneous methotrexate or addition 0f ciclosporin to methotrexate useful steps in tight control treatment strategy for rheumatoid arthritis. Post hoc analisis of the CAMERA study. Ann Rheum Dis. 2010;69:1849-52. doi: 10.1136/ard.2009.124065
42. Mainmann H, McClaren E, Heycoks S, et al. When should we use parental methotrexate? Clin Rheumatol. 2010;29:1093-8. doi: 10.1007/s10067-010-1500-9
43. Scott DG, Claydon P, Ellis C. Retrospective evaluation of continuation rates following a switch to subcutaneous methotrexate in rheumatoid arthritis patients failing to respond or tolerate oral methotrexate; the MENTOR study. Scand J Rheumatol. 2014;43:470-6. doi: 10.3109/03009742.2014.910312
44. Muller RB, von Kempis J, Haile SR, Schiff MH. Effectiveness, tolerability, and safety of subcutaneous methotrexate in early rheumatoid arthritis: a retrospective analysis of real-world data from the St. Gallen cohort. Semin Arthritis Rheum. 2015. doi: 10.1016/j.semarthritis.2015.02.009
45. Каратеев ДЕ, Лучихина ЕЛ, Демидова НВ и др. Применение подкожной формы метотрексата для лечения больных активным ревматоидным артритом (исследование РЕМАРКА). Научно-практическая ревматология. 2016;54(2):138-44 [Karateev DE, Luchikhina EL, Demidova NV, et al. Use of subcutaneous methotrexate for the treatment of patients with active rheumatoid arthritis: The REMARCA trial. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2016;54(2):138-44 (In Russ.)]. doi: 10.14412/1995-4484-2016-138-144
46. Муравьев ЮВ, Гриднева ГИ, Каратеев ДЕ, Лучихина ЕЛ. Безопасность применения метотрексата в форме раствора для подкожных инъекций у больных ревматоидным артритом. Научно-практическая ревматология. 2015;53(4):371-4 [Muravyev YuV, Gridneva GI, Karateev DE, Luchichina EL. Safety of using methotrexate solution for subcutaneous injections in patients with rheumatoid arthritis. NauchnoPrakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(4):371-4 (In Russ.)]. doi: 10.14412/1995-4484-2015-371-374
47. Schiff MH, Jaffe JS, Freundlich B. Head-to-head, randomized, crossover study of oral versus subcutaneous methotrexate in patients with rheumatoid arthritis: drug-exposure limitations of oral methotrexate at dose ≥15 mg may be overcome with subcutaneous administration. Ann Rheum Dis. 2014;73:1549-51. doi: 10.1136/annrheumdis-2014-205228
48. Kremer JM, Lawrence DA, Hamilton R, McInnes IB. Long-term study of the impact of methotrexate on serum cytokines and lymphocyte subsets in patients with active rheumatoid arthritis: correlation with pharmacokinetics measure. RMD Open. 2016;2:e000287. doi: 10.1136/rmdopen-2016-000287
49. Bykerk VP, Akhavan P, Hazlewood GS, et al. Canadian Rheumatology Association Recommendations for Pharmacological Management of Rheumatoid Arthritis with Traditional and Biologic Disease-modifying Antirheumatic Drugs. J Rheumatol. 2012;39:1559-82. doi: 10.3899/jrheum.110207
50. Curtis JR, Zhang J, Xie F, et al. Use of oral and subcutaneous methotrexate in rheumatoid arthritis patients in the United States. Arthritis Care Res (Hoboken). 2014 Nov;66(11):1604-11. doi: 10.1002/acr.22383
51. Strand V, Williams S, Miller PSJ, et al. Discontinuation of biologic therapy in rheumatoid arthritis (RA): analysis from the Consortium of Rheumatology Researchers of North America (CORRONA) database. Ann Rheum Dis. 2013;72(Suppl 3):71 (P0064).
52. Насонов ЕЛ, Каратеев ДЕ, Сатыбалдыев АМ и др. Ревматоидный артрит в Российской Федерации по данным Российского регистра больных артритом (сообщение I). Научно-практическая ревматология. 2015;53(5):472-84 [Nasonov EL, Karateev DE, Satybaldyev AM, et al. Rheumatoid arthritis in the Russian Federation according to Russian Arthritis Registry data (Communication 1). Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(5):472-84 (In Russ.)]. doi: 10.14412/1995-4484-2015-472-484
53. Duran J, Bockorny M, Dalasl D, et al. Methotrexate dosage as a source of bias in biological trials in rheumatoid arthritis: a systemic review. Ann Rheum Dis. 2016;75:1595-8. doi: 10.1136/annrheumdis-2016-209383
54. Strehl C, Bijlsma JW, de Wit M, et al. Defining conditions where long-term glucocorticoid treatment has an acceptable low level of harm to facilitate implementation of existing recommendations: viewpoints from an EULAR task force. Ann Rheum Dis. 2016;75:952-7. doi: 10.1136/annrheumdis-2015- 208916
55. Boyman O, Comte D, Spertini F. Adverse reactions to biologic agents and their medical management. Nar Rev Rheumatol. 2014;10:612-27. doi: 10.1038/nrrheuum.2014.123
56. Муравьев ЮВ, Муравьева ЛА. Несвоевременные мысли о применении генно-инженерных биологических препаратов при ревматических болезнях. Научно-практическая ревматология. 2016;54(3):361-6 [Muravyev YuV, Muravyeva LA. Tardy ideas on the use of biological agents in rheumatic diseases. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2016;54(3):361-6 (In Russ.)]. doi: 10.14412/1995-4484-2016-361-366
57. Verschueren P, De CD, Corluy L, et al. Methotrexate in combination with other DMARDs is not superior to methotrexate alone for remission induction with moderate-to-high-dose glucocorticoid bridging in early rheumatoid arthritis after 16 weeks of treatment: the CareRA trial. Ann Rheum Dis. 2015;74:27-34. doi: 10.1136/annrheumdis-2014-205489
58. De Jong PH, Hazes JM, Han HK, et al. Randomised comparison of initial triple DMARD therapy with methotrexate monotherapy in combination with low-dose glucocorticoid bridging therapy; 1-year data of the tREACH trial. Ann Rheum Dis. 2014;73:1331-9. doi: 10.1136/annrheumdis-2013-204788
59. Nam JL, Villeneuve E, Hensor EM, et al. Remission induction comparing infliximab and high-dose intravenous steroid, followed by treat-to-target: a double-blind, randomised, controlled trial in new-onset, treatment-naive, rheumatoid arthritis (the IDEA study). Ann Rheum Dis. 2014;73:75-85. doi: 10.1136/annrheumdis-2013-203440
60. Goekoop-Ruiterman YP, de Vries-Bouwstra JK, Allaart CF, et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arthritis Rheum. 2005;52:3381-90. doi: 10.1002/art.21405
61. National Institute for Health and Care Excellence (UK). Adalimumab, etanercept, infliximab, certolizumab pegol, golimumab, tocilizumab and abatacept for rheumatoid arthritis not previously treated with DMARDs or after conventional DMARDs only have failed [online] (2016).
62. Hazlewood GS, Barnabe C, Tomilison G, et al. Methotrexate monotherapy and methotrexate combination therapy with traditional and biologic disease modifying antirheumatic drugs for rheumatoid arthritis: abridged Cochrane systemic review and network meta-analysis. BMJ. 2016;353:i1777. doi: 10.1136/bmj.i1777
63. Espinosa F, Fabre S, Pers Y-M. Remission-induction therapies for early rheumatoid arthritis: evidence to date and clinical implications. Ther Adv Musculoskelet Dis. 2016;8:107-18. doi: 10.1177/175920X16654476
64. Smolen JS, Aletaha D. Forget personalized medicine and focus on abating disease activity. Ann Rheum Dis. 2013;72:3-6. doi: 10.1136/annrheumdis-2012-202361
65. Cuppen BV, Welsing PM, Sprengers JJ, et al. Personalized biological treatment for rheumatoid arthritis: a systematic review with a focus on clinical applicability. Rheumatology (Oxford). 2016;55(5):826-39. doi: 10.1093/rheumatology/kev421
66. Насонов ЕЛ. Ревматоидный артрит: проблемы и значение персонифицированной медицины. Терапевтический архив. 2012;84:5-10 [Nasonov EL. Rheumatoid arthritis: the problem and the importance of personalized medicine. Terapevticheskiy Arkhiv. 2012;84:5-10 (In Russ.)].
67. Jorgensen TS, Tarp S, Furst DE, et al. Added-value of combining methotrexate with a biological agent compared to biological monotherapy in patients with rheumatoid arthritis: a systemic review and meta-analysis of randomized trials. Ann Rheum Dis. 2015;74(Suppl 2):239. doi: 10.1136/annrheumdis-2015eular.3396
68. Choy E, Aletaha D, Behrens F, et al. Monotherapy with biologic disease-modifying anti-rheumatic drugs in rheumatoid arthritis. Rheumatology (Oxford). 2016. doi: 10.1093/rheumatology/kew271 [Epub ahead of print].
69. Buckley F, Finckh A, Huizinga TWJ, et al. Comparative efficacy of novel DMARDs as monotherapy and in combination with methotrexate in rheumatoid arthritis patients with inadequate response to conventional DMARDs: a network meta-analysis. J Man Care Spec Pharm. 2015;21:409-23. doi: 10.18553/jmcp.2015.21.5.409
70. Насонов ЕЛ. Абатацепт при ревматоидном артрите: новая форма, новые механизмы, новые возможности. Научнопрактическая ревматология. 2015;53(5):522-41 [Nasonov EL. Abatacept for rheumatoid arthritis: A novel formulation, new mechanisms, new possibilities. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(5):522-41 (In Russ.)]. doi: 10.14412/1995-4484-2015-522-541
71. Насонов ЕЛ. Применение ритуксимаба при ревматоидном артрите. В кн.: Насонов ЕЛ, редактор. Анти-В-клеточная терапия в ревматологии: фокус на ритуксимаб. Москва: ИМА-ПРЕСС; 2011. С. 55-93 [Nasonov EL. The use of rituximab in rheumatoid arthritis. In: Nasonov EL, editor. Anti-B-kletochnaya terapiya v revmatologii: fokus na rituksimab [Anti-B-cell therapy in rheumatology: Focus on rituximab]. Moscow: IMAPRESS; 2011. P. 55-93].
72. Насонов ЕЛ, Александрова ЕН, Авдеева АС, Панасюк ЕЮ. Ингибиция интерлейкина 6 – новые возможности фармакотерапии иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология. 2013;51(4):416-27 [Nasonov EL, Aleksandrova EN, Avdeeva AS, Panasyuk EY. Interleukin 6 inhibition: new possibilities of pharmacotherapy for immunoinflammatory rheumatic diseases. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2013;51(4):416-27 (In Russ.)]. doi: 10.14412/1995-4484-2013-1254
73. Насонов ЕЛ. Новые подходы к фармакотерапии ревматоидного артрита: тофацитиниб. Научно-практическая ревматология. 2014;52(2):209-21 [Nasonov EL. New approaches to pharmacotherapy of rheumatoid arthritis: tofacitinib. NauchnoPrakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(2):209-21 (In Russ.)]. doi: 10.14412/1995-4484- 2014-209-221
74. Richards JS, Dowell SM, Quinones ME, Kerr GS. How to use biologic agents in patients with rheumatoid arthritis who have comorbid disease. BMJ. 2015 Aug 17;351:h3658. doi: 10.1136/bmj.h3658
75. Roubille C, Richer V, Starnino T, et al. Evidence-based Recommendations for the Management of Comorbidities in Rheumatoid Arthritis, Psoriasis, and Psoriatic Arthritis: Expert Opinion of the Canadian Dermatology-Rheumatology Comorbidity Initiative. J Rheumatol. 2015;42:1767-80. doi: 10.3899/jrheum.141112
Источник