Ревматоидный артрит новости в лечении 2016
Ревматоидный артрит – это тяжёлое аутоиммунное заболевание, поражающее по меньшей мере одного человека из ста во всём мире. По неизвестным пока причинам три четверти, страдающих этой болезнью, – женщины.
Все люди, которым поставлен такой диагноз, вынуждены жить с постоянной болью, их движения скованны, постоянные спутники таких больных – воспаление и прогрессирующая деформация мелких суставов. Но и это ещё не всё: они также подвергаются повышенному риску заболеваний сердца и почек, страдают от нарушения зрения и других воспалительных осложнений.
В настоящее время лечение ревматоидного артрита направлено в основном на облегчение боли, замедление развития заболевания и восстановление уже имеющихся повреждений суставов с помощью хирургического вмешательства. К сожалению, современные препараты малоэффективны для лечения этого аутоиммунного расстройства и чрезвычайно дорогостоящи.
Однако у больных и их родственников появилась надежда на улучшение самочувствия и качества жизни. Учёные из Стэнфордского университета разработали новое лекарство, которое уже показало свою эффективность на начальных этапах клинических испытаний.
Экспериментальное соединение, названное филготиниб, блокирует один из четырёх ферментов, участвующих в развитии воспаления в тканях.
Главный исследователь последнего этапа клинических испытаний Марк Дженовезе возлагает большие надежды на новый препарат от ревматоидного артрита.
Отметим, что в 2012 году в США уже были лицензированы два средства с похожим механизмом действия. Правда, эти лекарства не так избирательны и нарушают работу всех четырёх воспалительных ферментов данной группы. Кроме того, препараты первого поколения обладают массой побочных эффектов и применять их можно только в низких дозах, что далеко не всегда даёт желаемый эффект.
Финальный этап клинических испытаний филготиниба проводился в 114 центрах в 15 странах, в основном в Северной Америке и Европе. В нём приняли участие 449 человек, средний возраст которых составил 56 лет. Около 80% пациентов при этом были женщинами.
Участников исследования случайным образом распределили в три группы. Одни пациенты в течение 24 недель получали 200 миллиграммов филготиниба в сутки, другие – 100, а третья группа принимала плацебо. У всех добровольцев был ревматоидный артрит от умеренной до тяжёлой степени. Кроме того, каждый из пациентов до этого безуспешно лечился различными сочетаниями традиционных препаратов.
Полученные результаты обнадёживают: более 40% участников, принимавших самую высокую дозу филготиниба, сообщили о значительном снижении активности артрита уже через 12 недель.
После 24 недель применения нового лекарства показатель эффективности терапии увеличился почти до 50%. Ещё больше впечатляет то, что 30% людей, которых было прописано 200 миллиграммов филготиниба в сутки, в течение пяти с половиной месяцев достигли полной ремиссии.
«Мы обнаружили, что такая хорошая реакция на терапию филготинибом не зависела от того, какими лекарствами и в каких комбинациях пациента лечили ранее»,– отметил главный исследователь клинических испытаний Марк Дженовезе (Mark Genovese).
Рентгеновский снимок кисти, поражённой ревматоидным артритом.
По его словам, новый препарат явно превосходит по эффективности другие лекарства с похожим механизмом действия. А тот факт, что новое средство работает исключительно хорошо у пациентов, потерпевших неудачу в традиционной терапии ревматоидного артрита, вселяет в учёного наибольший оптимизм.
Несмотря на явные успехи лечения, в процессе клинических испытаний возникли и кое-какие сложности. Например, в конце 2018 года некоторые специалисты выразили опасения по поводу безопасности нового лекарства.
Тогда исследователи предположили, что препарат может негативно влиять на функции яичек и снижать количество сперматозоидов у мужчин. По этой причине Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) попросило провести дополнительные исследования безопасности для оценки этого конкретного риска.
Пока неясно, задержит ли это испытание долгожданный запуск препарата в 2020 году, но фармацевтическая компания Gilead, которая будет выпускать лекарство, в начале этого месяца объявила, что ожидает одобрения FDA в самое ближайшее время.
Результаты клинических испытаний многообещающего лекарства опубликованы в издании JAMA.
Напомним, что авторы «Вести.Наука» (nauka.vesti.ru) ранее писали о разработке вакцины от ревматоидного артрита, а также о том, как с этим заболеванием связана микробиота кишечника. Одно из исследований также показало, как распространённый витамин поможет предотвратить развитие этого серьёзного заболевания.
Оставайтесь в курсе самых важных новостей науки, подписывайтесь на наши группы в социальных сетях: ВК, Facebook, Twitter, «Одноклассники». Есть мы и в Яндекс.Дзене.
Источник
Революционные методы лечения ревматоидного артрита

Революционные методы лечения ревматоидного артрита (РА) теперь могут быть доступны тысячам российских пациентов – 15 сентября в Москве состоялась пресс-конференция, посвященная выводу на отечественный рынок инновационного генно-инженерного биологического препарата Актемра. Уникальный механизм действия Актемры обеспечивает беспрецедентные результаты лечения у пациентов, обреченных на хронические боли и нарушение двигательной активности.
Ревматоидный артрит относится к самым распространенным хроническим аутоиммунным заболеваниям. По оценкам экспертов, им страдает более 21 млн. человек во всем мире. Почти половина больных в течение первых 5-6 лет после начала заболевания становятся инвалидами.
Евгений Насонов, академик РАМН, доктор медицинских наук, профессор, директор НИИ Ревматологии: «Ревматические заболевания насчитывают более 100 нозологических форм и занимают 3-е место после других причин инвалидизации (кардиологические заболевания и онкология). Ревматоидный артрит не щадит ни взрослых ни детей, ежегодно инвалидность получают 80 000 больных, половина из них относится к наиболее дееспособному возрасту (мужчин – до 49 лет, женщин – до 44 лет). У 2/3 из них сразу определяется II или даже I группы инвалидности, число инвалидов среди детей с ревматическими заболеваниями с 2000г. увеличилось на 24%».
Существенные сдвиги в лечении ревматоидного артирита связаны с появлением генно-инженерных биологических препаратов, которые целенаправленно воздействуют на различные мишени — клетки и рецепторы, ведущие к развитию воспалительных процессов. В этом ряду Актемра – принципиально новый биологический препарат из класса ингибиторов рецептора интерлейкина-6 (IL-6), – стала настоящим прорывом. Актемра блокирует рецептор IL-6, являющийся главным фактором развития целого ряда воспалительных процессов. Воздействуя, таким образом, на механизм развития РА, препарат способен быстро нейтрализовать симптомы и признаки заболевания. В результате значительно снижается воспаление в суставах и организме в целом.
Милош Петрович, глава представительства компании Рош в России: «Исследовательский центр нашей компании постоянно работает над созданием новых революционных препаратов, которые спасают жизни пациентов и принципиально изменяют подходы к лечению тяжелых заболеваний. Препарат Актемра стал действительно уникальным решением в новом классе ингибиторов рецептора интерлейкина-6, своего рода дирижёра воспалительных процессов в организме. Мы считаем, что появление таргетного препарата Актемра в арсенале врачей-ревматологов является значительным достижением современной фундаментальной науки».
Актемра – первый инновационный лекарственный препарат, относящийся к классу генно-инженерной биологической терапии, который можно применять на ранних этапах лечения РА. До недавнего времени данный вид терапии использовался только у тех пациентов, чье заболевание продолжало активно развиваться, несмотря на стандартные методы лечения. Теперь, благодаря возможности использования Актемры, больные обретают реальный шанс на длительную стабилизацию в развитии болезни. 96% пациентов, получавших Актемру, отмечают видимый эффект в течение первых 2-х недель. Главной цели лечения РА – ремиссии — за 6 месяцев терапии достигают 30% пациентов, к концу первого года — каждый второй пациент. В ряде случаев результатом становится полное излечение.
Яков Сигидин, доктор медицинских наук, профессор, руководитель лаборатории клинической фармакологии НИИР РАМН: «Больной ревматоидным артритом – это человек с припухшими деформированными суставами, страдающий от постоянной, сильной боли. Раньше лечение было направлено на внешние проявления болезни: пациенту назначались болеутоляющие препараты, тепловые процедуры, примочки, компрессы и так далее. В действительности же ревматоидный артрит — это сложнейшие биологические процессы, которые возникают в результате воздействия иммунной системы на свои собственные ткани. Нейтрализация рецепторов IL-6 антителами, состоящими из человеческого белка и, в меньшей степени, белка животного, радикально изменила положение. Мы констатируем очень высокую частоту ремиссии, по существующим публикациям она может претендовать на самую большую частоту среди современных активных генно-инженерных биологических препаратов».
По мнению Евгения Насонова, эффективность лекарственного средства оценивается не только тем, насколько оно помогает улучшить качество жизни больного, но и тем, насколько оно способно сохранить или восстановить его трудоспособность, что особенно важно для экономики государства. «Принципиальный момент для сокращения инвалидизации и обеспечения всех нуждающихся соответствующей терапией – это введение общего регистра больных РА, как взрослых, так и детей. Мы мечтаем о том, чтобы каждый пациент получал эффективное лечение», — отмечает академик Насонов.
 21.09.2009
21.09.2009  8445 Показ
8445 Показ
Администрация сайта med-practic.com не несет ответственности за содержание информации
Источник
В России разработано инновационное лекарство для лечения заболеваний
опорно-двигательного аппарата, включая артрит и артроз. Оно относится к
нестероидным противовоспалительным препаратам. Существующие на рынке
лекарства лишь на время облегчают симптоматику болезней суставов. Новое
же средство способно не только эффективно лечить хронические
воспалительные процессы, но и куда менее токсично для организма. Препарат прошел испытания на животных и готов к клиническим исследованиям. На рынке он может появиться в 2023 году.
Хроническая проблема
В
Казанском (Приволжском) федеральном университете разработали новое
нестероидное противовоспалительное средство (НПВС). Хронические
заболевания опорно-двигательного аппарата, такие как артрит и артроз,
часто приводят к инвалидности, а препараты, которые при них назначают
(ибупрофен, диклофенак и другие), недостаточно эффективны и при этом
разрушают слизистую оболочку желудка, оказывают негативное влияние на
сердечную деятельность человека.
— Ревматоидный артрит и остеоартроз
поражают до 30% взрослого населения во всем мире, — сообщил «Известиям»
один из разработчиков препарата, ведущий специалист НОЦ фармацевтики КФУ
Константин Балакин. — Среди людей в возрасте старше 60 лет эта
патология распространена в еще большей степени. У 50% населения выявляют
заболевания суставов, а с ишиалгией (воспаление седалищного нерва) и
люмбаго (прострел в нижней части спины) в течение жизни сталкивается
едва ли не каждый человек. Еще одна серьезная проблема — высокие гастро-
и кардиотоксичность имеющихся лекарств. В настоящий момент существует
острая необходимость в эффективных и безопасных противовоспалительных
препаратах.
Два в одном
В КФУ разработали и запатентовали
молекулу нестероидного противовоспалительного средства нового поколения,
получившую название KFU-01. Это так называемое пролекарство, которое
после попадания в организм под воздействием биохимических факторов
высвобождает два активных компонента: пиридоксин (одна из форм витамина
В6) и напроксен (сильнодействующее НПВС), обладающих уникальным
синергетическим действием. В результате достигается эффективность и
безопасность, которыми не обладает ни один из известных препаратов этой
категории.
— Исследования на животных показали, что KFU-01 обеспечивает
наступление ярко выраженного противовоспалительного эффекта на модели
как острого, так и хронического воспаления, что выделяет его среди всех
доступных НПВС, — отметил Константин Балакин. — Также существенно
усилены анальгетические эффекты. Принципиальная особенность — в том,
что, в отличие от любого нестероидного противовоспалительного средства,
KFU-01 практически не оказывает негативного влияния на слизистую
оболочку желудка.
Ученые подчеркивают, что эффект многократного
усиления свойств действующих компонентов был достигнут благодаря
особенностям фармацевтического молекулярного дизайна. Метаболизм и
фармакокинетика полученного соединения обеспечивают оптимальное
соотношение концентраций активных компонентов в очагах воспаления, что
позволяет эффективно их подавлять. При этом, если просто одновременно
принимать пиридоксин и напроксен, подобного синергетического эффекта не
наблюдается.
По назначению врача
Проект
по созданию нового противовоспалительного средства поддержан
Национальной технологической инициативой. Разработка имеет хорошие
перспективы на фармацевтическом рынке, сообщил «Известиям» заместитель
руководителя направления «Биомедицина» рабочей группы национальной
технологической инициативы «Хелснет» Андрей Ломоносов.
— Самые
гениальные решения всегда очень просты. Тут мы видим как раз такой
случай, когда из двух существующих лекарств удалось получить нечто
совершенно уникальное, — отметил он.
НПВС ежегодно в мире принимают более 300 млн человек, при этом только одна треть — по назначению врача,
сообщила «Известиям» заведующая клиникой госпитальной терапии
Сибирского государственного медицинского университета Татьяна Агеева
— Следствием лечения и особенно бесконтрольного приема препаратов
оказывается высокая частота развития нежелательных явлений, спектр
которых достаточно обширен, — сообщила она. — Наиболее серьезные —
эрозивно-язвенные поражения желудочно-кишечного тракта, которые подчас
сопровождаются опасными для жизни кровотечениями. Поэтому разработка
препаратов, сочетающих высокую противоболевую и противовоспалительную
активность с минимизацией вредного воздействия на другие системы и
органы, весьма актуальна.
Новый препарат переходит в стадию
клинических испытаний, на рынке он может появиться в 2023 году.
Разработчики предполагают, что им удастся осуществить продажу
международной лицензии.
Как писали «Известия», российские ученые
из ФГБУ «ГНЦ Институт иммунологии» ФМБА России создали первый в мире
генно-инженерный препарат от аллергического ринита. Лекарство в форме
обычного назального спрея снимает не только неприятные симптомы —
насморк и чихание, но и само воспаление слизистой носа. Специалисты,
запатентовавшие вещество, доказали его эффективность и безопасность на
животных. Сейчас новый препарат проходит стадию клинических испытаний.
Мария Недюк
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
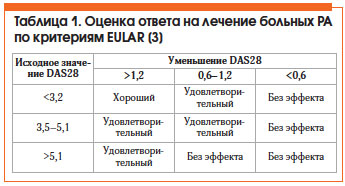
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

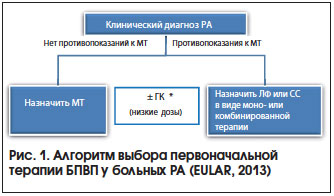
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
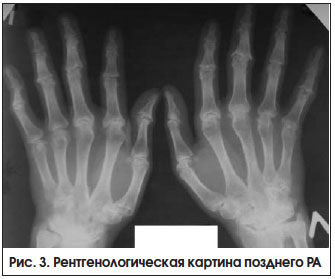
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
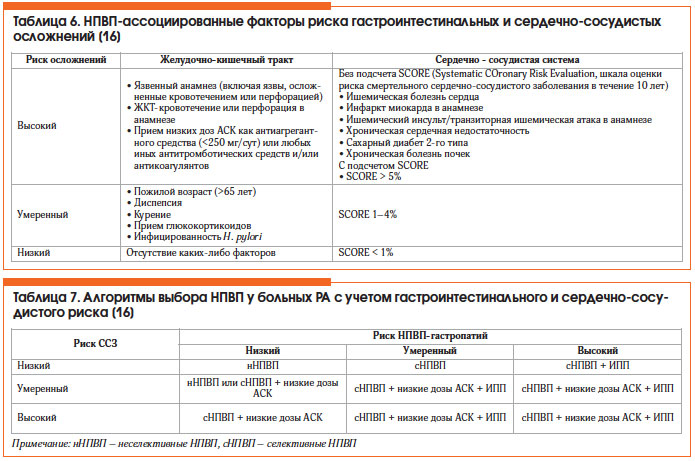
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник