Ревматоидный артрит распространенность в мире

- Главная
- Статьи
- Ваше здоровье
- Ревматоидный артрит в глобальном масштабе
04
Сентября
2012
Если враг не сдается…
Эпидемия ревматоидных заболеваний грозит разорить системы здравоохранения многих стран
Алла Астахова, «Итоги» № 36-2012
Это десятилетие доставит немало хлопот специалистам по борьбе с аутоиммунными заболеваниями. Недавно на конгрессе EULAR (Европейская лига по борьбе с ревматизмом) был обнародован неутешительный прогноз: к 2015 году количество больных ревматоидным артритом вырастет на 75 процентов по сравнению с 2005-м. И это при том, что в мире соответствующий диагноз уже поставлен 21 миллиону человек. Проблема остро стоит и в России – в нашей стране от этой болезни страдают порядка 850 тысяч человек.

На карте показаны потери, которые несут разные страны из-за распространения ревматического артрита, измеренные в единицах DALY (Disability-adjusted life year – год жизни с поправкой на инвалидность). Один DALY обозначает один недожитый год здоровой активной жизни на 100 тысяч населения. Россия оказалась среди стран, где это заболевание чаще всего приводит к инвалидности
Сегодня ревматоидные заболевания – одни из самых тяжелых по затратам на лечение. В США, например, подсчитали, что ежегодно тратят до 8,4 миллиарда долларов на борьбу с артритом: каждый пятый доллар из всех прямых расходов на медицину. А косвенный ущерб из-за потери нетрудоспособности может дойти почти до 11 миллиардов в год. Если количество случаев аутоиммунных заболеваний будет расти такими же темпами, банкротами окажутся национальные системы здравоохранения в целом. Так что прорывов на этом фронте с нетерпением ожидают не только те, кто из-за постоянной боли в суставах может передвигаться с трудом. Какие крепости собирается штурмовать в ближайшее время армия ревматологов?
Опознать врага
Предупредить ревматоидный артрит практически невозможно. Он может впервые проявиться после тяжелой физической нагрузки, эмоционального шока, утомления, в период гормональной перестройки. В том-то вся и беда, что причины его развития в организме доподлинно неизвестны. Многочисленные исследования показали: этим недугом страдает в среднем каждый сотый. И почему-то у слабого пола он встречается гораздо чаще. Есть и другие факторы риска: наследственность, курение. При этом заболевания суставов – вовсе не удел стариков. Из 80 тысяч, ежегодно получающих инвалидность в связи с ревматическими заболеваниями, половину составляют люди активного возраста: мужчины – до 49 лет, женщины – до 44. Ювенильным идиопатическим артритом болеют дети.
А недавние исследования выявили связь распространения ревматоидного артрита с эпидемией ожирения, стремительно набирающей обороты. По прогнозам ВОЗ, количество людей с излишним весом с 2005 по 2015 год увеличится в мире на те же самые 75 процентов, что и в случае с артритом. Причем риск заболеть артритом среди страдающих ожирением увеличивается именно у женщин. Впрочем, иммунологи и в этом случае не торопятся назвать избыточный вес причиной развития артрита. «Я бы не стал среди них искать причину и следствие, – говорит научный руководитель исследовательского центра «Иммункулус» Александр Полетаев. – Нарушения метаболизма стали настоящим бичом современности. Возможно, и ревматоидный артрит, и ожирение связаны с каким-то фактором, определяющим обмен веществ. Тут может быть повинен и образ жизни современного человека, и многочисленные неблагоприятные воздействия окружающей среды».
Впрочем, кое-какие предположения о природе артрита у специалистов все же имеются. Считается, что в основе лежат иммунные нарушения: организм не распознает собственные клетки и начинает атаковать их как чужие. Так называемые иммунные комплексы откладываются в тканях. Это постепенно и приводит к повреждению суставов.
Некоторые специалисты предполагают, что заболевание способно развиваться в результате инфекции – воспаление является его первым признаком. Впрочем, антибиотики тут не действуют, так что до сих пор непонятно, верно это предположение или нет. Медики научились определять грозную болезнь по ревматоидному фактору – в сыворотке крови больных есть антитела, атакующие их же собственные иммуноглобулины. Но вот незадача: приблизительно у 15 процентов больных этого фактора вовсе не находят. А у пожилых людей его наличие может не иметь никакого отношения к ревматоидному артриту. Получается, что вовремя определить недуг совсем непросто. Сейчас для этого врачи используют и анализ разных показателей крови, и томографию, и рентген, и УЗИ. Но что это дает?
Ближе к цели
Современные специалисты делают все возможное, чтобы диагностировать болезнь как можно раньше. Ведь без адекватного лечения она может сделать человека глубоким инвалидом всего за пять лет. К тому же ревматоидный артрит – системное заболевание. Оно поражает не только суставы и позвоночник. Страдают почки, легкие и даже кожа. Ускоренными темпами развивается атеросклероз сосудов, поэтому от 30 до 50 процентов больных артритом умирают от инсульта, инфаркта, сердечной недостаточности. Однако сейчас появилась возможность не только надолго отодвинуть наступление грозных последствий, но и достичь ремиссии – состояния, когда развитие заболевания приостанавливается настолько, что его признаки практически не проявляются. Раньше врачи начинали лечение с наименее эффективных лекарств, переходя к более сильным препаратам. Особого эффекта это не имело – рано или поздно 70 процентов больных становились инвалидами, лишенными возможности двигаться. Но в 2010 году Американский колледж по ревматологии (ACR) и EULAR определили новую цель борьбы.
Теперь болезнь лечат агрессивно на самых ранних стадиях: стараются обнаружить ее как можно раньше и добиваются ремиссии, применяя современные препараты. Эта концепция называется Treat-to-Target, в вольном переводе – «лечить до ремиссии». Впрочем, проблемы есть и тут. Дело за малым: понять, что такое ремиссия. Похоже, в ближайшее время медикам придется серьезно поработать над тем, чтобы улучшить диагностику. «Сейчас все существующие критерии ремиссии базируются на клинических и лабораторных параметрах, – говорит Микель Остергард, профессор университета Копенгагена. – Однако современные методы визуализации – МРТ и ультрасонография – могут дать другую картину».
Существует еще одна проблема: новые генно-инженерные биопрепараты (их называют еще биологическими агентами), благодаря которым и был достигнут прогресс в лечении, стоят недешево. Конечно, они нужны не всем больным: по некоторым данным, они подходят лишь приблизительно 15 процентам пациентов. Однако врачи хотели бы в каждом конкретном случае иметь возможность назначать современное лечение, если оно необходимо. Пока из 46 европейских стран лишь 36 оплачивают такие лекарства своим гражданам. Да и там, где доступ к новым препаратам есть, существует большая разница по уровню финансирования.
Например, Турция тратит на лекарства для одного больного ревматоидным артритом 9431 евро в год, а Германия – 21 349. Однако всех в отношении неравенства, похоже, переплюнула Россия. У нас неодинаковые условия лечения для жителей разных регионов страны. «В России за эти препараты вроде бы платит государство, – рассказывает врач-ревматолог одной из столичных клиник. – Но на деле все зависит от того, в каком регионе человек живет – богатом или бедном. Получается, что мы вынуждены подбирать не те лекарства, которые подходят пациенту, а те, за которые сможет заплатить регион, в котором он живет. Конечно, это несправедливо. Так просто не должно быть».
Вот и выходит, что в нашей стране доступ к дорогостоящим «биологическим агентам» у больных появляется часто только в том случае, если они получают инвалидность. Но ведь лечить человека нужно именно для того, чтобы он не стал инвалидом… Сейчас европейские страны разрабатывают критерии доступности биопрепаратов. «Должны существовать общие стандарты ЕС, определяющие доступ к лечению для тех пациентов, которым оно действительно необходимо», – говорит Полина Путник из университета Маастрихта, автор специального исследования на эту тему. Тут нам не грех поучиться у европейцев и сделать так, чтобы доступ к подобным лекарствам был равным хотя бы для жителей всех регионов России. Иначе лечение в соответствии с едиными стандартами становится фикцией.
Из чего выбрать?
Впрочем, проблемы существуют и там, где нет перебоев с дорогостоящими «биологическими агентами». Как выяснилось, пациенты склонны преувеличивать действие биотехнологических препаратов. Исследования показали: состояние больных улучшается обычно в течение первого года приема таких лекарств. Затем наступает период стабилизации, который может длиться достаточно долго. Ученые из Университета Калгари тщательно проследили все параметры состояния больных – они изучали и лабораторные данные, и результаты опросов. Оказалось, через четыре года после того, как состояние стабилизировалось, больные начинают приписывать себе улучшение. Конечно, врачам есть из чего выбрать – в мире сегодня существует порядка десяти основных биотехнологических препаратов для лечения ревматоидного артрита. В Европе применяется восемь. В России – семь. Лекарств так много, что специалисты могут позволить себе роскошь проводить клинические исследования нового типа – они сравнивают действие препаратов не с плацебо, а с другими биотехнологическими препаратами. Впрочем, как ни сравнивай, ясно, что пока ни один из них не излечивает ревматоидный артрит, а лишь приостанавливает развитие заболевания.
Именно поэтому врачи так напряженно следят за новыми открытиями фундаментальных механизмов развития ревматоидного артрита. Исследователи из госпиталя специальной хирургии в Нью-Йорке недавно выявили еще одно нарушение иммунной системы, которое может быть причиной заболевания. Речь идет о нарушениях межклеточных сигналов. Ученые показали, что такие нарушения могут повлиять на развитие макрофагов – иммунных клеток, атакующих посторонние патогены. Сейчас они хотят проверить эту теорию на лабораторных животных. И если докажут свою правоту, то тут же приступят к созданию нового лекарства.
«Вполне вероятно, что на этом пути их может ждать успех, – прогнозирует Александр Полетаев. – Ведь механизм развития иммунного ответа во многом сводится именно к передаче сигналов от одной клетки к другой. Аутоиммунные заболевания могут быть связаны с нарушением таких сигналов».
Однако и в этом случае мы вряд ли получим волшебную таблетку, приняв которую пациент наутро проснется здоровым. А потому ревматологи сегодня не пренебрегают ничем, что могло бы улучшить состояние больных. Изучают роль физических упражнений – доказано, что те, кто регулярно занимается, чувствуют себя лучше. Проводят специальные тренинги, обучающие справляться с болью. Изучают, как влияют те или иные симптомы заболевания на жизнь пациентов. Например, скандинавские ученые выяснили: утренняя скованность – затруднения в движениях – у более чем 70 процентов больных приводит к тому, что они вынуждены оставлять работу. Ведь нельзя же регулярно опаздывать в офис. Между тем врачи раньше считали этот симптом не особенно важным по сравнению с болью и воспалением. Теперь они изменят к этому отношение и, скорее всего, предложат дополнительные методы лечения. А норвежские исследователи решили поинтересоваться, как обстоят у больных ревматоидным артритом дела на личном фронте. Оказалось, что у 82 процентов из них есть партнер. Значит, жить с этим недугом можно, надеясь на то, что победа над ним не за горами.
Портал «Вечная молодость» https://vechnayamolodost.ru
04.09.2012
назад
Читать также:
03
Декабря
2009
Генетически модифицированные Т-лимфоциты для терапии артрита
После введения генетически модифицированных лимфоцитов мышам с артритом в очагах ревматоидного воспаления наблюдалось уменьшение количества T-хелперов и разрушительных процессов костной ткани, т.е. снижение аутоиммунной реакции.
читать
28
Января
2009
Генотерапия при ревматоидном артрите: проверено на людях
Соскобы ткани из суставов двух пожилых пациенток, страдающих тяжелым артритом, инфицировали ретровирусом со встроенным геном белка, блокирующего действие интерлейкина-1. Затем экспериментаторы размножили захваченные вирусом клетки и вновь подсадили их в суставы пациенток. Уже через 4 недели обе женщины почувствовали себя лучше.
читать
02
Сентября
2008
Начинаются испытания вакцины против ревматоидного артрита
Вакцины на основе собственных клеток пациента уже проходят клинические испытания у пациентов с онкологическими заболеваниями, но при ревматоидном артрите их испытают впервые. Экспериментальная стадия была весьма впечатляющей, и ученые рассчитывают, что вакцина сможет специфически подавлять патологический аутоиммунный ответ.
читать
22
Июня
2012
Новые данные о бесполезности и даже вреде гиалуроновой кислоты при артрозе
Внутрисуставные инъекции гиалуроновой кислоты приносят лишь временное и незначительное облегчение при артрите коленных суставов, клинически не обоснованы и даже опасны.
читать
24
Августа
2010
Артрит помог найти лекарство от болезни Альцгеймера
Болезнь Альцгеймера, вероятно, удастся победить при помощи артрита. Точнее – белка, который синтезируется в клетках при этой болезни, поражающей суставы.
читать
02
Декабря
2009
Бегом к артрозу!
Интенсивные занятия бегом или прыжками заметно повышают риск развития артроза. А спорт с низкой нагрузкой на скелет (плавание, велосипедный спорт) может оздоровить поврежденные хрящи и предотвратить заболевания здоровых суставов.
читать
Источник
Ревматоидный артрит — тяжелое заболевание, которому подвержено от 0,5 до 2% людей по всему миру (рис. 1) [1]. Неутешительна ситуация и в России: по данным фармацевтической фирмы Roche, ревматоидным артритом болеет около миллиона человек. Женщин среди них большинство: по статистике, они заболевают в пять раз чаще мужчин.
Рисунок 1. Распространенность ревматоидного артрита в мире. Приведены данные по годам жизни, скорректированным по нетрудоспособности (DALY) — показателю, оценивающему суммарное «бремя» болезни.
Артрит — это собирательный термин для обозначения практически любых воспалительных болезней суставов. Соответственно, и причин для развития этого состояния достаточно много. Болезнь, которая называется ревматоидным артритом, обусловлена поражением сустава иммунными клетками, атакующими собственные ткани организма. Из-за этой атаки развиваются отек, избыточное разрастание тканей сустава и в конечном счете его деформация.
Сильные боли в суставах и их малоподвижность приводят к инвалидизации пациентов с ревматоидным артритом. К сожалению, пока не существует «волшебной пилюли», способной вылечить человека с этим диагнозом. Современная медицинская практика предполагает лишь симптоматическое лечение, позволяющее купировать боль и подавлять воспалительную реакцию. К тому же врачам приходится бороться с большим количеством осложнений, сопровождающих болезнь. Например, с почечной недостаточностью и инфекциями — основными причинами смерти пациентов с ревматоидным артритом.
Факторы, приводящие к развитию ревматоидного артрита, до сих пор не до конца известны. Тем не менее понятно, что для того чтобы заболеть, необходимо иметь к этому генетическую и эпигенетическую предрасположенность. Но и этого недостаточно: пусковым фактором для развития ревматоидного артрита у предрасположенных к нему пациентов служит стресс, причем совершенно разного рода — от перенесенной инфекции и переохлаждения до курения и ожирения.
Иммунитет на страже беспорядка: как иммунные клетки разрушают сустав
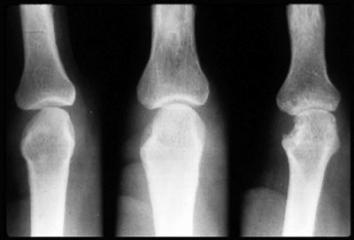
При ревматоидном артрите наиболее часто поражаются суставы кистей рук — межфаланговые и пястно-фаланговые (схема строения сустава приведена на рисунке 3). Клетки иммунной системы мигрируют в суставную сумку, вызывая ее воспаление, или синовит. Воспаление ведет к разрушению хряща и дальнейшей эрозии костной ткани. Так как хрящевая ткань практически не способна восстанавливаться, а костная в ходе постоянных процессов разрушения и регенерации деформируется, ревматоидные поражения остаются с пациентами на всю жизнь. Характерная картина поражения суставов кисти рук показана на рисунке 4.
Рисунок 3. Схема строения сустава. Сустав — это подвижное соединение костей скелета, позволяющее им совершать движения относительно друг друга. Поверхности костей, входящие в сустав, покрыты хрящевой тканью. Между ними находится суставная полость, содержащая синовиальную жидкость — «смазочный материал» для предотвращения взаимного трения поверхностей хрящей, а также для питания и увлажнения сустава. Весь сустав снаружи заключен в суставную сумку. Наружный слой сумки, образованный плотной волокнистой соединительной тканью, защищает сустав от внешних воздействий. Кроме того, к нему прикрепляются связки, отвечающие за подвижность сустава. Внутренний слой суставной сумки, который называется синовиальной оболочкой, выстилает всю внутреннюю поверхность сустава за исключением хрящей и отвечает за выработку суставной жидкости. Этот слой обильно иннервирован и снабжен кровеносными сосудами, осуществляющими обмен веществ.
Рисунок 4. «Ревматоидная кисть» — характерная деформация суставов кисти руки при ревматоидном артрите. Именно она позволяет отличить ревматоидный артрит от аналогичных поражений конечностей при других заболеваниях, например, псориатическом артрите и системной красной волчанке.
Для того чтобы началась «оккупация» (инфильтрация) сустава иммунными клетками, в синовиальной оболочке должны произойти функциональные изменения. Эндотелий сосудов начинает производить молекулы адгезии, необходимые для закрепления проплывающих мимо лейкоцитов и их проникновения из сосудистого русла в ткань. Кроме того, происходит разрастание сосудистой системы (неоангиогенез), что также помогает усиленной инфильтрации сустава иммунными клетками [3]. Освежить знания по строению и функционированию иммунной системы можно, обратившись к вводной статье цикла «Иммунитет: борьба с чужими и… своими» [4].
Фибробласты синовиальной сумки тоже активируются. Они становятся подвижными, теряют способность останавливать свое деление при контакте с другими клетками (так называемое контактное ингибирование) и избегают клеточной гибели (апоптоза). Это происходит из-за мутаций в генах опухолевых супрессоров — например, p53 [5], — а также из-за повышения продукции белка синовиолина, способного регулировать экспрессию p53, и стрессовых молекул, включая белки теплового шока.
Кроме того, фибробласты начинают производить большие количества матриксных металлопротеиназ и провоспалительных хемокинов — цитокинов, привлекающих иммунные клетки. Матриксные металлопротеиназы — специальные ферменты, способные расщеплять белковые компоненты внеклеточного матрикса. Они разрушают коллагеновые сети, составляющие основу хряща [6]. Тканевых ингибиторов металлопротеиназ, тоже вырабатываемых фибробластами, оказывается недостаточно для остановки лавинообразного процесса разрушения сустава.
Иммунные клетки, привлекаемые цитокинами, инфильтрируют синовиальную оболочку сустава. В таком иммунном инфильтрате присутствуют Т- и В-лимфоциты, макрофаги, нейтрофилы, тучные клетки и другие клетки врожденного иммунитета.
Несмотря на обилие в пораженном суставе Т-клеток, их функциональная роль до сих пор малопонятна. Попытки лечения пациентов путем прямого подавления активности Т-лимфоцитов (например, с помощью иммуносупрессанта циклоспорина) оказались неэффективны. Это может объясняться тем, что в патогенезе ревматоидного артрита принимают участие разные субпопуляции Т-лимфоцитов, чьи эффекты могут быть диаметрально противоположными. С одной стороны, иммуносупрессанты подавляют, как это и нужно, активность Т-хелперов первого типа (Th1) и Th17-лимфоцитов, которые выделяют множество провоспалительных цитокинов, усиливающих воспаление и привлекающих всё новые иммунные клетки в сустав. С другой стороны, они точно так же подавляют дифференцировку и функциональность регуляторных Т-клеток, которые могли бы остановить воспалительную реакцию.
В то же время использование абатацепта — препарата на основе молекулы CTLA-4 (не путать с терапевтическими антителами к ней [7]), блокирующего костимулирующий сигнал между лимфоцитом и антигенпрезентирующей клеткой, — оказалось достаточно успешным. Такого эффекта можно было ожидать, ведь в синовиальной оболочке достаточно много дендритных клеток, способных активировать Т-лимфоциты.
Свой вклад в «запутывание» роли Т-лимфоцитов может вносить динамика заболевания. Дело в том, что Т-клетки важны для запуска аутоиммунного процесса, однако позже, когда в воспалительный каскад вовлекаются всё новые и новые иммунные клетки (например, макрофаги), они отходят на второй план. Лечение же препаратами, нацеленными на Т-лимфоциты, начинается только после появления симптомов, то есть уже на втором этапе заболевания. Неудивительно, что при такой запаздывающей стратегии они оказываются неэффективными.
В-клетки и плазматические клетки синовиальной оболочки также участвуют в патогенезе ревматоидного артрита. Как правило, В-клетки образуют с Т-клетками особым образом пространственно организованные скопления, называемые третичными лимфоидными структурами. Напоминая по строению лимфоузлы, они осуществляют ту же функцию: способствуют встрече антигенпрезентирующих клеток с лимфоцитами и дальнейшему их созреванию. В роли антигенпрезентирующей клетки может выступать и сам В-лимфоцит. Кроме того, В-клетки синтезируют провоспалительные цитокины, чем дополнительно поддерживают работу патологического каскада.
Аутоантитела, продуцируемые В-лимфоцитами, уже много лет используются в качестве биомаркеров в диагностике ревматоидного артрита. Но их нельзя воспринимать лишь как «немых свидетелей» заболевания — они вносят вклад в его развитие и даже называются артритогенными. Как всё происходит, пока не совсем ясно, однако корреляция темпов развития болезни с уровнем в крови таких антител надежно установлена. Антитела (как правило, класса IgM) к собственным иммуноглобулинам класса IgG называют ревматоидным фактором (РФ). Это одно из проявлений нарушения толерантности к собственным антигенам, которым и характеризуется аутоиммунный процесс. Считается, что РФ образует с IgG макроскопические иммунные комплексы, которые наносят механические повреждения стенкам сосудов и синовиальным оболочкам, однако это не единственный возможный механизм патогенного действия РФ.
В сыворотке крови пациентов с ревматоидным артритом часто обнаруживают и антитела к циклическому цитруллинированному пептиду (АЦЦП). Цитруллин — это одна из аминокислот в организме, которая не кодируется в ДНК специфическим кодоном, а образуется из аргинина уже после синтеза белка (схема реакции представлена на рисунке 5). Замена аргинина на цитруллин влияет на химические свойства белка и делает его более гидрофобным, что сказывается на его пространственной структуре. Такие необычно свернутые белки могут быть замечены иммунной системой, и к ним образуются аутоантитела. Во многих белках синовиальной жидкости, включая фибрин и фибриноген, есть аргининовые остатки, которые в условиях воспаления модифицируются в цитруллин и вызывают аутоиммунный ответ. Согласно последним данным, РФ и АЦЦП усиливают действие друг друга [8].
Рисунок 5. Схема цитруллинирования белков. В реакции принимают участие ферменты деиминазы, заменяющие кетоиминовую группу аргинина (=NH) на кетоновую (=O).
Макрофаги — основные продуценты провоспалительных цитокинов, ответственных за развитие синовита. Кроме того, они синтезируют активные формы кислорода и азота, а также ферменты, разрушающие межклеточный матрикс. Этим же занимаются и другие клетки врожденного иммунитета, присутствующие в воспаленном суставе, — например, нейтрофилы и тучные клетки. Но всё же пальму первенства в запуске воспаления следует отдать макрофагам.
Коктейль из провоспалительных цитокинов запускает дифференцировку остеокластов, осуществляющих резорбцию кости, то есть попросту разрушающих ее. Под воздействием противовоспалительных препаратов этот процесс удается замедлить, но вернуть кости первоначальный облик невозможно, так как она не в состоянии регенерировать с сохранением прежней архитектуры.
Орел или решка: генетическая и эпигенетическая предрасположенность к заболеванию ревматоидным артритом
Ревматоидный артрит — комплексное заболевание, на развитие которого влияют как генетические факторы, так и факторы окружающей среды. Полногеномный поиск ассоциаций [9] показал, что существенное влияние на возникновение и развитие этого заболевания оказывают определенные варианты генов, регулирующих работу иммунной системы.
Сильнее всего на предрасположенность к ревматоидному артриту влияют гены главного комплекса гистосовместимости. Как мы помним из первой статьи этого цикла [4], именно кодируемые этими генами белки отвечают за презентирование антигена Т-лимфоцитам. Какие-то их варианты могут осуществлять этот процесс эффективнее в отношении собственных антигенов, способствуя тем самым запуску аутоиммунного процесса. Одним из самых интересных в этом отношении считается ген HLA-DRB1 [10], чья связь с ревматоидным артритом давно известна. Он кодирует компоненты поверхностного рецептора HLA-DR антигенпрезентирующих клеток, взаимодействующего с Т-клеточным рецептором. Различные аллели этого гена — например, кодирующие белки с аминокислотным мотивом QKRAA, — связаны с наибольшей предрасположенностью к заболеванию [11]. К самым «неблагоприятным» относят варианты из семейства DRB1*04 (определяющие серотип HLA-DR4) [12].
Аллельные варианты генов множества белков, вовлеченных в активацию Т-лимфоцитов, также отвечают за предрасположенность их носителей к ревматоидному артриту. Среди таких белков — молекулы, связанные с костимулирующим сигналом (CD28, CTLA-4), провоспалительные цитокины и их рецепторы (IL2, IL2RA, IL21), необходимые для функционирования Т-клеток, а также различные ферменты — важные внутриклеточные игроки в активации лимфоцитов (PTPN22, PRKCQ, TAGAP). Взаимодействие специфических аллельных вариантов разных генов (например, HLA-DRB1 и PTPN22) увеличивает вероятность заболевания [13].
Эпигенетические механизмы тоже могут регулировать работу иммунной системы, повышая риск развития ревматоидного артрита. Действие регуляторных РНК, модификации гистонов или ДНК могут приводить к изменению привычного «графика» работы ключевых генов, вовлеченных в патогенез.
Некоторые факторы окружающей среды увеличивают вероятность заболевания у людей, имеющих ассоциированные с ревматоидным артритом аллели. К таким факторам относят, например, курение [14]. Это связано с тем, что курение — серьезный стресс для дыхательной системы, который может повышать уровень посттрансляционных модификаций белков, в том числе и цитруллинирования. А, как мы помним, подобные неординарные белки и становятся антигенами в аутоиммунном процессе. Например, цитруллинированную форму α-енолазы можно найти примерно у 50% АЦЦП- положительных пациентов.
Инфекция — чека для запуска ревматоидного артрита
Инфекционные агенты — вирусы и бактерии — могут способствовать развитию ревматоидного артрита, причем, по-видимому, многими способами. Наиболее известный механизм — так называемая молекулярная мимикрия. Некоторые молекулы — чаще всего пептиды, входящие в состав микроба, — могут иметь структуру, схожую со структурой собственных биомолекул организма. Во время инфекции иммунная система распознает такие молекулы как чужеродные и эффективно борется с их носителями, но после нападает на клетки собственного организма, содержащие похожие антигены. В случае с ревматоидным артритом так может происходить, например, при заражении вирусом Эпштейна-Барр [15], цитомегаловирусом, кишечной палочкой и различными протеями.
Кроме того, при инфекционном заболевании образуются иммунные комплексы, состоящие из антигенов и специфических к ним антител. Если комплексов много, то такие антитела сами могут стать антигенами. Антитела против антител и есть тот самый ревматоидный фактор, о котором мы говорили ранее.
Инфекционные агенты могут и напрямую способствовать развитию ревматоидного артрита. Недавно было показано, что гигиена ротовой полости может влиять на заболеваемость ревматоидным артритом [16]. Дело в том, что бактерия, вызывающая пародонтоз, Porphyromonas gingivalis, способна синтезировать деиминазу и, соответственно, принимать участие в цитруллинировании белков хозяина, то есть человека.
Всё больше данных указывает на то, что состав микробиоты кишечника — еще один важный фактор, влияющий на вероятность развития ревматоидного артрита [17], [18], [19]. В модельных системах удалось убедительно показать, что определенные виды бактерий ассоциированы с ревматоидным артритом. Возможно, в недалеком будущем нас ждет разработка специальной диеты, позволяющей держать их под контролем и этим снижать риск развития аутоиммунитета.
Источник