Ревматоидный артрит в иммунологии
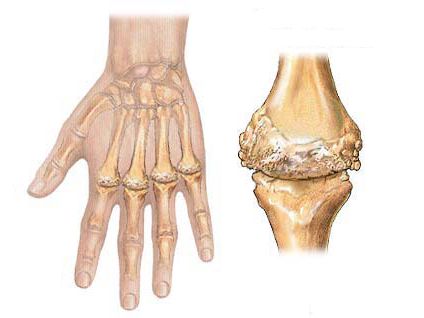
Ревматоидный артрит (РА) – хроническое системное заболевание, характеризующееся поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита.
РА регистрируется во всех странах мира и во всех климато-географических зонах с частотой 0,6-1,3%. Чаще болеют женщины, чем мужчины (3-4:1).
В основе развития хронического воспалительного процесса в суставах лежит реакция гиперчувствительности III типа, обусловленная иммунными комплексами (механизмы развития реакции гиперчувствительности III типа изложены в главе «Аллергия. Механизмы развития аллергических реакций»). В результате аутоиммунизации организма формируются аутоантитела, называемые ревматоидным фактором, которые реагируют с эпитопами Fc области IgG. Классическим ревматоидным фактором являются IgМ-антитела. Эти аутоантитела (IgМ или IgG), соединяясь с «нормальными» циркулирующими иммуноглобулинами G, формируют комплексы IgМ-IgG, которые, депонируясь в суставах, вызывают каскад реакций, приводящих к активизации системы комплемента, фагоцитов, лимфоцитов. Активация комплемента приводит к образованию МАК и хемокинов (С3а и С5а), а активация лимфоцитов вызывает продукцию провоспалительных цитокинов (ИНФ-гамма, ФНО? и др.), взаимодействие нейтрофилов с иммунными комплексами вызывает высвобождение протеолитических лизосомных ферментов, катеонных белков, простагландинов, кининов, гистамина, активных форм кислорода в межклеточное пространство. Весь этот комплекс факторов вызывает воспалительный процесс в тканях суставов, сосудах и внутренних органов, а также развитие дегенеративно-деструктивных процессов в хряще, что сопровождается его разрушением с последующим развитием фиброзного и костного анкилоза. В разрушении хряща и изменениях в костях большую роль играет также грануляционная ткань.
Ревматоидный артрит также характеризуется поражением сосудов всех калибров. В наибольшей степени поражаются мелкие сосуды. Изменения, происходящие в средних и крупных сосудах, в большой степени связаны с процессами в vasa vasorum и главным образом связаны с ишемизацией сосудистой стенки. Наиболее часто наблюдаются продуктивные васкулиты, тромбоваскулиты, реже панваскулиты типа узелкового периартериита.
Генерализованное поражение сосудистого русла при РА приводит к тому, что в процесс вовлекаются кожа, скелетная мускулатура, серозные оболочки, внутренние органы.
Ревматоидный процесс обычно локализуется в периферических суставах, поэтому основное значение в клинической картине болезни приобретает артриты конечностей.
Основными признаками РА являются:
1) Скованность в суставах по утрам, длящаяся не менее 1 ч до полного восстановления подвижности;
2) Артрит, характеризующийся отечностью мягких тканей вокруг трех или более суставов;
3) Артрит, характеризующийся отечностью проксимальных межфалан-говых, пястнофаланговых или запястных суставов;
4) Артрит, характеризующийся симметричностью пораженных суставов;
5) Ревматоидные узелки;
6) Наличие в сыворотке крови ревматоидного фактора;
7) Рентгенологические признаки эрозий и/или периартикулярной остеопении мелких суставов рук.
Наличие 4 из указанных признаков является достаточным для установления диагноза РА.
У 80% больных РА протекает без признаков системности и без висцеропатий. Только у 12-13% больных РА носит генерализованную форму. Эта форма помимо полиартрита и лимфаденопатии характеризуется поражением внутренних органов: сердца (перикардит, ревматоидный кардит), легких и плевры (плеврит, фиброзирующий альвеолит), почек (амилоидоз, гломерулонефрит, нефроангиосклероз), желудочно-кишечного тракта, печени, селезенки, нервной системы, кожи (ревматоидные узелки, хронические язвы), глаз (эписклерит, сухой конъюктивит), системы кроветворения. Системные поражения всегда свидетельствуют о неблагоприятном течении процесса и торпидности ко всем методам лечения.
Важными критериями тяжести и характера течения заболевания являются показатели крови. У больных РА почти всегда наблюдаются повышенные значения СОЭ. У тяжелых больных этот показатель может достигать 60-80 мм/час. Раннее и значительное повышение СОЭ и развитие анемии являются плохими прогностическими признаками заболевания. Ревматоидный фактор на ранних стадиях болезни выявляется редко (в 20-30% случаев). Раннее его выявление указывает на неблагоприятное течение болезни, а высокий титр, несмотря на клиническое улучшение, свидетельствует о возможности развития рецидива. Следует заметить, что РФ обнаруживается при многих инфекционных и аутоиммунных заболеваниях.
Показателем активности процесса является диспротеинемия (изменения в соотношении между количеством альбумина и глобулина, а также других белковых фракций крови). При острых и тяжелых случаях течения болезни существенно повышается фибриноген крови, иногда до 0,01 г/л (при норме 0,005 г/л).
Показателем «острой» фазы ревматоидного процесса является С-реактивный белок. В «острый» период заболевания он определяется более чем у 80% больных и отражает динамику ревматоидного процесса, при затихании заболевания – он исчезает из крови.
В основе лечения больных РА лежат следующие подходы: а) воздействие на патогенетические факторы заболевания; б) длительность и этапность лечения; в) дифференцированная терапия в зависимости от формы течения и активности болезни. Для подавления активности и прогрессирования болезни используются средства, воздействующие на аутоиммунные процессы. К средствам «базисной терапии» относятся: препараты золота, хинолинового ряда, иммунодепрессивные средства. Общим свойством средств длительной базисной терапии является их способность оказывать антипролиферативное действие (уменьшать развитие грануляционной ткани, разрушающей хрящ и кость) и тормозить развитие аутоиммунных реакций. Средства «базисной терапии» следует назначать каждому больному РА. В ранней фазе болезни, при преимущественно суставной форме ее течения и минимальной либо средней активности процесса лечение обычно начинают с назначения препаратов хинолинового ряда (резохина, делагила,плаквенила – по 0,25 г 1 раз в сутки) в течение года. Если после этого заболевание продолжает прогрессировать или с самого начала имело прогрессирующий характер течения, показано применение препаратов золота (санакризина, миокризина, кризанола). Лечебный эффект этой группы препаратов связан с их способностью подавлять избыточную продукцию иммуноглобулинов, ингибировать активность лизосомных ферментов лейкоцитов и окислительные процессы в тканях. Препараты золота обладают длительным действием, благодаря их кумулятивным свойствам. Хризотерапия противопоказана при тяжелом течении РА, при котором наблюдаются висцеропатии, васкулиты, заболевания внутренних органов. Соли золота не следует применять при беремености, кормлении, а также одновременно с Д-пеницилламином и цитостатиками. При возникновении токсических осложнений необходимо назначить кортикостероиды (преднизолон в дозе 50-60 мг в день).
При тяжелом течении РА, висцеральных формах, псевдосептическом синдроме, быстром прогрессировании заболевания, варианте, пограничном с СКВ, «базисная терапия» проводится иммунодепрессивными средствами, способными подавить функциональную активность иммунокомпетентных клеток и оказать антипролиферативное действие. С этой целью назначают антиметаболиты, препараты, блокирующие синтез нуклеиновых кислот (метотрексат, азатиоприн) либо алкилирующие вещества (циклофосфамид, хлорбутин и др.), обладающие способностью денатурировать нуклеопротеины. Высокую эффективность в терапии этих больных проявил циклоспорин-А. Стартовая доза препарата составляет 3,0-3,5 мг/кг массы тела в день, через 1-2 месяца от начала лечения доза может быть увеличена до 5,0 мг/кг/день.
В качестве средства «базисной терапии» больным РА назначают Д-пеницилламин. Показаниями к его применению являются активные формы РА, резистентные к терапии глюкокортикостероидными препаратами, непереносимоть больными препаратов золота. Механизм действия Д-пеницилламина заключается в деполимеризации (разрушении) иммунных комплексов путем разрыва дисульфидных связей между глобулиновыми цепями, а также в относительном увеличении растворимой фракции коллагена.
При необходимости средства «базисной терапии» могут сочетаться с противовоспалительными препаратами. Первое место среди средств быстрого противовоспалительного действия занимают глюкокортикостероиды (ГКС). Наиболее широко применяются преднизолон, преднизон, триамциналон, дексаметазон. Обычно доза преднизолона составляет 10-20 мг/сут. При умеренной активности ревматоидного процесса (через 1-2 месяца) дозу ГКС медленно снижают и переходят на применение нестероидных антивоспалительных средств (вольтарена, ортофена и др.)
При суставных формах РА с минимальной и умеренной активностью процесса средства базисной терапии (чаще всего аминохолиновые препараты) сочетают с нестероидными антивоспалительными препаратами (НАВП): ацетилсалициловой кислотой, амидопирином, анальгином, бутадионом, индометацином, реопирином, вольтареном, ортофеном. Клинический эффект от применения НАВП наступает быстро, обычно на 2-3 день лечения и продолжается только в период их применения. После прекращения употребления этих препаратов суставные симптомы возобновляются (боли, экссудативные явления).
Среди иммунокоррегирующих средств в лечении РА используют: антилимфоцитарный гаммаглобулин (0,1 мл п/к в одну руку, через 40 мин 0,1 мл в другую руку и затем черз 40 мин в/м 0,8 мл; далее ежедневно по 1-3 мл. На курс от 8 до 50 мл); антицитокиновые и антилимфоцитарные (анти CD4, CD5, CD7, DR) моноклональные антитела, дренаж грудного лимфатического протока, лимфоцитоферез, плазмоферез, гемосорбцию, каскадную плазмофильтрацию, криоферез (5-6 сеансов). Эти процедуры, как дополнительные к средствам «базисной терапии», позволяют купировать тяжелое течение ревматоидного процесса и эффективно бороться с торпидностью РА к проводимой терапии.
Для подавления местного воспалительноо процесса применяют внутрисуставное введение лекарственных средств. При стойком активном РА отдельных суставов чаще всего внутрисуставно вводят гидрокортизон (по 50-125 мг в крупные суставы, 25-50 мг в средние и 5-10 мг в мелкие суставы). Курс такой терапии может включать 3-5 инъекций с интервалом в одну неделю. Для внутрисуставной терапии также используют кеналог, метипред, дексон, трикорт, дипрофос.
При упорном хроническом артрите коленных суставов с прогрессирующей костно-хрящевой деструкцией показано внутрисуставное введение радиоактивных препаратов золота или иттрия. Эти препараты, фиксируясь в патологически измененной синовиальной оболочке сустава, вызывают разрушение патологической ткани (лекарственная синовэктомия).
Для подавления местного воспалительного процесса применяют аппликации диметилсульфоксида, мазей индометациновой, вольтареновой и др., локальную криотерапию, а также физиотерапевтические процедуры.
В заключение следует заметить, что имеющиеся в распоряжении лекарственные средства позволяют сохранять трудоспособность у 70% больных РА.
Источник
Ревматоидный
артрит (РА) -хроническое заболевание
суставов, неизвестной этиологии, с
которым связано значительное нарушение
трудоспособности и необходимость
значительных затрат в области
здравоохранения. Характеренхронический
воспалительный синовит,обычно с
симметричным вовлечением периферических
суставов, который может прогрессировать
с развитием деструкции хряща, костных
эрозий и деформаций. Наиболее часто
встречающиеся симптомы: боль, припухание
и болезненность пораженных суставов;
утренняя или постоянная скованность,
общие симптомы, такие как слабость,
быстрая утомляемость, похудание.
Внесуставные проявления включают
ревматоидные узлы, васкулит,
офтальмологическую патологию. Начало
РА может быть постепенным или, менее
часто, острым.
В популяции РА
развивается приблизительно у 0,8% (от
0,2% до 2,1%). Уровень общей заболеваемости
увеличивается с возрастом, наиболее
характерен дебют заболевания в возрасте
сорока-пятидесяти лет. Женщины поражаются
приблизительно в три раза чаще мужчин,
однако эти различия уменьшаются с
возрастом. Вероятно, в этиологии РА
играют роль как наследственность, так
и факторы внешней среды. Генетическая
предрасположенность связана с главным
комплексом
гистосовместимости II класса и кодируется
HLA-DR генами.
Функциональная
недостаточность часто имеет место на
ранних стадиях РА и у большинства
пациентов прогрессирует. В течение 2
лет от начала РА более 70% пациентов имеют
рентгенологические признаки поражения
суставов. Темпы прогрессирования
максимальны на ранних стадиях заболевания.
Патогенезревматоиднго артрита.
В норме сустав
выстлан синовиальной мембраной, которая
состоит из 2 слоев клеток, покрывающих
соединительную ткань и кровеносные
сосуды. Синовиальная мембрана состоит
из клеток типа А, имеющих костномозговое
происхождение и принадлежащих к
макрофагальной линии, и клеток типа В
— тканевых клеток, имеющих мезенхимальное
происхождение.
У больных РА в
пораженных суставах развивается
массивная инфильтрация клетками крови,
имеющими костномозговое происхождение
— моноцитами и лимфоцитами, которые, в
основном, инфильтрируют саму синовиальную
мембрану, и полинуклеарными лейкоцитами,
которые мигрируют в синовиальную
жидкость.
Эти иммунные
клетки продуцируют цитокины, которые
связываются с рецепторами на поверхности
иммунных и других типов клеток и
регулируют каскад реакций, в результате
которого развивается хроническое
воспаление. Воспаленную синовиальную
мембрану называют паннусом, она богато
васкуляризирована. Помимо воспаления
синовиальной мембраны, паннус инициирует
местные деструктивные процессы, ведущие
к повреждению хрящевой ткани.
Цитокины могут
потенциировать или подавлять воспаление.
В пораженных суставах при РА
провоспалительные цитокины преобладают
над противовоспалительными Ключевым
провоспалительным цитокином,
способствующими развитию как хронического
воспаления, так и деструкции хряща и
потере костной ткани, является фактор
некроза опухоли (TNFα).
TNFαпродуцируется,
главным образом, макрофагами и
Т-лимфоцитами.
TNFαпроявляет
целый ряд провоспалительных
эффектов:
способствует
воспалительному ответу и индуцирует
экспрессию других провоспалительных
цитокинов, включая IL-1,
IL-6,
IL-8
и GM-CSF,
индуцирует экспрессию молекул адгезии,
таких как межклеточные молекулы адгезии
(ICAM) и Е-селектин, которые способствуют
дальнейшей инфильтрации синовиальной
мембраны иммунными клетками;может
усиливать продукцию таких ферментов,
как металло-протеиназы,которые
усугубляют разрушение хрящевой и других
тканей.
Действие TNFαи других цитокинов, вероятно, лежит в
основе многих проявлений ревматоидного
синовита, таких как воспаление тканей,
повреждение хряща и костной ткани, и
системных проявлений ревматоидиого
артрита.
Диагностика РА.
Для установления
диагноза используются критерии
классификации РА Американской
Ревматологической Ассоциации,
пересмотренные в 1987 году.
Дифференциальный
диагноз следует проводить с системной
красной волчанкой, гонококковым артритом,
болезнью Лайма, анкилозирующим
спондилоартритом и остеоартритом.
Ддиагностические
критерии ревматоидного артрита
1. Общие 2. Критерии* |
* Критерии А-Г |
При установлении
диагноза могут быть полезными лабораторные
данные.Ревматоидный фактор,
который представляет собой аутоантитела
к Fc-фрагменту IgG 1, не является специфичным
для РА, но присутствует более чем у 67%
больных РА. У пациентов, имеющих высокие
титры ревматоидного фактора, более
вероятно тяжелое течение заболевания
и внесуставные проявления.Скорость
оседания эритроцитов (СОЭ)повышена
практически у всех пациентов с активным
РА. Другие острофазовые показатели, в
том числеС-реактивный белок (СРВ),также повышены, и их уровень коррелирует
с активностью заболевания.
Лечение
РА.
Целью лечения
является уменьшение боли, улучшение
или поддержание функции суставов,
снижение выраженности синовита,
предотвращение повреждения структур
суставов, поддержание функций и контроль
над системными проявлениями. Лечение
включает нелекарственные методы, такие
как отдых, физиотерапия и гимнастика,
фармакотерапию и хирургические методы.
Фармакотерапия
РАвключает как препараты, уменьшающие
выраженность симптомов, так и препараты,
модифицирующие течение заболевания.
Классификация
антиревматической терапии (по
материалам 5 заседания Международной
Лиги по Борьбе с Ревматизмом Всемирной
Организации Здравоохранения (МЛБР/ВОЗ),
1993 год). В эту классификацию включены
категории, разработанные европейскими
экспертами, она подразделяет препараты:
тип А
(симптом-модифицирующие),тип В
(болезнь-модицифирующие)тип С
(структурно-модифицирующие).
Классификация
антиревматических препаратов
1. Симптом-модифицирующие II. Модифицирующие А. Нецитотоксические (включают III. |
По |
Класс
симптом-модифицирующихантиревматических препаратов включает
нестероидные противовоспалительные
препараты (НПВП) и кортиокостероиды.
Последние надежно и быстро купируют
симптомы воспаления, однако вызывает
опасения их способность вызвать серьезные
токсические эффекты. Представляется
наиболее вероятным, что частота развития
побочных эффектов кортикостероидов
зависит от дозы. Есть данные, позволяющие
предположить, что низкие дозы
кортикостероидов могут замедлить
рентгенологическое прогрессирование
эрозивного артрита.
Модифицирующие
болезньантиревматические препараты
назывались также медленно действующими
антиревматическими препаратами. Этот
класс включает целый ряд препаратов,
в том числе МТ, циклофосфамид, антималярийные
препараты, соли золота. Механизм действия
многих при РА неизвестен. Предполагается,
что многие из них обладают минимальным,
неспецифическим противовоспалительным
или анальгетическим действием.
Метотрексат (МТ),
антагонист фолиевой кислоты, стал
стандартом терапии больных РА. Хотя
известно, что МТ ингибирует определенные
ферменты, его механизм действия при РА,
обеспечивающий антивоспалительное и
иммуносупрессивное действие, может
быть несколько шире
В связи с
тяжестью клинических проявлений и
прогрессирующим характером РД все
большее признание получает агрессивный
подход к лечению. Такой подход подразумевает
раннее назначение и их комбинирование
для оптимального контроля над воспалением
и уменьшения деструкции суставов на
протяжении заболевания. Когда монотерапия
неэффективна, широко используются
комбинации различных препаратов.
По мере
улучшения нашего понимания иммунологических
процессов, лежащих в основе РА, развиваются
новые биологические методы лечения,
направленные на специфические компоненты
иммунной системы. В противоположность
относительно неспецифическим эффектам
многих, точный механизм действия которых
неизвестен, биологические методы лечения
направлены на специфические молекулы,
принимающие участие в определенных
воспалительных и иммунных процессах.
Анти-TNF-а терапия — новый
метод, при котором связывается и
ингибируется ключевой провоспалительный
цитокин — фактор некроза опухоли альфа.
Анти-TNFα
терапия
Анти-TNFαтерапия представляет собой чрезвычайно
важный новый подход к лечению в тех
случаях, когда оно неэффективно, и РА
прогрессирует, несмотря на рано начатую
агрессивную терапию. Современные
руководства рекомендуют рассматривать
возможность назначения анти-TNFαтерапии пациентам с активным РА после
неэффективного лечения одним или более
препаратами, из группы модифицирующих
болезнь.Активный РА может быть
определен по нескольким показателям,
включая Индекс Активности Болезни (DAS)
>3,2, не менее 15 припухших или болезненных
суставов, повышение сывороточной
концентрации СРБ или СОЭ.
Соседние файлы в предмете Иммунология
- #
- #
Источник

