Т лимфоциты ревматоидный артрит
Воспалительные (аутоиммунные) ревматические заболевания относятся к числу распространенных и тяжелых форм патологии человека [1]. Они могут быстро приводить к инвалидности, а нередко и к уменьшению продолжительности жизни пациентов. Неблагоприятный жизненный прогноз определяется прогрессирующим поражением внутренних органов, связанным как с тяжестью самого патологического заболевания, которое плохо контролируется противовоспалительными препаратами, так и токсическим воздействием этих препаратов.
Причины большинства воспалительных ревматических болезней пока остаются не установленными, но основные механизмы патогенеза многих из них изучены достаточно подробно. Это послужило основанием для разработки концепции «патогенетической терапии». К «патогенетическим» относят большое число разнообразных по химической структуре и фармакологическим свойствам лекарственных средств (глюкокортикоиды, цитотоксические препараты и др.), которые объединяет способность подавлять воспаление и/или патологическую активацию системы иммунитета [2]. Однако у многих больных эти препараты недостаточно эффективны.
Ревматоидный артрит (РА) – распространенное (около 1% населения планеты) аутоиммунное ревматическое заболевание, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений [3]. Характерными проявлениями РА являются боли, нарушение функции суставов и неуклонно прогрессирующая деформация суставов, необратимое поражение внутренних органов, приводящие к ранней потере трудоспособности (около трети пациентов становятся инвалидами в течение 20 лет от начала болезни) и сокращению продолжительности жизни пациентов (в среднем на 5–15 лет). Преждевременная летальность во многом связана с высокой частотой сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия, остеопоротические переломы костей скелета и др.) [4].
Современная концепция фармакотерапии РА основана на следующих основных принципах [1,5–12]:
• Целью лечения является достижение полной (или хотя бы частичной) ремиссии.
• Для достижения этой цели лечение базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), должно начинаться как можно раньше, желательно в течение первых 3–х месяцев от начала болезни.
• Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ до 20–25 мг/нед. и последующим изменением (при необходимости) схемы лечения в течение 2–4 мес. для достижения максимально возможного терапевтического эффекта.
• В случае недостаточной эффективности терапии БПВП – назначение генно–инженерных биологических препаратов (ГИБП).
Напомним, что к ГИБП относится широкий спектр препаратов, полученных с помощью методов генной инженерии: моноклональные антитела против определенных детерминант иммунокомпетентных клеток или «провоспалительных» цитокинов, «анти–воспалительные» цитокины и ингибиторы цитокинов (растворимые рецепторы, антагонисты) [13,14]. Все они обладают высокой специфичностью, обеспечивающей селективное воздействие на определенные звенья иммунопатогенеза, в минимальной степени затрагивая нормальные механизмы функционирования иммунной системы. Это позволяет существенно снизить риск «генерализованной» иммуносупрессии, которая характерна для других лекарственных препаратов (в первую очередь глюкокортикоидов и цитотоксиков). Более того, изучение клинических и иммунологических эффектов этих препаратов позволяет получить новые данные о механизмах патогенеза заболеваний человека. Наиболее изученной и широко применяемой при РА группой ГИБП являются ингибиторы ФНО–a (инфликсимаб, адалимумаб и этанерцепт), однако примерно у 40% пациентов с тяжелым активным РА они недостаточно эффективны или вызывают побочные эффекты, являющиеся основанием для прекращения лечения [15–17]. Это диктует необходимость совершенствования подходов к фармакотерапии РА.
Поскольку по современным представлениям Т–клетки имеют фундаментальное значение в развитии РА [18], одним из важных направлений в лечении этого заболевания является подавление патологической активации Т–лимфоцитов [19]. Установлено, что для оптимальной активации Т–лимфоцитов требуется, как минимум, 2 сигнала (рис. 1). Один из них реализуется в процессе взаимодействия Т–клеточных рецепторов (ТКР) с молекулами главного комплекса гистосовместимости (ГКГ), экспрессирующимся на мембране антиген–презентирующих клеток (АПК), другой – за счет взаимодействия так называемых «ко–стимулирующих» рецепторов на Т–клетках и соответствующих лигандов на АПК [20,21]. Ключевой «ко–стимуляторный» сигнал обеспечивается за счет взаимодействия CD28 на Т–лимфоцитах и СD80/СD86 на АПК. CD28 постоянно экспрессируется на наивных CD4+ и CD8+ Т клетках, а CD80 и CD86 – только после стимуляции АПК. При наличии обоих сигналов Т–лимфоциты подвергаются пролиферации и синтезируют цитокины, которые, в свою очередь, активируют другие клетки иммунной системы, и прежде всего макрофаги. В отсутствие «ко–стимуляторного» сигнала Т–лимфоциты теряют способность эффективно «отвечать» на антигенные стимулы и подвергаются апоптозу. Наиболее мощным физиологическим ингибитором взаимодействия CD28–CD80/CD86 является CTLA4 (cytotoxic T–lymphocyte–associated antigen 4) – рецептор для CD80/CD86, который экспрессируется после активации АПК и взаимодействует с этими лигандами с более высокой авидностью (примерно в 500–2500 раз выше), чем CD28. Эта молекула рассматривается, как негативный регуляторный рецептор, который ограничивает неконтролируемую активацию Т–клеток в процессе иммунного ответа.
Это послужило основанием для разработки препарата абатацепт (Abatacept, Orencia, Bristol Myers Squibb), который представляет собой растворимую гибридную белковую молекулу, состоящую из двух компонентов – внеклеточного домена CTLA4 человека и модифицированного Fc (CH2 и CH3 области) фрагмента IgG1 (рис. 2). Модификация Fc фрагмента обеспечивает низкую способность абатацепта индуцировать комплемент–зависимые и антитело–зависимые клеточные цитотоксические реакции. Как и нативный CTLA4, этот белок связывается с более высокой авидностью с CD80/86, чем с CD28, и блокирует активацию Т–клеток (рис. 3).
По данным экспериментальных исследований, абатацепт подавляет развитие коллагенового артрита (классическая лабораторная модель РА у человека) при введении препарата во время иммунизации лабораторных животных коллагеном и замедляет прогрессирование артрита при введении на фоне его развития [22].
Абатацепт разрешен к применению для лечения РА в США (декабрь 2005), Канаде (июнь 2006) и Европе (май 2007) и проходит клиническую апробацию для лечения рассеянного склероза, псориаза и системной красной волчанки.
Лечение абатацептом проводится путем внутривенной инфузии препарата в дозе 10 мг/кг (500 мг при весе пациента менее 60 кг; 750 мг при весе 60–100 кг и 1000 мг при весе более 100 кг), затем через 2 и 4 нед., ежемесячно.
Эффективность
Клинические испытания, в которых была продемонстрирована высокая эффективность и безопасность абатацепта при РА, начались еще в конце прошлого века [23–25]. В дальнейшем была проведена серия рандомизированных плацебо–контролируемых исследований (РКПИ) в рамках фазы III клинических испытаний, которые соответствовали современным стандартам исследования современных БПВП [26–36].
Целью исследования AIM (Abatacept in Inadequate responders to Methotrexate) [26] являлось изучение клинической эффективности и влияния на прогрессирование деструкции суставов комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с активным РА с неадекватным ответом на МТ. В этом исследовании установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ (рис. 4). Результаты 2–летнего наблюдения за пациентами продемонстрировали длительное сохранение эффекта комбинированной терапии: ACR20/50/70 наблюдался соответственно у 80,3, 55,6 и 34,3% пациентов, низкая активность по DAS28 – у 56,1%, а ремиссия – у 30,9% (рис. 5). Установлено: в целом комбинированная терапия оказывает более выраженное влияние, чем монотерапия на прогрессирование деструкции суставов (1,07 ед. по сравнению с 2,4 ед.), в первую очередь за счет влияния насчет эрозий, но не на сужение суставной щели. Эффект в отношении замедления деструкции суставов сохранялся в течение двух лет терапии [31]. У тех пациентов, которые в течение второго года терапии вместо плацебо получали лечение абатацептом, наблюдалось замедление прогрессирования деструкции суставов (2,4 ед. через год лечения плацебо и 3,1 через год лечения абатацептом). В группе больных, получавших абатацепт в течение 2 лет, этот показатель составил 1,07 ед. в конце первого года и только 1,5 ед. в течение второго года. Эти данные указывают на нарастание эффективности абатацепта в отношении замедления деструктивного процесса в суставах в процессе длительного лечения препаратом.
В открытой фазе исследования [25], в котором была установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ, было показано, что лечение абатацептом и МТ эффективно в течение 5 лет терапии (рис. 6) и не сопровождается нарастанием частоты побочных эффектов [36].
ATTEST (Abatacept or infliximab versus placebo, A Trial for Tolerability, Efficacy and Safety in Treating RA) – первое и пока единственное исследование, в котором сравнивалась эффективность и безопасность двух ГИБП – абатацепта и ингибитора ФНО–a инфликсимаба [29] (рис. 7). Через 6 мес. пациенты, получавшие плацебо, переключались на лечение абатацептом. Через 6 мес. все анализируемые параметры эффективности (критерии ACR и EULAR) в группе пациентов, получавших абатацепт и инфликсимаб, были достоверно лучше, чем у пациентов, получавших плацебо (рис. 8 и 9). Отмечена определенная тенденция к более высокой эффективности и длительности сохранения эффекта у абатацепта по сравнению с инфликсимабом (рис. 8). Однако следует подчеркнуть: в группе пациентов, получавших инфликсимаб, не допускалась эскалация дозы препарата (более 3 мг/кг). Это не позволяет сделать заключение о более высокой эффективности абатацепта по сравнению с инфликсимабом.
Исследование ATTAIN (Abatacept Trial in Treatment of Anti–TNF Inadequate Responders) было посвящено оценке эффективности абатацепта у пациентов с неэффективностью ингибиторов ФНО–a [27]. Через 6 мес. эффективность абатацепта (ACR20) была существенно выше (50,4%), чем в группе плацебо (19,5%). Сходные данные получены при анализе числа пациентов с низкой активностью и достигших ремиссии по критерию EULAR (p<0,001) (рис. 10). Данные 18–месячной открытой фазы этого исследования свидетельствуют о длительном сохранении эффекта (ACR20 – 56,2%).
Важные результаты получены в открытом исследовании ARRIVE (Abatacept Researched in RA patients with an Inadequete anti–TNF response to Validate Effectiveness), в которое вошло 1046 больных с активным РА, несмотря на лечение ингибиторами ФНО–a [28]. Основной целью исследования было получение данных об эффективности и безопасности абатацепта у пациентов с РА в условиях, максимально приближенных к реальной клинической практике. В исследование были включены пациенты с побочными эффектами (или плохой переносимостью) ингибиторов ФНО–a и пациенты, которым проводилось профилактическое лечение по поводу латентного туберкулеза (положительная туберкулиновая проба, но отсутствие изменений при рентгенологическом исследовании легких). Кроме того, допускались прием любых БПВП и монотерапия абатацептом и возможность прямого перехода на лечение абатацептом без периода предварительной «отмывки» после завершения лечения ингибиторами ФНО–a. Было выделено 2 группы пациентов. В первую вошли 449 пациентов, которым проводилась «отмывка» перед назначением абатацепта, и 597 пациентов, которым лечение назначалось сразу после прекращения лечения ингибиторами ФНО–a. Установлено, что схема перехода на лечение абатацептом не влияет на эффективность (рис. 11) и, что самое важное – на безопасность терапии, по крайней мере, в течение первых 6 мес. наблюдения за пациентами. Так, частота ПЭ составила в сравниваемых группах 78% vs. 79,2%, тяжелых ПЭ – 11,1 и 9,9%, а частота прерывания лечения из–за побочных эффектов 3,8% vs. 4/0%.
Как уже отмечалось, современные принципы фармакотерапии РА основаны на ранней агрессивной терапии в дебюте болезни. Особый интерес представляют данные недавно завершенного исследования [34], целью которого было изучение эффективности комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с ранним РА, впервые начавших получать МТ. При этом пациенты с РА страдали прогностически неблагоприятной формой заболевания, характеризующейся высокими титрами ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (аЦЦП), которые рассматриваются, как маркер агрессивного течения РА [37]. Установлено, что комбинированная терапия абатацептом и МТ существенно превосходит по эффективности монотерапию МТ, в том числе по частоте развития ремиссии (рис. 12). Интересно, что сходные данные получены в процессе исследования COMET, в котором сравнивалась эффективность комбинированной терапии ингибитором ФНО–a – этанерцептом по сравнению с монотерапией МТ у пациентов с ранним РА [38]. Эти данные свидетельствуют о потенциальной возможности применения не только ингибиторов ФНО–a, но и абатацепта при раннем РА.
В недавних исследованиях было показано, что назначение МТ у пациентов с недифференцированным артритом (НДА) позволяет замедлить (и в некоторых случаях предотвратить) трансформацию НДА в достоверный РА [39], причем эффективность МТ ассоциировалась с обнаружением аЦЦП в сыворотках крови пациентов. Возникает вопрос: может ли агрессивная терапия ГИБД на стадии НДА приостановить развитие РА на самой ранней стадии болезни? Это послужило основанием для проведения специального РКПИ (фаза II) [35], в которое вошли 55 аЦЦП–позитивных пациентов с НДА (
Источник
ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
- Авторы
- Резюме
- Файлы
- Ключевые слова
Пачкунова М.В.
У 80 больных ревматоидным артритом исследовано относительное и абсолютное содержание лимфоцитарных рецепторов CD3+, CD4+, CD8+, CD19+ крови, используя иммуноцитохимический субпопуляционный анализ лимфоцитов и уровень интерферона гамма сыворотки крови методом твердофазного иммунноферментного анализа. Проанализированы взаимосвязи между Т-,В-лимфоцитами и уровнем интерферона гамма крови. Определено состояние лимфоцитарных рецепторов и интерферона гамма крови в зависимости от степени активности ревматоидного артрита.
ревматоидный артрит
CD-рецепторы
интерферон гамма
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
В группе больных РА по сравнению с группой контроля определено достоверное снижение относительного содержания CD19+ (22,51±0,53 % и 24,63±1,0 % соответственно, р<0,05) без изменения их абсолютной численности (0,49±0,03*109 /л и 049±0,04*109 /л соответственно, р>0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
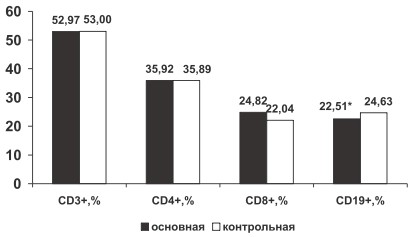
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р<0,05)
У больных РА по сравнению с группой здоровых лиц определена тенденция к росту абсолютного содержания молекулярных рецепторов лимфоцитов крови CD3+, CD4+, CD8+ (р>0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р<0,05).
Было исследовано состояние CD3+, CD4+, CD8+, CD19+ и IFNγ крови у больных РА в зависимости от активности воспалительного процесса. Относительное содержание изучаемых молекулярных рецепторов (р>0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
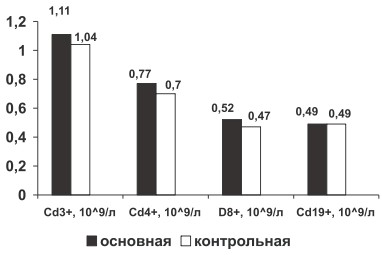
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Показатель | 1 группа здоровые n =25 | Степень активности | ||
2 группа 1 степень n =5 | 3 группа 2 степень n= 36 | 4 группа 3 степень n= 39 | ||
1 | 2 | 3 | 4 | 5 |
CD3 +,% | 53,0±0,99 | 55,4±2,58 р(2,1) >0,05 | 52,81±0,8 р(3,1) >0,05 р(3,2) >0,05 | 52,77±0,86 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD4 +,% | 35,89±1,23 | 35,2±1,93 р(2,1) >0,05 | 35,47±0,61 р(3,1) >0,05 р(3,2) >0,05 | 36,42±0,8 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD8 +,% | 23,74±0,95 | 23,6±2,58 р(2,1) >0,05 | 24,84±0,51 р(3,1) >0,05 р(3,2) >0,05 | 24,97±0,66 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD19 +,% | 24,63±1,0 | 21,8±2,17 р (2,1) >0,05 | 22,31±0,78 р (3,1) >0,05 р (3,2) >0,05 | 22,77±0,8 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
ИРИ CD4+%/ CD8+% | 1,54±0,07 | 1,55±0,19 р (2,1) >0,05 | 1,44±0,03 р (3,1) >0,05 р (3,2) >0,05 | 1,48±0,05 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD3 +,109/л | 1,04±0,09 | 1,06±0,18 р (2,1) >0,05 | 1,23±0,11 р (3,1) >0,05 р (3,2) >0,05 | 1,02±0,09 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD4 +,109/л | 0,7±0,06 | 0,66±0,1 р (2,1) >0,05 | 0,85±0,08 р (3,1) >0,05 р (3,2) >0,05 | 0,7±0,06 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD8 +, 109/л | 0,47±0,05 | 0,4±0,09 р (2,1) >0,05 | 0,57±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,49±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD19 +,109/л | 0,49±0,04 | 0,41±0,07 р (2,1) >0,05 | 0,53±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,46±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
IFNγ, пг/мл | 73,89±6,55 | 139,33±23,04 р (2,1) <0,05 | 191,58±31,03 р (3,1) <0,05 р (3,2) <0,05 | 319,53±68,46 р (4,1) <0,05 р (4,2) <0,05 р (4,3) <0,05 |
Примечания: р ‒ уровень значимости различия групп с соответствующими номерами, n ‒ количество обследованных
При 3-й степени активности РА по сравнению со 2-й степенью, несмотря на нарастание тяжести заболевания, наблюдается тенденция к снижению CD3+, CD4+, CD8+, CD19+ и нарастанию ИРИ, что, вероятно, свидетельствует о срыве компенсаторных реакций и нарастании иммунодефицита (р>0,05).
При всех степенях активности РА по сравнению с нормой определено достоверное увеличение уровня IFNγ (p <0,05, таблица), что, вероятно, связано с воздействием этого существенного показателя аутоиммунизации на развитие и прогрессирование заболевания. У больных РА по мере повышения степени активности РА выявлено закономерное увеличение содержания IFNγ крови (p<0,05, таблица). Мы считаем, что это связано с нарастанием процессов иммунного воспаления по мере усиления активности РА.
При проведении корреляционного анализа нами обнаружена прямая взаимосвязь между активностью воспаления у больных РА, с одной стороны, и IFNγ, с другой,
(r= 0,27, p<0,05). Не выявлены корреляционные взаимосвязи между активностью воспаления при РА и относительным и абсолютным содержанием изучаемых молекулярных рецепторов (р>0,05). Мы считаем, что динамика клеточных субпопуляций лимфоцитов не отражает напрямую активности иммуновоспалительного процесса.
Был проведен корреляционный анализ между показателями лимфоцитарной и цитокиновой систем при РА. Выявлены прямые корреляционные связи между относительным содержанием CD3+%, с одной стороны, и относительным содержанием CD4+% (r=0,56, p<0,0001), CD8+% (r=0,38, p<0,01), с другой, как и между CD4+%, с одной стороны, и CD8+% (r=0,31, p<0,03) и ИРИ (r=0,37, p<0,01), с другой. Определена обратная сильная корреляция между CD8+%, с одной стороны, и ИРИ (r= -0,75, p<0,001), с другой. Определена умеренная обратная корреляционная связь между ИРИ, с одной стороны, и CD19+% (r= -0,32, p<0,03), с другой, что свидетельствует об увеличении миграции В-лимфоцитов в очаг воспаления при снижении относительного содержания цитотоксических лимфоцитов в периферической крови. Выявлены высокодостоверные прямые корреляционные связи между абсолютным содержанием изучаемых молекулярных рецепторов: CD3+, с одной стороны, и CD4+, CD8+, CD19+ (r=0,9, p<0,0001), с другой, как и между CD4+ с одной стороны, и CD8+, CD19+ (r= 0,9, p<0,0001) с другой, и между CD8+, с одной стороны и CD19+ (r=0,9, p<0,0001), с другой. Таким образом, обнаруженная выраженная зависимость между лимфоцитарными рецепторами свидетельствует об имеющемся взаимном влиянии Т- и В- лимфоцитов. Т-хелперы посредством когнатной помощи и путем выработки IFNγ влияют на дифференцировку В-лимфоцитов в плазматические клетки, антителопродукцию, способствуют созреванию цитотоксических лимфоцитов, активируют макрофаги. В-лимфоциты способны презентировать антигены Т-клеткам, активировать аутореактивные CD4+, CD8+ лимфоциты, продуцировать провоспалительные цитокины. CD8+ лимфоциты осуществляют основной клеточный механизм иммунорегуляции, оказывая ингибирующее влияние на Т-хелперы как путем контактных взаимодействий, так и через выделение гуморальных факторов. Выявлена умеренная прямая корреляционная связь между абсолютным содержанием CD19+с, одной стороны, и IFNγ крови (r= 0,36, p<0,01), с другой, что объясняется усилением дифференцировки В-лимфоцитов, их превращением в плазматические клетки с последующим синтезом антител под действием IFNγ.
Выводы
Таким образом, у больных РА имеет место активация лимфоцитарной системы, сопровождающаяся миграцией В-лимфоцитов из периферической крови в очаг воспаления и нарушением функции цитотоксических лимфоцитов. При 3-й степени активности заболевания по сравнению со 2-й, определена тенденция к снижению абсолютного содержания лимфоцитарных рецепторов, вероятно, вследствие нарастания иммунодефицита. Выявлено взаимное прямое влияние между Т- и В-лимфоцитами у больных РА. Миграция В-лимфоцитов из периферической крови в очаг воспаления увеличивается при снижении относительного содержания CD8+ крови. Увеличение уровня IFNγ крови приводит к увеличению содержания в крови абсолютного содержания В-лимфоцитов.
Достоверное повышение уровня IFNγ в сыворотке крови больных РА по сравнению с контрольной группой является, вероятно, признаком дисрегуляции с избыточными иммунными реакциями и последующим нарушением функции клеток общевоспалительного назначения. Концентрация IFNγ достоверно связана с активностью воспалительного процесса. Определение уровня IFNγ может быть использовано в качестве информативного критерия для определения степени активности РА с последующей перспективой применения антител к IFNγ.
Список литературы
- Лукина Г.В. Перспективы антицитокиновой терапии ревматоидного артрита // Вестник Российской академии медицинских наук. ‒ 2003. ‒ №.7. ‒ С.23-27.
- Насонова В.А., Лукина Г.В., Сигидин Я.А. Нейтрализация ИФ-γ ‒ новое направление в терапии ревматоидного артрита // Терапевтический архив. ‒ 2008. ‒ Т. 80, №. 5. ‒ С. 30-37.
- Олюнин Ю.А., Балабанова Р.М. Комбинированная иммуномодулирующая терапия ревматоидного артрита // Терапевтический архив. ‒ 1996. ‒ Т.68, №5. ‒ С. 13-16.
- Порядин П.В., Казимирский А.Н. Иммунная система и воспаление // Сборник трудов 5-го конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». ‒ Т.1. ‒ М., 2002. ‒ С. 269-280.
- Ревматология, национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. ‒ М.: ГЭОТАР-Медиа, 2008. ‒ 714 с.
- Сучков С.В., Хитров А.М., Наумова Т.Е. и др. Современная модель патогенеза ревматоидного артрита и её место в клинической практике // Терапевтический архив. ‒ 2004. ‒ Т. 76, № 12. ‒ С. 83-87.
- Bank I., Coheu L., Monallem M. T cell subsets in patients with arthritis and chronic neutropenia // Ann Rheum Dis. ‒ 2002. ‒ Vol.61, №5. ‒ Р. 438-443.
- Dolhain R.J., ter Haar N.T., Hoefakker S. Increased expression of interferon (IFN)-gamma together with IFN-gamma receptor in the rheumatoid synovial membrane comparedwith synovium of patients with osteoarthritis // Br J Rheumatol. ‒ 1996. ‒ Vol. 35, № 1. ‒ Р. 24-32.
- Klimiuk P.A., Sierakowski S., Latosiewicz R et al. Mistological patterns of synovitis and serum chemokines in patients with rheumatoid arthritis // J Rheumatol. ‒ 2005. ‒ Vol. 32, №9. ‒ P. 1666-1672.
Рецензент:
Кратнов Андрей Евгеньевич, д.м.н., профессор, зав. кафедрой терапии педиатрического факультета Ярославской государственной медицинской академии.
Библиографическая ссылка
Пачкунова М.В. ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Фундаментальные исследования. – 2011. – № 1. – С. 148-156;
URL: https://fundamental-research.ru/ru/article/view?id=15821 (дата обращения: 31.10.2019).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


