Таргетная терапия ревматоидного артрита
 Начало 21 века прошло под знаком стремительного развития фармакологии, иммунологии и молекулярной биологии, что отразилось на принципах терапии многих аутоиммунных заболеваний. К аутоиммунным болезням относится и ревматоидный артрит, лечение которого всегда считалось одной из наиболее актуальных проблем научной медицины. Как изменились взгляды на фармакотерапию РА за последние 10 лет, какие новые препараты появились в распоряжении ревматологов? Обзору прогрессивных методов лечения РА мы посвящаем этот материал.
Начало 21 века прошло под знаком стремительного развития фармакологии, иммунологии и молекулярной биологии, что отразилось на принципах терапии многих аутоиммунных заболеваний. К аутоиммунным болезням относится и ревматоидный артрит, лечение которого всегда считалось одной из наиболее актуальных проблем научной медицины. Как изменились взгляды на фармакотерапию РА за последние 10 лет, какие новые препараты появились в распоряжении ревматологов? Обзору прогрессивных методов лечения РА мы посвящаем этот материал.
Современное лечение ревматоидного артрита: общие принципы
В этом материале мы не будем говорить о прописных истинах, а рассмотрим те препараты, на которых строится современное лечение ревматоидного артрита. Как правило, пациенты с диагнозом РА знают о своей болезни немало, а потому рассказывать о роли аутоиммунного воспаления мы не будем. Вместо этого сразу перейдем к новым методам лечения болезни, ибо обзоров инновационных лекарственных препаратов в сети, к сожалению, недостаточно. Если же вы хотите узнать больше о базовых методах фармакотерапии РА, ознакомьтесь с материалом «Ревматоидный артрит: симптомы и лечение».
Итак, генно-инженерные биологические препараты (ГИБП) для таргетной терапии – это новое слово в лечении РА. Эти препараты также часто называют средствами «антицитокиновой терапии». При серопозитивном ревматоидном артрите лечение, как правило, начинается с базисных противовоспалительных препаратов (БПВП); антицитокиновые препараты включаются в схемы терапии при тяжелой и среднетяжелой форме заболевания, а также при наличии противопоказаний для назначения метотрексата и других цитостатиков.
ГИБП целенаправленно воздействуют на молекулярные мишени, участвующие в аутоиммунном воспалении. Иными словами, современные методы лечения направлены на глубинные молекулярные механизмы иммунных реакций, которые лежат в основе патогенеза РА. Блокируя определенные звенья иммунного ответа, ГИБП останавливают лавину патологических изменений в пораженных суставах, купируют воспаление и препятствуют прогрессированию болезни. А теперь поговорим обо всем этом подробнее.
Ревматоидный артрит: лечение, препараты
Ниже мы рассмотрим основные группы биологических препаратов для лечения ревматоидного артрита и раскроем тезисы, озвученные в небольшом вступлении.
1. Блокаторы ФНО-α
Ингибиторы фактора некроза опухоли являются теми лекарственными средствами, с которых началось современное лечение ревматоидного артрита. ФНО-α – это белок из семейства цитокинов, участвующий в миграции лимфоцитов и стимулирующий синтез медиаторов воспаления. Блокируя ФНО-α, мы можем остановить каскад аутоиммунного воспаления на одной из ранних стадий – выделение медиаторов воспаления (цитокины) клетками иммунной системы.
Одним из первых препаратов таргетной терапии ревматоидного артрита был Ремикейд (МНН Инфликсимаб). Применяется инфликсимаб, как правило, в комбинации с метотрексатом (препарат из группы БПВП), назначается при тяжелых и среднетяжелых формах РА и считается препаратом 1-й линии антицитокиновой терапии. Это значит, что если лечение преднизолоном ревматоидного артрита (и/или другими БПВП) недостаточно эффективно, доктора включают в схемы терапии инфликсимаб. Если же инфликсимаб на дает желаемого результата, ревматологи могут принять решение о переводе пациента на ингибиторы ФНО-α нового поколения (пример – этанерцепт, или Энбрел).
2. Блокаторы CD20 рецепторов В-лимфоцитов
Ранее считалось, что в патогенезе РА главную роль играют цитотоксические Т-лимфоциты, однако исследования, проведенные в начале 21 века, показали, что и значение В-звена иммунитета тоже достаточно велико. В клинических испытаниях, посвященных изучению роли ингибитора CD20 (ритуксимаб, или Мабтера) в схемах химиотерапии неходжкинских лимфом, был обнаружен позитивный ответ у пациентов с лейкозом, страдающих одновременно и ревматоидным артритом. Дальнейшее изучение свойств ингибитора CD20 подтвердило огромный потенциал лекарства при РА.
Масштабные клинические испытания (REFLEX и DANCER) препарата ритуксимаб доказали, что он достоверно замедляет прогрессирование РА, позволяет достичь стойкого ответа по критериям ACR, купирует болевой синдром, улучшает функциональное состояние суставов и повышает качество жизни. Отзывы пациентов, которые уже получают лечение этим уникальным лекарством (Мабтера разрешен в РФ с 2006 года), являются лишним доказательством его высокой эффективности.
Мишенью для ритуксимаба являются В-лимфоциты: связываясь с рецепторами CD20 на их поверхности, он блокирует их действие и останавливает последующую активацию Т-лимфоцитов и синтез цитокинов, отвечающих за воспаление в суставах. Яркий пример «точечного» действия на один рецептор, следствием которого становится комплексное блокирование механизмов аутоиммунного воспаления.
У читателя может возникнуть вопрос. Если «новое в лечении» РА настолько эффективно, почему ученые продолжают искать альтернативные пути фармакологической терапии? Ответ прост – далеко не все пациенты получают адекватный результат от терапии определенными таргетными препаратами. Одним ингибиторы ФНО-α помогают, другие не получают желаемого эффекта, либо терапевтический эффект ослабевает по мере увеличения длительности курса терапии. В этом случае на помощь приходят еще более новые препараты для таргетной терапии, в том числе уже изученные нами блокаторы CD20 и ингибиторы рецепторов CD80 и CD86, о которых пойдет речь далее.
3. Блокаторы CD80 и CD86 рецепторов Т-лимфоцитов
Активация Т-лимфоцитов – важнейшее звено патогенеза РА. Происходит эта активация при участии специфических рецепторов CD80 и CD86, расположенных на поверхности Т-лимфоцитов. Заблокировав эти клеточные маркеры, мы препятствуем активации Т-лимфоцитов цитокинами и тем самым останавливаем каскад патологических изменений в суставах. На эту мишень (CD80 и CD86) нацелено действие препарата абатацепт (Орсения), еще одного инновационного средства из группы ГИБП для лечения ревматоидного артрита. Как правило, абатацепт назначается в качестве второй линии терапии, то есть при отсутствии желаемого терапевтического отклика на ФНО-α.
4. Блокатор JAK-киназ Т-лимфоцитов
Наконец, мы добрались до наиболее прогрессивной группы таргетных препаратов – блокатор JAK-киназ тофацитиниб (Яквинус). Чтобы не слишком усложнять и без того непростой для понимания материал, скажем, что JAK-киназы – это сигнальные мембранные белки, влияющие на активность клеточного звена иммунитета. Взаимодействие с этими белками различных цитокинов (интерферон-гамма, интерлейкины) приводит к активации Т-лимфоцитов, что, как вы уже понимаете, ведет к обострению аутоиммунного воспаления в суставах. Блокировка JAK-киназ, напротив, останавливает аутоиммунные реакции и улучшает состояние пациента с РА.
Перед нами поистине новое слово в лечении РА, наиболее инновационная группа лекарств. Масштабные клинические испытания (ORAL Scan) завершены только в конце 2013 года. Клинические эксперименты, в которых участвовало более 5000 пациентов с РА, доказали отличный профиль безопасности тофацитиниба и высокую эффективность при тяжелых формах ревматоидного артрита. Еще одним достоинством препарата является таблетированная форма выпуска, что делает длительное лечение тофацитинибом максимально комфортным и избавляет человека от необходимости регулярных инъекций лекарственных средств.
Итоги
На примере четырех групп антицитокиновых препаратов мы познакомились с основными направлениями современной фармакотерапии ревматоидного артрита. Читатель, который смог дочитать этот материал до конца, должен понимать две вещи. Во-первых, эти препараты назначаются при тяжелой и среднетяжелой форме РА, лечить легкую форму столь мощными (и дорогостоящими) средствами нецелесообразно.
Во-вторых, при всей эффективности эти лекарства не являются панацеей, именно поэтому ученые продолжают искать новые мишени для фармакотерапии. Терапевтический отклик на определенный ГИБП достигается примерно у 70 % пациентов с тяжелым РА, а оставшимся 30 % приходится искать другой препарат таргетной терапии. Это означает, что при лечении РА одним из ключевых факторов остается опыт лечащего ревматолога и его умение выбрать из множества возможностей оптимальный, наиболее эффективный лекарственный препарат!
Источник
 Биологическая (таргетная) терапия в ревматологии Выполнила: Проверила: АО «Медицинский Университет Астана»
Биологическая (таргетная) терапия в ревматологии Выполнила: Проверила: АО «Медицинский Университет Астана»
 «Биологические препараты» (от англ. biologics) применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное ( «точечное» ) блокирование ключевых механизмов воспаления с помощью антител или растворимых рецепторов к цитокинам, их рецепторам, а также CD, ко-молекулам и др. В связи с большим количеством «молекул-мишеней» , воздействие на которые потенциально может подавлять иммунное воспаление, разработан целый ряд лекарственных средств из этой группы и еще несколько препаратов проходят клинические испытания.
«Биологические препараты» (от англ. biologics) применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное ( «точечное» ) блокирование ключевых механизмов воспаления с помощью антител или растворимых рецепторов к цитокинам, их рецепторам, а также CD, ко-молекулам и др. В связи с большим количеством «молекул-мишеней» , воздействие на которые потенциально может подавлять иммунное воспаление, разработан целый ряд лекарственных средств из этой группы и еще несколько препаратов проходят клинические испытания.
 Имитирует механизмы основных физиологических систем организма и используетих для торможения иммунного воспалительного процессов.
Имитирует механизмы основных физиологических систем организма и используетих для торможения иммунного воспалительного процессов.
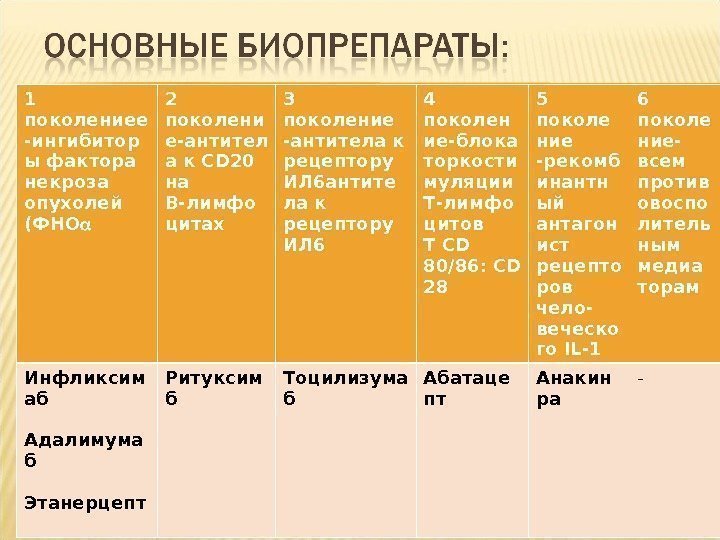 1 поколениее — ингибитор ы фактора некроза опухолей (ФНО α 2 поколени е- антител а к CD 20 на В-лимфо цитах 3 поколение — антитела к рецептору ИЛ 6 антите ла к рецептору ИЛ 6 4 поколен ие- блока торкости муляции Т-лимфо цитов ТCD 80/86: CD 28 5 поколе ние — рекомб инантн ый антагон ист рецепто ров чело- веческо го IL-1 6 поколе ние- всем против овоспо литель ным медиа торам Инфликсим аб Адалимума б Этанерцепт Ритуксим б Тоцилизума б Абатаце пт Анакин ра —
1 поколениее — ингибитор ы фактора некроза опухолей (ФНО α 2 поколени е- антител а к CD 20 на В-лимфо цитах 3 поколение — антитела к рецептору ИЛ 6 антите ла к рецептору ИЛ 6 4 поколен ие- блока торкости муляции Т-лимфо цитов ТCD 80/86: CD 28 5 поколе ние — рекомб инантн ый антагон ист рецепто ров чело- веческо го IL-1 6 поколе ние- всем против овоспо литель ным медиа торам Инфликсим аб Адалимума б Этанерцепт Ритуксим б Тоцилизума б Абатаце пт Анакин ра —
 Для биологических препаратов характерны быстрый и выраженный клинический эффект и достоверно доказанное торможение деструкции суставов. Характерной чертой биологических агентов является потенцирование эффекта в сочетании с базисными противовоспалительными препаратами, в первую очередь с метотрексатом. В вязи с высокой эффектив ностью при ревматоидном артрите, в том числе у пациентов, резистентных к обычной терапии, биологическая терапия в настоящее время выдвинулась по значимости на первое место в лечении этого заболевания.
Для биологических препаратов характерны быстрый и выраженный клинический эффект и достоверно доказанное торможение деструкции суставов. Характерной чертой биологических агентов является потенцирование эффекта в сочетании с базисными противовоспалительными препаратами, в первую очередь с метотрексатом. В вязи с высокой эффектив ностью при ревматоидном артрите, в том числе у пациентов, резистентных к обычной терапии, биологическая терапия в настоящее время выдвинулась по значимости на первое место в лечении этого заболевания.
 Первыми биологическими агентами, которые стали широко применяться в клинической практике, были ингибиторы ФНОα. Они блокируют биологическую активность этого цитокина в циркуляции и на клеточном уровне. К ним относятся химерные (инфликсимаб) и человеческие (адалимумаб) моноклональные антитела к ФНОα, а также растворимые рецепторы к ФНОα – этанерцепт. На сегодняшний день они рассматриваются как одни из самых эффективных лекарственных препаратов для лечения ЮА. Фактор некроза опухоли альфа является одной из центральных фигур в развитии событий при ревматоидном и ювенильном артрите. С одной стороны, он играет важную роль в регуляции дифференцировки, роста и метаболизма различных клеток, а с другой – выступает в роли медиатора воспаления при многих заболеваниях человека. Локальные эффекты ФНОα обеспечивают формирование очага местного воспаления, активацию эндотелиальных клеток, повышение тромбообразования в сосудах микроциркуляции. Локальный отек способствует дренажу патогена в регионарные лимфатические узлы, где в норме есть все условия для развития лимфоцитарного иммунного ответа.
Первыми биологическими агентами, которые стали широко применяться в клинической практике, были ингибиторы ФНОα. Они блокируют биологическую активность этого цитокина в циркуляции и на клеточном уровне. К ним относятся химерные (инфликсимаб) и человеческие (адалимумаб) моноклональные антитела к ФНОα, а также растворимые рецепторы к ФНОα – этанерцепт. На сегодняшний день они рассматриваются как одни из самых эффективных лекарственных препаратов для лечения ЮА. Фактор некроза опухоли альфа является одной из центральных фигур в развитии событий при ревматоидном и ювенильном артрите. С одной стороны, он играет важную роль в регуляции дифференцировки, роста и метаболизма различных клеток, а с другой – выступает в роли медиатора воспаления при многих заболеваниях человека. Локальные эффекты ФНОα обеспечивают формирование очага местного воспаления, активацию эндотелиальных клеток, повышение тромбообразования в сосудах микроциркуляции. Локальный отек способствует дренажу патогена в регионарные лимфатические узлы, где в норме есть все условия для развития лимфоцитарного иммунного ответа.
 • В последние годы отмечен большой прогресс в методах лечения ревматоидного артрита. Самым значительным достижением стало создание группы препаратов, называемых препаратами, модифицирующими биологическую реакцию, или биологическими агентами.
• В последние годы отмечен большой прогресс в методах лечения ревматоидного артрита. Самым значительным достижением стало создание группы препаратов, называемых препаратами, модифицирующими биологическую реакцию, или биологическими агентами.
 Существует ряд стандартных биологических агентов, предназначенных для лечения ревматоидного артрита: • Енбрел • Хумира • Ремикейд • Оренсия • Остальные биологические агенты подвергаются клиническим испытаниям относительно их воздействия на различные формы артрита.
Существует ряд стандартных биологических агентов, предназначенных для лечения ревматоидного артрита: • Енбрел • Хумира • Ремикейд • Оренсия • Остальные биологические агенты подвергаются клиническим испытаниям относительно их воздействия на различные формы артрита.
 Каким образом биологические агенты воздействуют на симптомы ревматоидного артрита? • Биологические агенты – это протеины, разработанные методом генной инженерии с использованием человеческого гена. Они направлены на модификацию функции особых ферментов иммунной системы, играющих основную роль в активизации или подавлении воспалительного процесса (главной составляющей ряда артритных заболеваний, таких как ревматоидный артрит и псориатический артрит). • Каким образом биологические агенты, существенно отличающиеся от остальных препаратов, также использующихся для лечения ревматоидного артрита, модифицируют иммунную систему? Они воздействуют исключительно на особые компоненты иммунной системы. Таким образом, теоретически эти препараты обладают меньшим спектром побочных эффектов.
Каким образом биологические агенты воздействуют на симптомы ревматоидного артрита? • Биологические агенты – это протеины, разработанные методом генной инженерии с использованием человеческого гена. Они направлены на модификацию функции особых ферментов иммунной системы, играющих основную роль в активизации или подавлении воспалительного процесса (главной составляющей ряда артритных заболеваний, таких как ревматоидный артрит и псориатический артрит). • Каким образом биологические агенты, существенно отличающиеся от остальных препаратов, также использующихся для лечения ревматоидного артрита, модифицируют иммунную систему? Они воздействуют исключительно на особые компоненты иммунной системы. Таким образом, теоретически эти препараты обладают меньшим спектром побочных эффектов.
 Побочные эффекты биологических агентов • Так же как и другие препараты, подавляющие функцию иммунной системы, биологические агенты обладают некоторой степенью риска, поскольку организм в период их применения более уязвим и подвержен инфекционным заболеваниям. На постоянно повышенную температуру следует немедленно отреагировать соответствующим медикаментозным лечением. • Биологические агенты также могут вызвать обострение хронических заболеваний, пребывающих в ремиссии, таких как туберкулез, поэтому эти препараты не рекомендуемы при рассеянном склерозе, хронической сердечной недостаточности и других заболеваниях. Прежде чем приступить к лечению биологическими агентами, больные также должны предварительно пройти тест на туберкулез кожи.
Побочные эффекты биологических агентов • Так же как и другие препараты, подавляющие функцию иммунной системы, биологические агенты обладают некоторой степенью риска, поскольку организм в период их применения более уязвим и подвержен инфекционным заболеваниям. На постоянно повышенную температуру следует немедленно отреагировать соответствующим медикаментозным лечением. • Биологические агенты также могут вызвать обострение хронических заболеваний, пребывающих в ремиссии, таких как туберкулез, поэтому эти препараты не рекомендуемы при рассеянном склерозе, хронической сердечной недостаточности и других заболеваниях. Прежде чем приступить к лечению биологическими агентами, больные также должны предварительно пройти тест на туберкулез кожи.
 • Согласно данным настоящих исследований, они довольно эффективны и обладают меньшим риском возникновения побочных эффектов по сравнению с остальными видами медикаментозного лечения. • Одним из недостатков терапии с использованием биологических агентов является необходимость их применения в виде инъекций или методом внутривенного вливания. Один сеанс занимает от 30 минут до нескольких часов. Тем не менее, эти препараты обеспечивают существенное улучшение состояния.
• Согласно данным настоящих исследований, они довольно эффективны и обладают меньшим риском возникновения побочных эффектов по сравнению с остальными видами медикаментозного лечения. • Одним из недостатков терапии с использованием биологических агентов является необходимость их применения в виде инъекций или методом внутривенного вливания. Один сеанс занимает от 30 минут до нескольких часов. Тем не менее, эти препараты обеспечивают существенное улучшение состояния.
 • Клинические испытания с участием животных не показали негативного влияния на рождаемость или развитие плода, однако эти данные не могут гарантировать отсутствие осложнений у людей. Соответственно, женщины во время беременности должны принимать эти препараты только в случае очевидной необходимости. • Как правило, не следует использовать два биологических агента одновременно. • По словам исследователей, на стадии разработки находятся пероральные биологические агенты, которые будут намного дешевле.
• Клинические испытания с участием животных не показали негативного влияния на рождаемость или развитие плода, однако эти данные не могут гарантировать отсутствие осложнений у людей. Соответственно, женщины во время беременности должны принимать эти препараты только в случае очевидной необходимости. • Как правило, не следует использовать два биологических агента одновременно. • По словам исследователей, на стадии разработки находятся пероральные биологические агенты, которые будут намного дешевле.
 Енбрел • уменьшает воспаление в суставах, подавляя выработку фермента, называемого фактором некроза опухолей (ФНО). • применяется в виде подкожной инъекции раз или дважды в неделю. • может вызывать раздражение в области инъекции, которое можно ограничить, приложив холодный компресс перед выполнением инъекции. • Действие Енбрела может подавлять функционирование иммунной системы. В случае инфекционного заболевания следует прекратить прием препарата и возобновить по наставлению врача. • противопоказан в период беременности, поскольку его влияние на плод не известно.
Енбрел • уменьшает воспаление в суставах, подавляя выработку фермента, называемого фактором некроза опухолей (ФНО). • применяется в виде подкожной инъекции раз или дважды в неделю. • может вызывать раздражение в области инъекции, которое можно ограничить, приложив холодный компресс перед выполнением инъекции. • Действие Енбрела может подавлять функционирование иммунной системы. В случае инфекционного заболевания следует прекратить прием препарата и возобновить по наставлению врача. • противопоказан в период беременности, поскольку его влияние на плод не известно.
 Хумира • препятствует развитию фактора некроза опухолей. Препарат применяется самостоятельно в виде инъекции. Инъекция выполняется каждые две недели. • Случаи острых аллергических реакций и нарушения соотношения количества кровяных клеток встречаются редко. Образование гематом и кровотечения могут свидетельствовать о нарушениях функции клеток крови, о чем следует немедленно сообщить врачу. • В ходе клинических испытаний наблюдался повышенный риск инфекций вследствие применения комбинации Хумиры и другого противоревматического препарата – Кинерета.
Хумира • препятствует развитию фактора некроза опухолей. Препарат применяется самостоятельно в виде инъекции. Инъекция выполняется каждые две недели. • Случаи острых аллергических реакций и нарушения соотношения количества кровяных клеток встречаются редко. Образование гематом и кровотечения могут свидетельствовать о нарушениях функции клеток крови, о чем следует немедленно сообщить врачу. • В ходе клинических испытаний наблюдался повышенный риск инфекций вследствие применения комбинации Хумиры и другого противоревматического препарата – Кинерета.
 Кинерет • Кинерет уменьшает суставное воспаление, подавляя функцию фермента – интерлейкина-1. Препарат применяется ежедневно в виде инъекции (инъекции выполняются самостоятельно или же другими людьми). Кинерет не является часто применяемым препаратом из-за недостаточно высокой эффективности.
Кинерет • Кинерет уменьшает суставное воспаление, подавляя функцию фермента – интерлейкина-1. Препарат применяется ежедневно в виде инъекции (инъекции выполняются самостоятельно или же другими людьми). Кинерет не является часто применяемым препаратом из-за недостаточно высокой эффективности.
 Ремикад • уменьшает суставное воспаление, подавляя развитие фактора некроза опухолей. Ремикад вводиться методом внутривенного вливания. Процедура выполняется в условиях стационара. Каждое вливание занимает около двух часов. Курс внутривенного вливания состоит из трех процедур в течение первых шести, затем девяти недель. Ремикад применяется в комбинации с Метотрексатом, использующемся при лечении РА. • С применением Ремикада может ослабить сопротивляемость организма инфекционным заболеваниям. При наличии таких симптомов, как высокая температура свыше 38º С, потливость или озноб, кожная сыпь и других признаков, вызывающих беспокойство, следует немедленно обратиться к врачу.
Ремикад • уменьшает суставное воспаление, подавляя развитие фактора некроза опухолей. Ремикад вводиться методом внутривенного вливания. Процедура выполняется в условиях стационара. Каждое вливание занимает около двух часов. Курс внутривенного вливания состоит из трех процедур в течение первых шести, затем девяти недель. Ремикад применяется в комбинации с Метотрексатом, использующемся при лечении РА. • С применением Ремикада может ослабить сопротивляемость организма инфекционным заболеваниям. При наличии таких симптомов, как высокая температура свыше 38º С, потливость или озноб, кожная сыпь и других признаков, вызывающих беспокойство, следует немедленно обратиться к врачу.
 Ритуксан • назначается больным со средней и тяжелой формой РА, которые не отреагировали на лечение препаратов, подавляющих фактор некроза опухолей, таких как Енбрел и Ремикад. Ритуксан вводится внутривенно в два захода с двухнедельным интервалом в комбинации с Метотрексатом, который вводится еженедельно. • Наиболее типичными побочными эффектами вследствие применения Ритуксана являются снижение сопротивляемости инфекционным заболеваниям и реакции организма, называемые реакциями на внутривенное вливание. Среди симптомов реакций на внутривенное вливание – гриппозные заболевания, высокая температура, озноб, тошнота и головные боли.
Ритуксан • назначается больным со средней и тяжелой формой РА, которые не отреагировали на лечение препаратов, подавляющих фактор некроза опухолей, таких как Енбрел и Ремикад. Ритуксан вводится внутривенно в два захода с двухнедельным интервалом в комбинации с Метотрексатом, который вводится еженедельно. • Наиболее типичными побочными эффектами вследствие применения Ритуксана являются снижение сопротивляемости инфекционным заболеваниям и реакции организма, называемые реакциями на внутривенное вливание. Среди симптомов реакций на внутривенное вливание – гриппозные заболевания, высокая температура, озноб, тошнота и головные боли.
 Оренция • используется для лечения умеренной и тяжелой формы ревматоидного артрита. Оренция подавляет сигналы, активизирующие функцию Т-лимфоцитов – компонентов иммунной системы. Т-лимфоциты в действии являются пусковым механизмом развития ревматоидного артрита. • Клинические испытания показывают способность Оренции смягчать симптомы РА в случае неэффективности Метотрексата и других биологических агентов. Препарат предназначен для изолированного применения, а также в комбинации с другими лекарственными препаратами за исключением биологических агентов. • Оренция применяется методом внутривенного вливания. Побочные реакции проявляются в виде повышенного риска инфекционных заболеваний и серьезных аллергических реакций. Больных не следует подвергать вакцинации в период применения Оренции в течение трех месяцев после прекращения приема препарата. Следует соблюдать осторожность при назначении Оренции больным хроническим обструктивным заболеванием лёгких (ХОЗЛ).
Оренция • используется для лечения умеренной и тяжелой формы ревматоидного артрита. Оренция подавляет сигналы, активизирующие функцию Т-лимфоцитов – компонентов иммунной системы. Т-лимфоциты в действии являются пусковым механизмом развития ревматоидного артрита. • Клинические испытания показывают способность Оренции смягчать симптомы РА в случае неэффективности Метотрексата и других биологических агентов. Препарат предназначен для изолированного применения, а также в комбинации с другими лекарственными препаратами за исключением биологических агентов. • Оренция применяется методом внутривенного вливания. Побочные реакции проявляются в виде повышенного риска инфекционных заболеваний и серьезных аллергических реакций. Больных не следует подвергать вакцинации в период применения Оренции в течение трех месяцев после прекращения приема препарата. Следует соблюдать осторожность при назначении Оренции больным хроническим обструктивным заболеванием лёгких (ХОЗЛ).
 • Биологическая терапия в ревматологии. / Я. А. Сигидин, Г. В. Лукина. –М. : Медицина, 2007. — 179 с. • Насонова В. А. , Насонов Е. Л. , Алекперов Р. Т. Рациональная фармакотерапия ревматических заболеваний. — Изд-во «Литтерра» , 2007. – 448 с. • Ревматология: национальное руководство / Под ред. Е. Л. Насонова, В. А. Насоновой. – М. : ГЭОТАР – Медиа, 2008. – 720 с. • Ревматология: Клинические рекомендации / Под ред. акад. РАМН Е. Л. Насонова. – 2 -е изд. , испр. и доп. – М. : ГЭОТАР-Медиа, 2010. – 752 • Биологическая терапия в ревматологии. / Я. А. Сигидин, Г. В. Лукина. –М. : Медицина, 2007. — 179 с.
• Биологическая терапия в ревматологии. / Я. А. Сигидин, Г. В. Лукина. –М. : Медицина, 2007. — 179 с. • Насонова В. А. , Насонов Е. Л. , Алекперов Р. Т. Рациональная фармакотерапия ревматических заболеваний. — Изд-во «Литтерра» , 2007. – 448 с. • Ревматология: национальное руководство / Под ред. Е. Л. Насонова, В. А. Насоновой. – М. : ГЭОТАР – Медиа, 2008. – 720 с. • Ревматология: Клинические рекомендации / Под ред. акад. РАМН Е. Л. Насонова. – 2 -е изд. , испр. и доп. – М. : ГЭОТАР-Медиа, 2010. – 752 • Биологическая терапия в ревматологии. / Я. А. Сигидин, Г. В. Лукина. –М. : Медицина, 2007. — 179 с.
Источник