Узи сердца при ревматоидном артрите
Поражение сердца при ревматоидном артрите в последние годы привлекает к себе внимание исследователей. Долгое время считалось, что отсутствие поражения сердца при инфектартрите является дифференциально-диагностическим признаком по отношению к ревматизму.
Engleman (1955) обнаружил значительное поражение сердца (очаговый миокардит, перикардит, изменения клапанов и коронариит, наличие ревматоидных узелков в миокарде и сосудах) в 38 из 43 аутопсий. Vignon, Perkin, Duran (1962) из 12 случаев аутопсий в шести нашли поражение клапанов сердца, аорты, коронарных сосудов и перикарда. Cruickshank при аутопсиях 100 больных инфектартритом обнаружил васкулит сосудов сердца в 20 случаях. В обстоятельной работе Cathcart и Spodik исследование 15 секционных случаев инфектартрита показало наличие утолщений митрального и аортального клапанов с субэндокардиально расположенными ревматоидными узелками, наличие подострого и слипчивого перикардита с лимфоцитарной инфильтрацией и узелками в миокарде в 7 случаях. У остальных 8 умерших были найдены более или менее выраженные явления атерокардиосклероза.
По данным различных авторов, органическое изменение клапанов сердца при инфектартрите встречается в 15-35% всех секционных случаев. В связи с этим некоторые авторы считают, что при инфектартрите имеет место прежде всего поражение эндокарда – вальвулит, главным образом аортальных клапанов (Ravault и Vignon). Другие указывают на преимущественное поражение миокарда, чаще всего типа очагового миокардита.
Во многих случаях инфектартрита при аутопсиях обнаруживается поражение аорты с образованием аортального порока. При этом, согласно данным Clark, Kulka, Bauer (1957), происходят следующие изменения: очаговое разрушение эластической ткани в аортальном кольце и его расширение, рубцовое стягивание створок аортальных клапанов и их краевая кальцинация и изредка сужение устий коронарных артерий. По данным этих авторов, картина ревматоидного аортита имеет место в 2% всех случаев инфектартрита, главным образом у мужчин, страдающих спондилитом.
Однако следует подчеркнуть, что столь частое поражение сердца при ревматоидном артрите обнаруживается только на аутопсиях, клинически же оно диагностируется значительно реже, в среднем, по обобщенным данным различных авторов, у 5% больных инфектартритом.
Еще в 1956 г. А. И. Нестеров и М. Г. Астапенко отмечали, что у большинства больных инфектартритом клинически можно констатировать явления миокардиодистрофии, а в некоторых случаях признаки медленно развивающегося порока – недостаточности митрального клапана. Эти данные, были впоследствии подтверждены в работе И. Е. Сперанской (1959), которая, обследовав 326 больных, диагностировала миокардиодистрофию у 50%, недостаточность митрального клапана – у 40 больных и сочетанный митральный порок у восьми; при этом все больные были моложе 50 лет и лишь трое из них ранее перенесли ревматизм.
По данным Kottgen и Calleusse у 1/3 детей, страдающих ревматоидным артритом, клинически можно обнаружить поражение сердца.
В исследованиях Berger и Schenck (1961) у 45% детей были отмечены патологические изменения на электро- и фонокардиограмме. При этом у 56% детей были обнаружены и мезодиастолические шумы. У части детей было отмечено уменьшение систолического и минутного объема сердца и удлинение времени напряжения. Все эти данные, по мнению авторов, свидетельствуют о поражении миокарда и указывают на то, что поражение сердца при ревматоидном артрите у детей встречается значительно чаще, чем это предполагают.
М. Г. Астапенко, В. М. Чепой, В. А. Шанина и Г. П. Котельникова, исследовав 100 больных достоверным инфектартритом в возрасте от 10 до 46 лет, предъявляющих кардиальные жалобы, обнаружили у 14 из них симптомы текущего воспалительного процесса в сердце (миокардит и перикардит). Однако в последующие 3 года у этих больных сформировался порок сердца (недостаточность митрального клапана), что свидетельствует также и о поражении эндокарда у этих больных.
Портативный аппарат для неотложной помощи, интенсивной терапии и спортивной медицины.
Исследования опорно-двигательного аппарата, мониторинг проведения анестезии и др.
Ювенильный ревматоидный артрит (ЮРА) — одно из наиболее частых и инвалидизирующих ревматических заболеваний у детей [1, 2]. Заболеваемость ювенильным ревматоидным артритом составляет 2-16 случаев на 100 000 детского населения в возрасте до 16 лет. Распространенность ювенильного ревматоидного артрита в разных странах составляет 0,05-0,6%. Распространенность ювенильного ревматоидного артрита у детей до 18 лет на территории Российской Федерации — 62,3 на 100 000, первичная заболеваемость — 16,2 на 100 000. У подростков распространенность ювенильного ревматоидного артрита составляет 116,4 на 100 000 (у детей до 14 лет — 45,8 на 100 000), первичная заболеваемость — 28,3 на 100 000 (у детей до 14 лет — 12,6 на 100 000). Чаще ревматоидным артритом болеют девочки. Смертность составляет 0,5-1%.
Ювенильного ревматоидный артрит — хроническое воспалительное заболевание суставов неизвестной этиологии и сложного патогенеза [3, 4]. Оно характеризуется неуклонно прогрессирующим течением, что приводит к инвалидизации. Среди множества проявлений ювенильного ревматоидного артрита одним из ведущих является суставной синдром, характеризующийся припухлостью, повышением местной кожной температуры над суставом, скованностью и болью в суставе. Патогенез связан с аутоиммунными нарушениями в первую очередь с ревматоидными факторами (антителами к иммуноглобулинам) и иммунокомплексными процессами, которые приводят к развитию синовита, а в ряде случаев и генерализованного васкулита. Деформацию суставов при ревматоидном артрите связывают с образованием и разрастанием в синовиальной оболочке грануляционной ткани, которая постепенно разрушает хрящ и субхондральные отделы костей с возникновением узур (эрозий), развитием склеротических изменений, фиброзного, а затем и костного анкилоза. Характерные подвывихи и контрактуры обусловлены отчасти и изменениями сухожилий, серозных сумок и капсулы сустава (рис.1). Как известно, лучевые методы диагностики представлены рентгенографическим исследованием, магнитно-резонансной томографией (МРТ), компьютерной томографией (КТ) и ультразвуковым исследованием (УЗИ). Рентгенография в большинстве случаев позволяет определить поражение суставов при вовлечении в патологический процесс только костных элементов, и зачастую эти изменения уже необратимы и трудны для лечения. Но, обладая рядом несомненных достоинств, традиционная рентгенография уже не может полностью удовлетворять потребности современной медицины в ранней диагностике заболеваний суставов в первую очередь в оценке воспалительных и дегенеративно-дистрофических изменений сухожильно- связочного аппарата и окружающих мягких тканей. Без всякого сомнения, МРТ является одним из самых эффективных методов исследования мягких тканей, костей и суставов, особенно их внутренних структур. Но высокая стоимость МРТ, трудность ее проведения у детей младшего возраста (в большинстве случаев детям до 3-х лет МР-исследования проводятся под наркозом) и относительно малое число МР-томографов не позволяют считать это обследование методом выбора при диагностике ревматоидного артрита. УЗИ позволяет оценить мягкие ткани сустава, хрящевую ткань и кортикальный слой костной ткани, а также связки, сухожилия, соединительнотканные элементы, жировую клетчатку, сосудисто-нервные пучки. Легкодоступность, быстрота и экономичность исследования позволяют данный метод использовать в диагностике ювенильного ревматоидного артрита на начальном этапе обследования пациента [5].
Рис. 1. Схематическое изображение сустава при ювенильном ревматоидном артрите.
Среди поражений суставов в 80% случаев коленный сустав поражается в первую очередь, в 40% — голеностопный сустав, в 20 % — плечевой сустав. На примере коленного сустава, как наиболее часто вовлекающегося в патологический процесс, мы выявили УЗ критерии поражения костной и хрящевой ткани, а также сухожильно-связочного аппарата.
Нами обследовано 25 детей с суставным синдромом в возрасте от 1 года до 16 лет, из них 20 девочек и 5 мальчиков. Всем пациентам проводили рентгенографическое исследование, МРТ и УЗИ суставов. Диагноз был поставлен по клиническим и лабораторным данным.
Ультразвуковое исследование коленных суставов проводилось по разработанной ранее методике, при этом оценивали структуру гиалинового хряща, наличие свободной жидкости в полости сустава, состояние кортикального слоя мыщелков большеберцовой и бедренной костей, а также сосудистую реакцию мягких тканей сустава с помощью методики УЗ-ангиографии.
В ходе проведенных исследований было установлено, что у 30% (8 детей исследуемой группы) рентгенографические исследования коленного сустава (КС) изменения не показали. Однако эхографическая картина того же сустава показала начальные изменения в виде умеренного неравномерного истончения гиалинового хряща и незначительного количества жидкости в области сустава. Кортикальный слой был представлен в виде неровных и размытых контуров, отмечалось утолщение кортикального слоя надколенника, что позволило сделать предположение о начальных проявлениях артрита, которые были позже подтверждены лабораторными исследованиями (рис. 2).
Друзья, ну оооочень много вопросов поступает о различных методах диагностики ревматических болезней. И правда, что выбрать из такого многообразия. УЗИ, рентген, МРТ, КТ… Постараюсь побольше уделять времени методам диагностики. А сегодня про УЗИ. Метод относительно (!) новый в практической ревматологии и вызывающий массу вопросов и споров относительно его целесообразности и ситуациях применения на практике.
Существуют рекомендации и алгоритмы практического применения ультразвука для диагностики и контроля за эффективностью терапии ревматоидного артрита (РА). Вот сегодня о них и поговорим, хочется чтобы вы сами разобрались в этом вопросе.
До 2016-2017 гг Европейская антиревматическая Лига (EULAR) хоть и поддерживала использование ультразвука, но не давала конкретных указаний относительно того, как и, главное, когда использовать ультразвук.
Экспертная комиссия EULAR предлагает 3 возможных области применения ультразвука.
- Уточнить, присутствует ли синовит у пациентов без клинических признаков воспаления.
- Контроль пациентов, которые вроде бы соответствуют критериям EULAR, но смущают врача.
- Контроль пациентов, которые не соответствуют критериям диагноза, но являются подозрительными в отношении РА.
А теперь комментарии…
Пациент А. имеет симптомы РА и/или положительные РФ/АЦЦП.
Шаг 1: определяем имеет ли он синовит (воспаление синовиальной оболочки и выпот в сустав) клинически (то есть определяемый при осмотре). Если ДА, выясняем соответствует ли он критериям диагноза РА. Если ДА, тогда выставляется диагноз РА, рекомендуется терапия.
❌Если НЕТ, то есть пациент НЕ соответствует критериям диагноза или мы клинически не видим у него синовита, тогда переходим к шагу 2.
✅Это УЗИ. Если на УЗИ выявлен синовит, то тогда все равно стоит рассмотреть вопрос о терапии с учётом факторов риска.
❌Если НЕТ — стоит искать другую болезнь.
Пациент Б, удовлетворяет критериям постановки диагноза РА.
Что же мы можем обнаружить на УЗИ и какой сделать вывод?
Ситуация 1: синовит обнаружен во многих суставах. Мы делаем вывод о наличии подтверждённого УЗИ РА.
❌Ситуация 2: синовит НЕ выявлен вообще. Исследование стоит повторить через 2-4 недели.
✅Ситуация 3: синовит выявлен, но незначительный и в единичных суставах. Эта находка диагноз РА не снимает, но тактику ведения стоит пересмотреть с учётом факторов риска.
Кроме того, эксперты делают вывод о том, что пациенты с РА, получающие стандартные базисные или биологические препараты должны пройти УЗИ на старте терапии и через 3-6 месяцев лечения для оценки ответа на лечение.
Источник
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
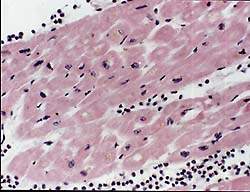 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
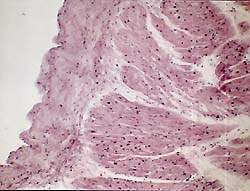 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник