Американская коллегия ревматологов ревматоидный артрит
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
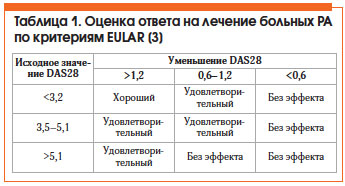
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

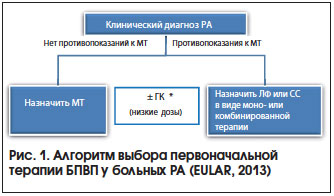
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
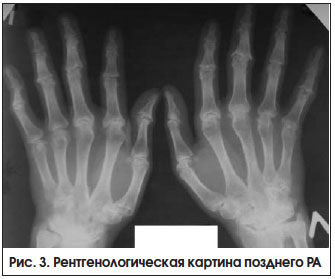
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
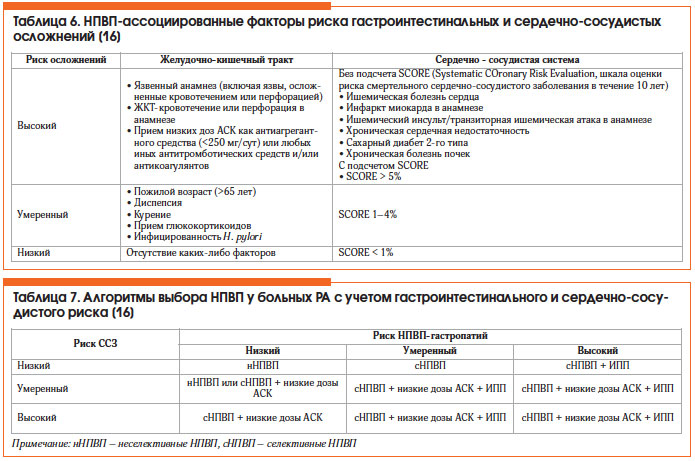
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
1. Goodman SM, Springer B, Guyatt G, et al. 2017 American College of Rheumatology/American Association of Hip and Knee Surgeons Guideline for the Perioperative Management of Antirheumatic Medication in Patients With Rheumatic Diseases Undergoing Elective Total Hip or Total Knee Arthroplasty. Arthritis Rheum. 2017;69(8):1538-51. doi: 10.1002/art.40149
2. Strand V, Singh JA. Improved health-related quality of life with effective disease-modifying antirheumatic drugs: evidencefrom randomized controlled trials. Am J Manag Care. 2008;14:234-54.
3. Ravi B, Croxford R, Reichmann WM, et al. The changing demographics of total joint arthroplasty recipients in the United States and Ontario from 2001 to 2007. Best Pract Res Clin Rheumatol. 2012;26:637-47. doi: 10.1016/j.berh.2012.07.014
4. Mertelsmann-Voss C, Lyman S, Pan TJ, et al. Arthroplasty rates are increased among US patients with systemic lupus erythematosus: 1991-2005. J Rheumatol. 2014;41:867-74. doi: 10.3899/jrheum.130617
5. Mertelsmann-Voss C, Lyman S, Pan TJ, et al. US trends in rates of arthroplasty for inflammatory arthritis including rheumatoid arthritis, juvenile idiopathic arthritis, and spondyloarthritis. Arthritis Rheum. 2014;66:1432-9. doi: 10.1002/art.38384
6. Nikiphorou E, Carpenter L, Morris S, et al. Hand and foot surgery rates in rheumatoid arthritis have declined from 1986 to 2011, but large-joint replacement rates remain unchanged: results from two UK inception cohorts. Arthritis Rheum. 2014;66:1081-9. doi: 10.1002/art.38344
7. Sokka T, Kautiainen H, Hannonen P. Stable occurrence of knee and hip total joint replacement in Central Finland between 1986 and 2003: an indication of improved longterm outcomes of rheumatoid arthritis. Ann Rheum Dis. 2007;66:341-4. doi: 10.1136/ard.2006.057067
8. Ravi B, Croxford R, Hollands S, et al. Increased risk of complications following total joint arthroplasty in patients with rheumatoid arthritis. Arthritis Rheum. 2014;66:254-63. doi: 10.1002/art.38231
9. Lin JA, Liao CC, Lee YJ, et al. Adverse outcomes after major surgery in patients with systemic lupus erythematosus: a nationwide population-based study. Ann Rheum Dis. 2014;73:1646-51. doi: 10.1136/annrheumdis-2012-202758
10. Singh JA, Inacio MC, Namba RS, Paxton EW. Rheumatoid arthritis is associated with higher ninety-day hospital readmission rates compared to osteoarthritis after hip or knee arthroplasty: a cohort study. Arthritis Care Res (Hoboken). 2015;67:718-24. doi: 10.1002/acr.22497
11. Roberts JE, Mandl LA, Su EP, et al. Patients with systemic lupus erythematosus have increased risk of short-term adverse events after total hip arthroplasty. J Rheumatol. 2016;43:1498-502. doi: 10.3899/jrheum.151373
12. Насонов ЕЛ, Мазуров ВИ, Каратеев ДЕ и др. Проект рекомендаций по лечению ревматоидного артрита Общероссийской общественной организации «Ассоциация ревматологов России» – 2014 (часть 1). Научно-практическая ревматология. 2014;52(5):477-95 [Nasonov EL, Mazurov VI, Karateev DE, et al. Spondyloarthritis: Evolution of a concept. Project: recommendations on treatment of rheumatoid arthritis developed by All-Russian Public organization «Association of Rheumatologists of Russia» – 2014 (part 1). Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(5):477-94 (In Russ.)]. doi: 10.14412/1995-4484-2014-477-494
13. Goodman SM, Ramsden-Stein DN, Huang WT, et al. Patients with rheumatoid arthritis are more likely to have pain and poor function after total hip replacements than patients with osteoarthritis. J Rheumatol. 2014;41:1774-80. doi: 10.3899/jrheum.140011
14. Goodman SM, Johnson B, Zhang M, et al. Patients with rheumatoid arthritis have similar excellent outcomes after total knee replacement compared with patients with osteoarthritis. J Rheumatol. 2016;43:46-53. doi: 10.3899/jrheum.150525
15. LoVerde ZJ, Mandl LA, Johnson BK, et al. Rheumatoid arthritis does not increase risk of short-term adverse events after total knee arthroplasty: a retrospective case-control study. J Rheumatol. 2015;42:1123-30. doi: 10.3899/jrheum.141251
16. Johnson BK, Goodman SM, Alexiades MM, et al. Patterns and associated risk of perioperative use of anti-tumor necrosis factor in patients with rheumatoid arthritis undergoing total knee replacement. J Rheumatol. 2013;40:617-23. doi: 10.3899/jrheum.121171
17. Berbari EF, Osmon DR, Lahr B, et al. The Mayo prosthetic joint infection risk score: implication for surgical site infection reporting and risk stratification. Infect Control Hosp Epidemiol. 2012;33:774-81. doi: 10.1086/666641
18. Bongartz T, Halligan CS, Osmon DR, et al. Incidence and risk factors of prosthetic joint infection after total hip or knee replacement in patients with rheumatoid arthritis. Arthritis Rheum. 2008;59:1713-20. doi: 10.1002/art.24060
19. Goodman SM, Menon I, Christos PJ, et al. Management of perioperative tumour necrosis factor a inhibitors in rheumatoid arthritis patients undergoing arthroplasty: a systematic review and metaanalysis. Rheumatology (Oxford). 2016;55:573-82.
20. Au K, Reed G, Curtis JR, et al. High disease activity is associated with an increased risk of infection in patients with rheumatoid arthritis. Ann Rheum Dis. 2011;70:785-91.doi: 10.1136/ard.2010.128637
21. Doran MF, Crowson CS, Pond GR, et al. Predictors of infection in rheumatoid arthritis. Arthritis Rheum. 2002;46:2294-300. doi: 10.1002/art.10529
22. Kurtz SM, Lau E, Watson H, et al. Economic burden of periprosthetic joint infection in the United States. J Arthroplasty. 2012;Suppl 27:61-5. doi: 10.1016/j.arth.2012.02.022
23. Centers for Disease Control and Prevention. General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices. MMWR. 2011;60:22-3.
24. Salmon JE, Roman MJ. Subclinical atherosclerosis in rheumatoid arthritis and systemic lupus erythematosus. Am J Med. 2008;Suppl 1:S3-8. doi: 10.1016/j.amjmed.2008.06.010
25. Периоперационное ведение пациентов с ревматоидным артритом, нуждающихся в эндопротезировании крупных суставов нижних конечностей. В кн.: Насонов ЕЛ, редактор. Российские клинические рекомендации «Ревматология». Москва: ГЭОТАР-Медиа; 2017. С. 360-70 [Perioperative management of patients with rheumatoid arthritis who need endoprosthetics of large joints of lower extremities. In: Nasonov EL, editor. Rossiyskie klinicheskie rekomendatsii «Revmatologiya» [Russian Clinical Recommendations «Rheumatology»]. Moscow: GEOTAR-Media; 2017. P. 360-70 (In Russ.)].
26. Амирджанова ВН, Макаров МА, Бялик ЕИ и др. Периоперационное ведение больных ревматоидным артритом. Научно-практическая ревматология. 2014;52(4):366-76 [Amirdzhanova VN, Makarov MA, Byalik EI, et al. Perioperative
27. management of patients with rheumatoid arthritis. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(4):366-75 (In Russ.)]. doi: 10.14412/1995-4484-2014-366-375
28. American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Rhythm Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, et al.
29. ACCF/AHA focused update on perioperative b blockade incorporated into the ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery. J Am Coll Cardiol. 2009;54:e13-118. doi: 10.1016/j.jacc.2009.07.010
30. Fleisher LA, Beckman JA, Brown KA, et al. 2009 ACCF/AHA focused update on perioperative b blockade incorporated into the ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Circulation. 2009;120:e169-276. doi: 10.1161/CIRCULATIONAHA.109.192690
31. Falck-Ytter Y, Francis CW, Johanson NA, et al. Prevention of VTE in orthopedic surgery patients: antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141 Suppl 2:e278S-325S.
32. Jacobs JJ, Mont MA, Bozic KJ, et al. American Academy of Orthopaedic Surgeons clinical practice guideline on: preventing venous thromboembolic disease in patients undergoing elective hip and knee arthroplasty. J Bone Joint Surg Am. 2012;94:746-7. doi: 10.2106/JBJS.9408.EBO746
33. Савенкова НА. Амирджанова ВН, Макаров СА и др. Отменять ли базисную терапию больным ревматоидным артритом перед эндопротезированием суставов? Научно-практическая ревматология. 2011;49(5):46-50 [Savenkova NA,
34. Amirdzhanova VN, Makarov SA, et al. Should disease-modifying therapy be stopped in patients with rheumatoid arthritis before endoprosthetic joint replacement? Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2011;49(5):46-50 (In Russ.)]. doi: 10.14412/1995-4484-2011-1460
35. Strand V, Ahadieh S, French J, et al. Systematic review and metaanalysis of serious infections with tofacitinib and biologic diseasemodifying antirheumatic drug treatment in rheumatoid arthritis clinical trials. Arthritis Res Ther. 2015;17:362. doi: 10.1186/s13075-015-0880-2
36. Singh JA, Cameron C, Noorbaloochi S, et al. Risk of serious infection in biological treatment of patients with rheumatoid arthritis: a systematic review and meta-analysis. Lancet. 2015;386:258-65. doi: 10.1016/S0140-6736(14)61704-9
37. Maxwell LJ, Zochling J, Boonen A, et al. TNF-a inhibitors for ankylosing spondylitis. Cochrane Database Syst Rev. 2015;4:CD005468.
38. Ito H, Kojima M, Nishida K, et al. Postoperative complications in patients with rheumatoid arthritis using a biological agent: a systematic review and meta-analysis. Mod Rheumatol. 2015;25:672-8. doi: 10.3109/14397595.2015.1014302
39. Lopez-Olivo MA, Amezaga Urruela M, McGahan L, et al. Rituximab for rheumatoid arthritis. Cochrane Database Syst Rev. 2015;1:CD007356.
40. Ruiz Garcia V, Jobanputra P, Burls A, et al. Certolizumab pegol (CDP870) for rheumatoid arthritis in adults. Cochrane Database Syst Rev. 2014;9:CD007649.
41. Song GG, Bae SC, Lee YH. Efficacy and safety of tofacitinib for active rheumatoid arthritis with an inadequate response to methotrexate or disease-modifying antirheumatic drugs: a metaanalysis of randomized controlled trials. Korean J Intern Med. 2014;29:656-63. doi: 10.3904/kjim.2014.29.5.656
42. Cohen S, Radominski SC, Gomez-Reino JJ, et al. Analysis of infections and all-cause mortality in phase II, phase III, and longterm extension studies of tofacitinib in patients with rheumatoid arthritis. Arthritis Rheum. 2014;66:2924-37. doi: 10.1002/art.38779
43. Michaud TL, Rho YH, Shamliyan T, et al. The comparative safety of tumor necrosis factor inhibitors in rheumatoid arthritis: a metaanalysis update of 44 trials. Am J Med. 2014;127:1208-32. doi: 10.1016/j.amjmed.2014.06.012
44. Borba HH, Wiens A, de Souza TT, et al. Efficacy and safety of biologic therapies for systemic lupus erythematosus treatment: systematic review and meta-analysis. BioDrugs 2014;28:211-28. doi: 10.1007/s40259-013-0074-x
45. He Y, Wong AY, Chan EW, et al. Efficacy and safety of tofacitinib in the treatment of rheumatoid arthritis: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2013;14:298. doi: 10.1186/1471-2474-14-298
46. Lethaby A, Lopez-Olivo MA, Maxwell L, et al. Etanercept for the treatment of rheumatoid arthritis. Cochrane Database Syst Rev. 2013;5:CD004525.
47. Machado MA, Barbosa MM, Almeida AM, et al. Treatment of ankylosing spondylitis with TNF blockers: a meta-analysis. Rheumatol Int. 2013;33:2199-213. doi: 10.1007/s00296-013-2772-6
48. Li ZH, Zhang Y, Wang J, Shi ZJ. Etanercept in the treatment of ankylosing spondylitis: a meta-analysis of randomized, doubleblind, placebo-controlled clinical trials, and the comparison of the Caucasian and Chinese population. Eur J Orthop Surg Traumatol. 2013;23:497-506. doi: 10.1007/s00590-012-1035-7
49. Schoels MM, van der Heijde D, Breedveld FC, et al. Blocking the effects of interleukin-6 in rheumatoid arthritis and other inflammatory rheumatic diseases: systematic literature review and metaanalysis informing a consensus statement. Ann Rheum Dis. 2013;72:583-9. doi: 10.1136/annrheumdis-2012-202470
50. Lan L, Han F, Chen JH. Efficacy and safety of rituximab therapy for systemic lupus erythematosus: a systematic review and metaanalysis. J Zhejiang Univ Sci B. 2012;13:731-44. doi: 10.1631/jzus.B1200057
51. Dommasch ED, Abuabara K, Shin DB, et al. The risk of infection and malignancy with tumor necrosis factor antagonists in adults with psoriatic disease: a systematic review and meta-analysis of randomized controlled trials. J Am Acad Dermatol. 2011;64:1035- 50. doi: 10.1016/j.jaad.2010.09.734
52. Campbell L, Chen C, Bhagat SS, et al. Risk of adverse events including serious infections in rheumatoid arthritis patients treated with tocilizumab: a systematic literature review and meta-analysis of randomized controlled trials. Rheumatology (Oxford). 2011;50:552-62. doi: 10.1093/rheumatology/keq343
53. Lee YH, Bae SC, Song GG. The efficacy and safety of rituximab for the treatment of active rheumatoid arthritis: a systematic review and meta-analysis of randomized controlled trials. Rheumatol Int. 2011;31:1493-9. doi: 10.1007/s00296-010-1526-y
54. Katikireddi VS, Whittle SL, Hill CL. Tumour necrosis factor inhibitors and risk of serious infection in rheumatoid arthritis. Int J Rheum Dis. 2010;13:12-26. doi: 10.1111/j.1756-185X.2009.01457.x
55. Wiens A, Venson R, Correr CJ, et al. Meta-analysis of the efficacy and safety of adalimumab, etanercept, and infliximab for the treatment of rheumatoid arthritis. Pharmacotherapy. 2010;30:339-53. doi: 10.1592/phco.30.4.339
56. Storage SS, Agrawal H, Furst DE. Description of the efficacy and safety of three new biologics in the treatment of rheumatoid arthritis. Korean J Intern Med. 2010;25:1-17. doi: 10.3904/kjim.2010.25.1.1
57. An MM, Zou Z, Shen H, et al. The addition of tocilizumab to DMARD therapy for rheumatoid arthritis: a meta-analysis of randomized controlled trials. Eur J Clin Pharmacol. 2010;66:49-59. doi: 10.1007/s00228-009-0754-0
58. Wiens A, Correr CJ, Pontarolo R, et al. A systematic review and meta-analysis of the efficacy and safety of etanercept for treating rheumatoid arthritis. Scand J Immunol. 2009;70:337-44. doi: 10.1111/j.1365-3083.2009.02296.x
59. Fouque-Aubert A, Jette-Paulin L, Combescure C, et al. Serious infections in patients with ankylosing spondylitis with and without TNF blockers: a systematic review and meta-analysis of randomised placebocontrolled trials. Ann Rheum Dis. 2010;69:1756-61. doi: 10.1136/ard.2008.098822
60. Leombruno JP, Einarson TR, Keystone EC. The safety of antitumour necrosis factor treatments in rheumatoid arthritis: meta and exposure-adjusted pooled analyses of serious adverse events. Ann Rheum Dis. 2009;68:1136-45. doi: 10.1136/ard.2008.091025
61. Alonso-Ruiz A, Pijoan JI, Ansuategui E, et al. Tumor necrosis factor a drugs in rheumatoid arthritis: systematic review and metaanalysis of efficacy and safety. BMC Musculoskelet Disord. 2008;9:52. doi: 10.1186/1471-2474-9-52
62. Saad AA, Symmons DP, Noyce PR, Ashcroft DM. Risks and benefits of tumor necrosis factor-a inhibitors in the management of psoriatic arthritis: systematic review and metaanalysis of randomized controlled trials. J Rheumatol. 2008;35:883-90.
63. Gartlehner G, Hansen RA, Jonas BL, et al. The comparative efficacy and safety of biologics for the treatment of rheumatoid arthritis: a systematic review and metaanalysis. J Rheumatol. 2006;33:2398-408.
64. Bongartz T, Sutton AJ, Sweeting MJ, et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA. 2006;295:2275-85. doi: 10.1001/jama.295.19.2275
65. Fleischmann R, Baumgartner SW, Weisman MH, et al. Long term safety of etanercept in elderly subjects with rheumatic diseases. Ann Rheum Dis. 2006;65:379-84. doi: 10.1136/ard.2005.035287
66. Capogrosso Sansone A, Mantarro S, Tuccori M, et al. Safety profile of certolizumab pegol in patients with immune-mediated inflammatory diseases: a systematic review and meta-analysis. Drug Safety. 2015;38:869-88. doi: 10.1007/s40264-015-0336-2
67. Tarp S, Furst DE, Luta G, et al. Risk of serious adverse effects associated with different biological and targeted synthetic diseasemodifying anti-rheumatic drugs in patients with rheumatoid arthritis: a systematic review and meta-analysis of randomised trials [abstract]. Ann Rheum Dis. 2015;74 Suppl 2:176-7.
68. doi: 10.1136/annrheumdis-2015-eular.3288
69. De la Forest M, Brugneaux J, Utard G, Salliot C. Safety of anti-TNFs in RA patients in real life: results from a systematic literature review and meta-analyses from biologic registers [abstract]. Ann Rheum Dis. 2015;74 Suppl 2:702. doi: 10.1136/annrheumdis-2015-eular.2781
70. Hochberg M, Janssen K, Broglio K, et al. Comparison of abatacept and other biologic DMARDs for the treatment of rheumatoid arthritis patients: a systematic literature review and network metaanalysis [abstract]. Ann Rheum Dis. 2014;73 Suppl 2:676. doi: 10.1136/annrheumdis-2014-eular.5331
71. Tarp S, Tarp U, Andersen LS, et al. Serious adverse events associated with using biological agents to treat rheumatic diseases: network meta-analysis from a national guideline panel [abstract]. Arthritis Rheum. 2013;65 Suppl:S997-8.
72. He Y, Wong A, Chan E, et al. Safety of tofacitinib in the treatment of rheumatoid arthritis: a systematic review and meta-analysis. Drug Safety. 2013;36:852-3.
73. Singh JA, Wells G, Christensen R, et al. Risk of cancer, serious lung infections and death with biologics: a systematic review and network meta-analysis of randomized controlled trials (RCTs) [abstract]. Ann Rheum Dis. 2013;72:A74. doi: 10.1136/annrheumdis-2013-eular.276
74. Ahadieh S, Checchio T, Tensfeldt T, et al. Meta-analysis of malignancies, serious infections, and serious adverse events with tofacitinib or biologic treatment in rheumatoid arthritis clinical trials. J Pharmacokinetics Pharmacodynamics. 2013;40:S93-4.
75. Lin T, Shamliyan T, Choi H, et al. The safety of anti-TNF biologic agents in rheumatoid arthritis: a metaanalysis of 35 RCTs [abstract]. Arthritis Rheum. 2012;64 Suppl:S1854.
76. Venson R, Wiens A, Correr CJ, Pontarolo R. Efficacy, safety and tolerability of using abatacept for the treatment of rheumatoid arthritis. Brazil J Pharm Sci. 2012;48:781-91. doi: 10.1590/S1984-82502012000400022
77. Cormier H, Barnetche T, Schaeverbeke T. The risk of serious infection with and without anti-TNF therapy in rheumatoid arthritis and ankylosing spondylitis: a metaanalysis [abstract]. Arthritis Rheum. 2011;63 Suppl:S878.
78. Dommasch E, Troxel A, Shin D, et al. The safety of tumor necrosis factor antagonists in patients with psoriatic disease: a systematic review and metaanalysis of randomized controlled trials. J Am Acad Dermatol. 2011;64:AB8. doi: 10.1016/j.jaad.2010.09.734
79. Rieder S, Thompson A, Pope J. Anti-TNF therapy and the risk of serious infection and malignancy in patients with early rheumatoid arthritis: a meta-analysis of randomized controlled trials. J Rheumatol. 2010;37:1343.
80. Powers J, Martin R. Incidence of serious infectious events with methotrexate treatment: metaanalysis of randomized controlled trials. J Am Acad Dermatol. 2010;62:AB4.
81. Volkmann ER, Agrawal H, Maranian P, Furst DE. Rituximab for rheumatoid arthritis: a meta-analysis and systematic review. Clin Med. 2010;2:749-60.
82. Kaine JL. Abatacept for the treatment of rheumatoid arthritis: a review. Curr Ther Res. 2007;68:379-99. doi: 10.1016/j.curtheres. 2007.12.001
83. Nestorov I. Clinical pharmacokinetics of TNF antagonists: how do they differ? Semin Arthritis Rheum. 2005;34 Suppl 1:12-8. doi: 10.1016/j.semarthrit.2005.01.004
84. Jinesh S. Pharmaceutical aspects of anti-inflammatory TNFblocking drugs. Inflammopharmacology. 2015;23:71-7. doi: 10.1007/s10787-015-0229-0
85. Weisman MH, Moreland LW, Furst DE, et al. Efficacy, pharmacokinetic, and safety assessment of adalimumab, a fully human antitumor necrosis factor-a monoclonal antibody, in adults with rheumatoid arthritis receiving concomitant methotrexate: a pilot study. Clin Ther. 2003;25:1700-21. doi: 10.1016/S0149-2918(03)80164-9
86. Breedveld F, Agarwal S, Yin M, et al. Rituximab pharmacokinetics in patients with rheumatoid arthritis: B-cell levels do not correlate with clinical response. J Clin Pharmacol. 2007;47:1119-28. doi: 10.1177/0091270007305297
87. Погожева ЕЮ, Амирджанова ВН, Макаров СА, Насонов ЕЛ. Осложнения после эндопротезирования суставов у пациентов, получающих генно-нженерные биологические препараты. Научно-практическая ревматология. 2012;50(3):43-8 [Pogozheva EYu, Amirdzhanova VN, Makarov SA, Nasonov EL. Complications after endoprosthetic joint replacement in patients receiving genetically engineered biological agents. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2012;50(3):43-8 (In Russ.)]. doi: 10.14412/1995-4484-2012-708
88. Tarp S, Furst DE, Maarten B, et al. Risk of serious adverse effects of biological and targeted drugs in patients with rheumatoid arthritis: a systematic review meta-analysis. Rheumatology (Oxford). 2017;56:417-25.
89. Ramos-Casals M, Soto MJ, Cuadrado MJ, Khamashta MA. Rituximab in systemic lupus erythematosus: a systematic review of off-label use in 188 cases. Lupus. 2009;18:767-76. doi: 10.1177/0961203309106174
90. Murray E, Perry M. Off-label use of rituximab in systemic lupus erythematosus: a systematic review. Clin Rheumatol. 2010;29:707-16. doi: 10.1007/s10067-010-1387-5
91. Furie R, Petri M, Zamani O, et al. A phase III, randomized, placebocontrolled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63:3918-30. doi: 10.1002/art.30613
92. Ahadieh S, Checchio T, Tensfeldt T, et al. Meta-analysis of malignancies, serious infections, and serious adverse events with tofacitinib or biologic treatment in rheumatoid arthritis clinical trials [abstract]. Arthritis Rheum. 2012;64(10 Suppl):S726.
93. Boyle DL, Soma K, Hodge J, et al. The JAK inhibitor tofacitinib suppresses synovial JAK1-STAT signaling in rheumatoid arthritis. Ann Rheum Dis. 2015;74:1311-6. doi: 10.1136/annrheumdis-2014-206028
94. Marik PE, Varon J. Requirement of perioperative stress doses of corticosteroids: a systematic review of the literature. Arch Surg. 2008;143:1222-6. doi: 10.1001/archsurg.143.12.1222
95. Harpaz R, Ortega-Sanchez I, Seward J. Prevention of herpes zoster: recommendation of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2008;57:1-30.
96. Somayaji R, Barnabe C, Martin L. Risk factors for infection following total joint arthroplasty in rheumatoid arthritis. Open Rheumatol J. 2013;7:119-24. doi: 10.2174/1874312920131210005
Источник