Артрит при ибс лечение
Диагностика ИБС и стенокардии при ревматоидном артрите
Согласно современным европейским и российским рекомендациям для оценки риска фатального сердечно-сосудистого события, в том числе у больных РА, следует пользоваться моделью SCORE.
Для определения риска используют следующие факторы: пол, возраст, курение, систолическое АД и общий холестерин. Высоким считают риск фатального события (5% и более) в течение ближайших 10 лет.
К сожалению, для многих больных РА оценка риска по SCORE может занижать риск, особенно при использовании версии с общим холестерином. Например, у некурящей женщины 59 лет, страдающей РА, АД при измерении врачом 140/85 мм рт.ст., уровень общего холестерина — 5,1 ммоль/л (холестерин ЛПВП 0.85 ммоль/л). При оценке по SCORF, риск составляет 2%. Однако у больной 16 припухших суставов, серопозитивность по ревматоидному фактору, СОЭ — 75 мм/ч, СРВ — 54 мг/л. Действительна ли у этой больной низкий риск фатального сердечно-сосудистого события? Реальный риск может превышать 5%. Очевидно, что для больных РА в дополнение к SCORE необходимо расширенное обследование с применением инструментальных методов и последующим уточнением категории риска. Продемонстрировано увеличение комплекса интима-медиа, расцениваемое как субклинический атеросклероз, у больных РА в сравнении с контрольными лицами. Такой подход ограничивает отсутствие унифицированной методологии; кроме того, корреляция степени выраженности каротидного и коронарного атеросклероза весьма умеренная.
ЭхоКГ с оценкой систолической и диастолической функций левого желудочка, а также расчет индекса массы миокарда левого желудочка — распространенный и ценный метод диагностики. Гипертрофия левого желудочка, его систолическая дисфункция и ремоделирование позволяют оценить риск хронической сердечной недостаточности (ХСН).
Электронно лучевая или мультиспиральная компьютерная томография дает возможность оценить выраженность кальциноза коронарных артерий, что отражает тяжесть атеросклероза. У больных РА кальциноз коронарных артерий наиболее выражен при длительном течении заболевания, К сожалению, при опенке выраженности кальциноза невозможно учесть роль воспаления коронарной артерии и стабильности бляшек; можно предположить, что предсказательная ценность электронно-лучевой или мультиспиральной компьютерной томографии в отношении острых коронарных событий у больных РА будет невысокой, хотя этот вопрос требует изучения в проспективных исследованиях. Кроме того, оба метода не всегда доступны в реальной практике.
Нагрузочные тесты (вело- или тредмил-эргометрия) имеют ограниченное применение у больных РА из-за объективной невозможности достижения субмаксимальной ЧСС и ограниченных функциональных возможностей пациентов. Последнее обстоятельство затрудняет интерпретацию результатов холтеровского мониторирования ЭКГ, применяемого для диагностики бессимптомной ишемии миокарда.
Исследования с применением коронарной ангиографии продемонстрировали, что у больных РА чаше, чем у контрольных лиц, наблюдается поражение трех коронарных сосудов. Коронарная ангиография, «золотой стандарт» диагностики, позволяет обнаружить атеросклеротические стенозы коронарных артерий, но не применима для оценки состояния микроциркуляторного русла и воспаления артериальной стенки.
Возможный эффективный метод для диагностики нарушений микроциркуляции — сцинтиграфия миокарда. В единичных исследованиях продемонстрирована высокая частота дефектов перфузии миокарда (до 50%) у больных РА. Метод ограничен из-за сложности и дороговизны.
С помощью суточного мониторирования АД можно выявить пациентов с недостаточным снижением АД ночью, при этом регистрируемые в дневные часы значения АД не превышают границу нормы, АГ в ночной период — независимый фактор неблагоприятного прогноза.
Возможный метод оценки риска сердечно-сосудистых событий у больных РА — одновременное исследование воспалительных маркеров и активности симпатической нервной системы. Высоким уровень СРБ и низкая вариабельность сердечного ритма (отражающая преобладание симпатической активности) вместе обладают высокой предсказательной ценностью в отношении инфаркта миокарда и смерти; по отдельности предсказательная ценность факторов снижается. По данным исследования, проведенного на кафедре факультетской терапии им. акад. А.И. Нестерова РГМУ. низкая вариабельность сердечного ритма (с помощью холтеровского мониторирования ЭКГ) чет ко связана с высокой воспалительной активностью заболевания у больных РА. Вариабельность сердечного ритма снижается при прогрессировании коронарного атеросклероза и может служить предиктором жизнеугрожающих аритмий. В то же время при РА наблюдают высокую частоту внезапной смерти. Таким образом, одновременная оценка воспалительной активности РА и вариабельности сердечного ритма может быть дополнительным методом выявления пациентов с высоким риском сердечно сосудистых событий.
Новый фактор неблагоприятного сердечно-сосудистого прогноза — синдром обструктивного апноэ во сне (СОАС). Для скрининга можно применять вопросники (например, шкалу Эпфорта). «Золотой стандарт» диагностики — полисомнография, выполнение которой сопряжено с большим количеством материальных и технических трудностей. Доступная альтернатива — кардиореспираторный мониторинг сна пациента, во время которого регистрируют три параметра — воздушный поток, сатурацию О2), и ЧСС. Результаты кардиореспираторного мониторинга хорошо коррелируют с данными полисомнографии, этот метод можно применять на амбулаторном этапе для диагностики СОАС.
По немногочисленным данным, СОАС часто наблюдают у больных РА — почти в 50% случаев.
 [21], [22], [23], [24], [25], [26]
[21], [22], [23], [24], [25], [26]
Клиническое наблюдение
Больная З., 56 лет, поступила в отделение ревматологии ГКБ № 1 им. Н.И Пирогова в марте 2008 г. с жалобам и на утреннюю скованность в течение 1,5 ч, боли, ограничение движения в пястно-фаланговых, лучезапястных, коленных, голеностопных суставах, сухость но рту, боли и першение в горле.
Из анамнеза известно, что пациентка больна с сентября 1993 г., когда ее стали беспокоить боли в пястно-фаланговых, лучезапястных суставах, утренняя скованность. Консультирована ревматологом, проведено обследование, поставлен диагноз «ревматоидный артрит, серопозитивный». Проводилось лечение сульфасалазином, без эффекта. В 1995-1996 гг. проводили лечение таурсдоном (на тот момент препарат был зарегистрирован в РФ) с положительным эффектом, однако препарат был отменен в связи с развитием нефропатии. В качестве базисного воздействия назначен гидроксихлорохин (плаквенил), На фоне лечения гидроксихлорохином отмечали прогрессирование заболевания, препарат был отменен, и с 1999 г. начали лечение метотрексатом в дозе 7,5 мг/нед. В связи с повышением печеночных ферментов (ACT, АЛТ) через 6 мес препарат был отменен.
До 2003 г. пациентка не получала болезнь-модифицирующего лечения. В 2003 г., и связи высокой активностью заболевания, начали применять преднизолон. С 2005 г. в качестве базисной терапии назначен лефлупомид в дозе 20 мг, который принимала до осени 2007 г. В октябре 2007 г. у пациентки развился острый ларинготрахеит предполагали диатез рецидивирующего полихондрита, в связи с чем проводили стационарное лечение и начали давать метилпреднизолон в дозе 24 мг/сут. Диагноз не подтвержден, однако сохранялось чувство першения в горле, боли в горле. Дозу метилпреднизолона постепенно снижали, и с февраля 2008 г. пациентка получает 9 мг/сут. В период с 2004 г. по настоящее время пациентка принимала HIIBC (диклофенак) внутрь курсами.
С февраля 2008 г. началось усиление болей в суставах, утренней скованности, в связи с чем пациентка была госпитализирована в стационар.
При поступлении состояние больной удовлетворительное. При осмотре: гиперстенического телосложения. Рост 160 см, вес 76 кг. Окружность талии 98 см, окружность бедер 106 см, окружность шеи 39 см. Кожные покровы обычной окраски, отмечается одутловатость лица. Лимфатические узлы не пальпируются. В легких дыхание везикулярное, хрипы нс выслушиваются. Частота дыхания 17 в минуту. Тоны сердца приглушены, ритм правильный. ЧСС 100 в минуту. АД 130/80 мм рт.ст. Живот при пальпации мягкий, безболезненный. Печень пальпируется у края реберной дуги, безболезненная; селезенка не пальпируется. Периферических отеков нет.
Status heath. Обнаружена болезненность при пальпации и движениях В пястно-фаланговых суставах (1,3, 4-м — справа и 2-м, 3-м — слева), 3-м проксимальном межфаланговом суставе правой кисти, голеностопных суставах и плюснефалангоных суставах обеих стоп. Дефигурация за счет экссудативно-пролиферативных изменении в 1-м, 3-м пястно-фаланговых суставах справа, 3-м, 4-м проксимальных межфаланговых справа, обоих голеностопных суставах. Дефигурация лучезапястных суставов за счет пролиферативных изменений. Гипотрофия интеркостальных мышц, сила сжатия кисти в кулак снижена с обеих сторон. Сгибательная контрактура левого локтевого сустава. Боль по визуальной аналоговой шкале (ВАШ) — 55 мм. Число припухших суставов (счет 44 суставов) — 6. индекс Ричи — 7.
В анализах крови при поступлении Нb — 141 т/л, лейкоцитарная формула не изменена, СОЭ — 55 мм/ч, общий белок — 67,0 г/л, мочевина — 5,1 ммоль/л, билирубин — 1.7,2-0 -17,2 мкмоль/л, отмечено повышение ферментов (ACT — 50 ЕД/л, АЛТ — 48 ЕД/л), общего холестерина до 7,1 ммоль/л. Глюкоза крови — 4,5 ммоль/л. СРВ — отрицательный. Латекс-тест 1:40.
На рентгенограммах кистей обнаружен выраженный остеопороз головок пястных, фаланговых костей и костей запястья. Кистовидные просветления и множественные эрозии суставных поверхностей костей запястья, больше слева. Субхондральный склероз. Заметное сужение щелей лучезапястных суставов, меньше — межфаланговых и пястно-фаланговых сочленений. Подвывих в пястно-фаланговом сочленении 1 пальца справа.
На рентгенограммах коленных суставов в двух проекциях обнаружен выраженный очаговый остеопороз. Субхондралъный склероз. Заметное неравномерное сужение межсуставных щелей, больше справа.
На ЭКГ заметна выраженная синусовая тахикардия. ЧСС — 130 в минуту. Нормальное положение электрической оси сердца, без патологических изменений.
Активность заболевания по DAS28 и DAS4 составила 4,24 и 2,92 соответственно, что соответствует умеренной активности.
Клинический диагноз: ревматоидный артрит серопозитивный, поздняя стадия, активность II (DAS28 4,24), эрозивный (рентгенологическая стадия III), II ФК,
Больной проведены дополнительные методы исследования (ЭхоКГ, холтеровское мониторирование ЭКГ с анализом вариабельности сердечного ритма, суточное мониторирование АД, дуплексное ультразвуковое сканирование сонных артерий, кардиореспираторный мониторинг). Оценен 10-летний риск развития сердечно-сосудистых событий по шкале SCORE.
Результаты обследования: риск фатального сердечно-сосудистого заболевания по шкале SCORE составил 1,4%. С помощью ЭхоКГ установлены признаки гипертрофии миокарда левого желудочка (индекс массы миокарда левого желудочка — 100 г/м2), диффузное снижение сократимости — фракция выброса (ФВ) 45%. Дуплексное сканирование сонных артерий: справа в области бифуркации общей сонной артерии обнаружена атеросклеротическая бляшка, стенозирующая просвет на 20% (рис. 1-3).
Холтеровское мониторирование ЭКГ с анализом вариабельности сердечного ритма: за сутки регистрировали синусовый ритм со средней ЧСС 100 в минуту. Отмечали снижение SDNN, показатели rMSSD. pNN50 в пределах нормы (SDNN — 67 мс, rMSSD = 64 мс, pNN50 = 12,1%).
Суточное мониторирование АД: средние показатели АД за дневной период составили 146/86 мм рт.ст. Регистрировали повышение АД в ночной период: средненочные показатели АД составили 162/81 мм рт.ст.
При кардиореспираторном мониторинге обнаружен СОАС тяжелой степени тяжести (индекс апноэ-гипопноэ 49, норма менее 5).
У некурящей пациентки с отсутствием жалоб на боли или дискомфорт и грудной клетке, без указаний в анамнезе на АГ и нормальными значениями АД при измерении врачом суммарный риск
сердечно-сосудистого заболевания был низким. Однако при расширенном клинико-инструментальном обследовании выявлены как субклинический атеросклероз сонной артерии, так и следующие факторы неблагоприятного прогноза:
- гипертрофия левого желудочка;
- ночная АГ;
- снижение вариабельности сердечного ритма;
- СОАС.
Таким образом, в рассмотренном случае благодаря комплексному анализу установлен высокий риск сердечно-сосудистых осложнений, в связи с чем пациентке показаны немедикаментозные мероприятия и лекарственное лечение, направленное на снижение риска.
Приведенный клинический пример иллюстрирует необходимость использования современных методов оценки кардиоваскулярного риска у данной категории больных.
 [27], [28], [29], [30], [31], [32], [33], [34], [35]
[27], [28], [29], [30], [31], [32], [33], [34], [35]
Источник
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
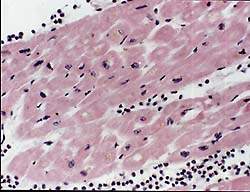 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
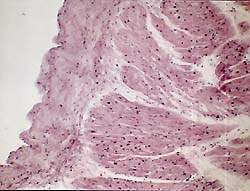 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник

