Хеликобактер пилори и артрит
Представлены результаты исследования частоты инфицированности и оценки эффективности альтернативной схемы эрадикационной терапии Helicobacter pylori у больных ревматическими заболеваниями
Helicobacter pylori (H. pylori) – самая распространенная инфекция человека: не менее половины жителей Земли являются носителями этой бактерии. Взаимодействие H. pylori и иммунной системы формирует широкий спектр биологических реакций, от относительно спокойного сосуществования микро- и макроорганизма до выраженного воспалительного процесса и серьезных аутоиммунных нарушений. Эта бактерия известна как основной этиологический фактор хронического гастрита, язвы желудка и двенадцатиперстной кишки, а также аденокарциномы желудка [1, 2]. Кроме того, инфекция H. pylori ассоциируется с развитием ряда аутоиммунных заболеваний, таких как аутоиммунная гемолитическая анемия, тромбоцитопеническая пурпура, IgA-нефропатия и др. (всего более 90 наименований). Имеются данные, свидетельствующие о взаимосвязи H. pylori и развитии ревматических заболеваний (РЗ) – ревматоидного артрита, прогрессирующего системного склероза, синдрома Шегрена [3]. Однако для ревматологов клиническое значение H. pylori, прежде всего, определяется его ролью в развитии лекарственных осложнений противоревматической терапии.
Речь пойдет о НПВП-гастропатии – поражении верхних отделов желудочно-кишечного тракта (ЖКТ), которое возникает на фоне приема нестероидных противовоспалительных препаратов (НПВП). Хотя НПВП и H. pylori считаются независимыми факторами развития эрозивно-язвенных изменений ЖКТ, имеется ряд исследований, показывающих их негативный синергизм. Согласно последним международным рекомендациям по диагностике и лечению H. pylori-ассоциированной патологии (Маастрихтское соглашение V), выявление и эрадикация этого микроорганизма настоятельно рекомендуется в случае развития НПВП-гастропатии. Тестирование на H. pylori и проведение курса антихеликобактерной терапии также показано лицам, нуждающимся в приеме НПВП и имеющим такие факторы риска, как язвенный анамнез, выраженная диспепсия и сопутствующий прием препаратов, влияющих на свертывание крови [4].
К сожалению, российские ревматологи и терапевты не так часто проводят эрадикацию H. pylori в своей повседневной практике, передавая решение вопроса о целесообразности данной терапии «узким специалистам» – гастроэнтерологам. В определенной степени это связано с недостаточными знаниями проблемы заболеваний и состояний, ассоциированных с H. pylori. С другой стороны, многие российские врачи избегают назначения комбинированной антибактериальной терапии, опасаясь известных нежелательных реакций (НР) – прежде всего, развития дисбиоза кишечника и диареи, связанной с избыточным ростом условно-патогенной флоры.
Решить проблему может альтернативный режим эрадикации H. pylori. В частности, большой интерес представляет схема антибактериальной терапии, включающая нифурател и предложенная Научным обществом гастроэнтерологов России в рамках национальных российских рекомендаций по лечению заболеваний, ассоциированных с H. pylori [5].
Нифурател – производное нитрофурана, препарат широкого спектра действия, активный в отношении H. pylori; кроме антибактериальной активности, он также обладает противогрибковым и противопротозойным эффектом. Принципиальным достоинством нифуратела является способность подавлять условно-патогенную флору кишечника, не нарушая при этом микробного равновесия. Собственно, этот препарат активно используется в качестве системного кишечного антисептика. Поэтому риск развития НР со стороны кишечника при использовании такой схемы антихеликобактерной терапии может быть существенно меньше в сравнении со стандартными схемами, включающими макролиды. При этом также снижается необходимость в назначении пробиотиков для восстановления биоценоза кишечника [6–8].
С целью изучения влияния H. pylori на развитие НПВП-гастропатии и оценки эффективности альтернативной схемы эрадикационной терапии, содержащей нифурател (Макмирор®), нами проведено открытое исследование ГРАНАТ («Геликобактер в Ревматологии: Апробация Нифуратела при Антигеликобактерной Терапии»).
Материал и методы
На первом этапе исследования был проведен скрининг для определения частоты инфекции H. pylori у больных РЗ, регулярно принимавших НПВП. С этой целью всем пациентам, находившимся на стационарном лечении в клинике ФГБНУ «НИИР им. В.А. Насоновой» в период с 01.02.2017 по 31.03.2017 (2 календарных месяца) и направленным для проведения эзофагогастродуоденоскопии (ЭГДС), было выполнено тестирование на инфицированность данным микроорганизмом. Критериями включения в исследование принимались общие показания к ЭГДС (наиболее часто – регулярный прием НПВП, диспепсия или патология ЖКТ в анамнезе), регулярное, не менее 2-х недель, использование НПВП до момента направления на ЭГДС, а также подписанное информированное согласие.
Всего тестирование на H. pylori проведено 109 больным. Характеристика исследуемой группы представлена в таблице 1. В исследуемой группе преобладали женщины среднего возраста, страдающие ревматоидным артритом. Из НПВП пациенты в основном получали нимесулид, диклофенак и мелоксикам; существенная часть из них, кроме того, получали глюкокортикоиды и базисные противовоспалительные препараты (БПВП), в основном метотрексат. Серьезные факторы риска НПВП-гастропатии, такие как наличие язвенного анамнеза и прием низких доз аспирина, имелись менее чем у 10% обследованных. 
При выполнении ЭГДС оценивалось наличие эрозий (поверхностные дефекты слизистой, не имеющие видимой глубины) и язв желудка и/или дефекта стенки желудка/двенадцатиперстной кишки с видимой глубиной, ≥5 мм в диаметре.
H. pylori выявляли путем «настольного» уреазного теста. Предварительно всем больным во время ЭГДС выполнялась биопсия слизистой антрального отдела и нижней трети тела желудка (по 1 образцу); затем эти образцы помещались на специальную пластинку (ХЕЛПИЛ-бланк). Положительная уреазная реакция проявляется ярко-синей окраской индикатора ХЕЛПИЛ-бланка. Тест считался положительным при явном изменении окраски индикатора после контакта с биоптатом слизистой из любого участка желудка.
На втором этапе исследования оценивали эффективность режима эрадикационной терапии с применением нифуратела: омепразол 20 мг 2 р./сут + амоксициллин 1000 мг р./сут + нифурател (Макмирор®) 400 мг 2 р./сут в течение 10 дней. Это лечение проводилось всем больным, инфицированным H. pylori, у которых при выполнении эндоскопического исследования были выявлены эрозии и/или язвы желудка или имелся язвенный анамнез (всего 32 пациента).
Результат лечения оценивался спустя 6 нед. после курса антибактериальной терапии. Для оценки эрадикации (отсутствия) H. pylori в организме больных проводилась полимеразная цепная реакция (ПЦР) в кале.
Все данные, полученные в ходе исследования, с согласия больных вносились в анонимные исследовательские карты. Электронная база данных была создана при помощи программы Microsoft Office Excel 2011, статистический анализ проводился с использованием программы SPSS 17.0. Средние значения приведены в формате M+m. Для оценки статистической значимости отличия количественных параметров применен t-тест Стьюдента, качественные параметры оценивались с помощью показателя χ2, точного теста Фишера и показателя отношения шансов (ОШ).
Проведение настоящего исследования одобрено комитетом по этике при ФГБНУ «НИИР им. В.А. Насоновой» (протокол № 26 от 03.11.2016).
Результаты исследования
Уреазный тест оказался положительным у 61 больного (56,0%). Эрозии и язвы верхних отделов ЖКТ выявлены у 40 пациентов (36,7%), причем единичные эрозии (менее 10) – у 23 (21,1%), множественные эрозии (более 10) – у 8 (7,3%), язвы желудка – у 9 больных (8,3%).
Группы больных, инфицированных и не инфицированных H. pylori, достоверно не различались по среднему возрасту и полу (p<0,05). Имелась четкая достоверная разница в частоте эрозий и язв у больных, инфицированных и не инфицированных H. pylori (рис. 1). Как видно, эти изменения гораздо чаще отмечались у пациентов с положительным уреазным тестом (p<0,001). В частности, язвы желудка были выявлены у 7 инфицированных больных и лишь у 2-х неинфицированных. 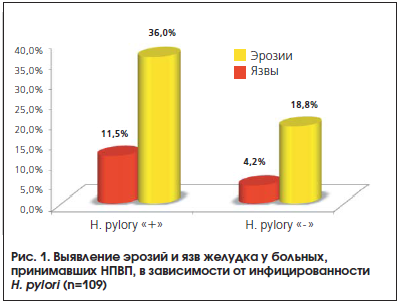
Суммарно риск (ОШ) выявления эрозии и/или язвы желудка у больных, инфицированных H. pylori, составил 3,68 (95% ДИ 1,56–8,68). Следует также отметить, что наличие гастралгий существенно чаще отмечалось у больных с H. pylori – у 19 (31,1%), чем у больных с отрицательным уреазным тестом – у 7 (14,6%), p=0,027.
Эрадикация H. pylori проводилась у 32 больных. Полный курс антибиотиков проведен практически у всех пациентов, лишь у одного из них лечение было прервано из-за развития кожной аллергической реакции. Кроме этого случая, других значимых НР не отмечено.
Через 6 нед. после окончания антихеликобактерной терапии эрадикация H. pylori (отрицательная ПЦР) была достигнута у подавляющего большинства больных (рис. 2). Инфицированность этим микроорганизмом сохранилась лишь в 4-х случаях. Результаты лечения еще 2-х пациентов остались неизвестными. 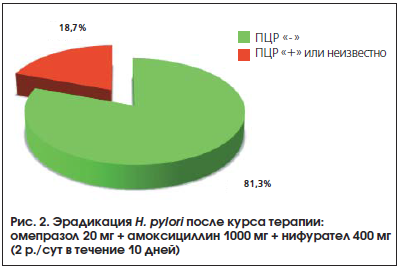
Обсуждение
Согласно полученным данным, H. pylori выявлен более чем у половины больных РЗ, принимавших НПВП. Надо признать, что небольшие размеры исследуемой группы не позволяют делать какие-либо выводы о реальной распространенности этой инфекции среди российских пациентов, тем более что ряд российских исследований демонстрируют существенно более высокий уровень инфицированности H. pylori в российской популяции – до 80–90% [9, 10].
Следует принять во внимание особенности контингента больных, включенных в наше исследование. На госпитализацию в клинику ФГБНУ «НИИР им. В.А. Насоновой» направляются пациенты из самых разных регионов нашей страны, причем обычно в состоянии обострения основного заболевания. Многие из них ранее получали антибиотики, а также ингибиторы протонной помпы (ИПП) в качестве гастропротекторов. Хорошо известно, что антибактериальная терапия и прием ИПП способны подавлять уреазную активность H. pylori, тем самым определяя ложноотрицательные результаты уреазного теста. Тем не менее обнаружение H. pylori более чем у 50% обследованных лиц указывает на серьезность данной проблемы и необходимость ее дальнейшего изучения.
Полученные нами результаты демонстрируют четкую взаимосвязь между наличием H. pylori и выявлением эрозий и язв желудка. Эти данные соответствуют литературным. Так, в 2002 г. J. Huang et al. провели метаанализ 16 рандомизированных контролируемых исследований (РКИ) (n=1625), в которых изучалась частота развития неосложненных и осложненных язв у пациентов, принимавших НПВП. Суммарно язвы были выявлены у 341 из 817 (41,7%) инфицированных H. pylori и у 209 из 808 (25,9%) неинфицированных (ОШ 2,12; 95% ДИ 1,68–2,67). Расчет показал, что сочетание H. pylori и приема НПВП повышало риск развития ЖКТ-кровотечения в 6,13 раза [11].
Похожие данные получены в относительно недавнем исследовании С. Sostres et al., которые исследовали причины развития язвенного кровотечения у 666 пациентов. Соответствующий по полу и возрасту контроль также составил 666 человек. H. pylori выявлен у 74,3% и 54,8% (ОШ 2,6; 95% ДИ 2,0–3,3), прием НПВП зарегистрирован у 34,5% и 13,4% (ОШ 4,0; 95% ДИ 3,0–5,4). В случае сочетания H. pylori и приема НПВП риск развития кровотечения резко возрастал (ОШ 8,0; 95% ДИ 5,0–12,8) [12].
Как уже отмечено выше, тестирование на H. pylori и проведение эрадикации при его выявлении у больных с высоким риском развития НПВП-гастропатии четко рекомендуется Маастрихтским соглашением V [4]. Это обосновано серией исследований, подтвердивших снижение риска серьезных ЖКТ-осложнений у пациентов, которым до назначения НПВП проводилась успешная антихеликобактерная терапия. С другой стороны, у лиц с уже развившейся патологией эрадикация H. pylori не снижает риска рецидивов язв и ЖКТ-кровотечения, если терапия НПВП продолжается, а дополнительная профилактика гастропротекторами не проводится.
Такой вывод подтверждают два метаанализа. Первый из них был представлен в 2005 г. М. Vergara et al., которые оценили результаты 5 РКИ (n=939). Согласно полученным данным, язвы желудка на фоне приема НПВП развились суммарно у 7,4% пациентов, прошедших эрадикацию, и у 13,3% – в группах контроля (ОШ 0,43; 95% ДИ 0,20–0,93). Необходимо отметить, что эрадикация обеспечила не только снижение частоты язв, но и снижение ЖКТ-кровотечений: их число составило 0 и 4 случая (ОШ 0,13; 95% ДИ 0,02–0,92). Однако анализ эффективности эрадикации H. pylori показал четкие различия в подгруппах пациентов, до включения в исследование еще не принимавших НПВП («НПВП-наивных») и уже получавших эти препараты. У первых эрадикация обеспечила значительное снижение риска развития НПВП-гастропатии (ОШ 0,26; 95% ДИ 0,14–0,49), у вторых же не да-вала положительного результата (ОШ 0,95; 95% ДИ 0,53–1,72) [13].
Более поздняя работа С. Tang et al. показала схожие результаты. По данным 7 РКИ, у больных после эрадикации и без нее число язв составило 6,4% и 11,8% соответственно (ОШ 0,50; 95% ДИ 0,36–0,74). Но также было отмечено существенное отличие между «НПВП-наивными» больными и лицами, длительно принимавшими НПВП. Если у первых эрадикация была однозначно эффективна для снижения частоты НПВП-гастропатии (ОШ 0,26; 95% ДИ 0,14–0,49), то у вторых достоверного уменьшения риска ЖКТ-осложнений не отмечено (ОШ 0,74; 95% ДИ 0,46–1,20) [14].
Яркими примерами отсутствия влияния эрадикации H. pylori на частоту рецидивов НПВП-индуцированных язв (после их успешного заживления) при продолжении НПВП-терапии могут служить классическое РКИ HELP-NSAID [15] и меньшее по масштабу открытое российское исследование [16].
Поэтому все больные, у которых развилась НПВП-гастропатия, в дальнейшем (после успешного заживления эрозий и язв желудка), при использовании НПВП, должны в качестве профилактики получать эффективный гастропротектор, например ИПП. Это положение четко отмечено в Маастрихтском соглашении V: «Утверждение 8. Тестирование на H. pylori следует выполнять у принимающих аспирин и НПВП с язвенным анамнезом… Таким образом, лечение ИПП является обязательным для тех, кто получает НПВП, коксибы или даже низкую дозу аспирина после язвенного кровотечения и эрадикации H. pylori при положительном тесте на эту инфекцию» [4].
Проводить эрадикацию H. pylori у больных, у которых на фоне приема НПВП развились язвы или ЖКТ-кровотечение, конечно же, необходимо. Ведь негативное действие инфекции H. pylori не исчерпывается только развитием НПВП-гастропатии. Нельзя забывать о хроническом гастрите и риске аденокарциномы, а также возможности заражения других лиц. В частности, до сих пор неизвестно, как протекает инфекция H. pylori на фоне снижения иммунитета, вызванного приемом синтетических и биологических БПВП для лечения ревматоидного артрита.
Необходимо отметить, что большинство пациентов с наиболее распространенными РЗ, такими как ревматоидный артрит и остеоартрит, не используют НПВП постоянно. На фоне активной патогенетической терапии основного РЗ потребность в обезболивающих средствах может быть сведена до минимума или вовсе исчезнуть. Если у пациента развилась НПВП-гастропатия и при этом выявлен H. pylori, устранение обоих этих факторов (отмена НПВП и эрадикация H. pylori) позволит в дальнейшем снизить риск развития патологии верхних отделов ЖКТ до минимума. В том случае, если потребность в НПВП возникнет вновь, отсутствие H. pylori станет важным фактором предупреждения рецидива поражения ЖКТ.
Наше исследование показало хороший результат применения альтернативной схемы эрадикации H. pylori с использованием нифуратела. Позитивный результат достигнут у 80% больных. При этом переносимость терапии оказалась благоприятной: лишь у одного пациента возникла аллергическая реакция, которая потребовала отмены лечения. Конечно, небольшой размер исследуемой группы и открытый характер исследования ограничивают оценку полученных результатов. Тем не менее, полученные данные представляют интерес как первый опыт применения альтернативной схемы антихеликобактерной терапии у пациентов с РЗ.
Наши результаты подтверждают данные о хорошей эффективности эрадикационных схем на основе нифуратела, показанные, в частности, в детской практике [7, 17]. Так, в работе О.Г. Шадрина и соавт. частота эрадикации H. pylori при использовании этого препарата достигала почти 90% [18].
Как уже отмечено выше, нифурател имеет серьезное преимущество в сравнении с другими антихеликобактерными средствами – он обладает свойствами кишечного антисептика. Нифурател относится к производным нитрофурана и имеет широкий спектр действия; важно, что к нему очень редко формируется устойчивость микроорганизмов. Подавление условно-патогенной флоры и пробиотическое действие нифуратела позволяют избежать развития дисбиотических нарушений и поддерживать нормальное состояние микробиоты кишки. Это принципиально важно при лечении ЖКТ-осложнений, вызванных НПВП. Дело в том, что негативное действие этих препаратов не ограничивается только верхними отделами ЖКТ. У больных, регулярно принимающих НПВП, нередко развивается поражение тонкой кишки – НПВП-энтеропатия. Данная патология относительно редко проявляет себя в виде манифестных форм – кишечного кровотечения, перфорации или формирования стриктур, но часто становится причиной развития медленно прогрессирующей железодефицитной анемии [19]. Имеются данные, что прием антибиотиков и ИПП – это основные компоненты «стандартной» эрадикационной терапии – существенно повышает риск развития НПВП-энтеропатии [20]. Напротив, кишечные антисептики, подавляющие условно-патогенную флору кишки (контаминация этих микроорганизмов играет ключевую роль в развитии энтеропатии), способны предотвращать развитие НПВП-энтеропатии [21]. Поэтому включение в схему эрадикационной терапии нифуратела представляется ценным элементом комплексной защиты ЖКТ от негативного действия НПВП.
Необходимы дальнейшие исследования в этом направлении. Однако полученные данные уже сейчас можно рассматривать как серьезное подтверждение целесообразности более широкого применения нифуратела для лечения и профилактики лекарственных осложнений в ревматологической практике.
Источник
1. Насонов ЕЛ. Почему необходима ранняя диагностика и лечение ревматоидного артрита? Русский Медицинский Журнал. 2002;10(22):1009-12. [Nasonov EL. Why the early diagnosis and treatment of rheumatoid arthritis is necessary? Russkii Meditsinskii Zhurnal. 2002;10(22):1009-12. (In Russ.)].
2. Насонов ЕЛ, Каратеев ДЕ, Сатыбалдыев АМ и др. Ревматоидный артрит в Российской Федерации по данным Российского регистра больных артритом (сообщение 1). Научно-практическая ревматология. 2015;53(5):472-84. [Nasonov EL, Karateev DE, Satybaldyev AM, et al. rheumatoid arthritis in the Russian Federation according to Russian arthritis registry data (communication I). Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2015;53(5):472-84. (In Russ.)]. doi: 10.14412/1995-4484-2015-472-484
3. Фоломеева ОМ, Насонов ЕЛ, Андрианова ИА и др. Ревматоидный артрит в ревматологической практике России: тяжесть заболевания в российской популяции больных. Одномоментное эпидемиологическое исследование. Научно-практическая ревматология. 2010;48(1):50-60. [Folomeeva OM, Nasonov EL, Andrianova IA, et al. Rheumatoid arthritis in rheumatological care of Russia: the severity of the disease in a russian patient population: a cross-sectional epidemiological study (RAISER). Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2010;48(1):50-60. (In Russ.)]. doi: 10.14412/ 1995-4484-2010-1406
4. Балабанова РМ, Эрдес ШФ. Динамика распространенности ревматических заболеваний, входящих в ХIII класс МКБ-10, в популяции взрослого населения Российской Федерации за 2000–2010 гг. Научно-практическая ревматология. 2012;50(3):10–2. [Balabanova RM, Erdes ShF. Trends in the prevalence of rheumatic diseases in ICD-10 in the adult population of the Russian Federation over 2000-2010. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2012;50(3):10–2. (In Russ.)]. doi: 10.14412/1995-4484-2012-702
5. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984 Jun 16;1(8390):1311-5.
6. Smyk DS, Koutsoumpas AL, Mytilinaiou MG, et al. Helicobacter pylori and autoimmune disease: cause or bystander. World J Gastroenterol. 2014 Jan 21;20(3):613-29. doi: 10.3748/wjg.v20.i3.613.
7. Kusters JG, van Vliet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori Infection. Clin Microbiol Rev. 2006 Jul;19(3):449-90. doi:10.1128/CMR.00054-05.
8. Goodwin CS, Armstrong JA. Microbiological aspects of Helicobacter pylori (Campylobacter pylori). Eur J Clin Microbiol Infect Dis. 1990 Jan;9(1):1-13.
9. Sato F, Saito N, Konishi K, et al. Ultrastructural observation of Helicobacter pylori in glucose-supplemented culture media. J Med Microbiol. 2003 Aug;52 (Pt 8):675-9.
10. Dworkin J. Form equals function? Bacterial shape and its consequences for pathogenesis. Mol Microbiol. 2010 Nov; 78(4):792-5.
11. Chaput C, Ecobichon C, Pouradier N, et al. Role of the N-Acetylmuramoyl-lAlanyl Amidase, AmiA, of Helicobacter pylori in Peptidoglycan Metabolism, Daughter Cell Separation, and Virulence. Microb Drug Resist. 2016 Sep;22(6):477-86. doi: 10.1089/mdr.2016.0070. Epub 2016 Jul 22.
12. Маев ИВ, Самсонов АА, Андреев ДН, Гречушников ВБ. Клиническое значение инфекции Helicobacter pylori. Клиниче- ская медицина. 2013;91(8):4-13. [Maev IV, Samsonov AA, Andreev DN, Grechushnikov VB. Clinical significance of Helicobacter pylori infection. Klinicheskaya meditsina. 2013;91(8):4-13. (In Russ.)].
13. Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165.
14. Khalifa MM, Sharaf RR, Aziz RK. Helicobacter pylori: a poor man’s gut pathogen? Gut Pathog. 2010 Mar 31;2(1):2. doi: 10.1186/1757-4749-2-2.
15. Mana F, Vandebosch S, Miendje Deyi V, et al. Prevalence of and risk factors for H. pylori infection in healthy children and young adults in Belgium anno 2010/ 2011. Acta Gastroenterol Belg. 2013 Dec; 76(4):381-5.
16. Hollander WJ, Holster IL, Hoed CM, et al. Ethnicity is a strong predictor for Helicobacter pylori infection in young women in a multi-ethnic European city. J Gastroenterol Hepatol. 2013 Nov;28(11): 1705-11. doi: 10.1111/jgh.12315.
17. Benajah DA, Lahbabi M, Alaoui S, et al. Prevalence of Helicobacter pylori and its recurrence after successful eradication in a developing nation (Morocco). Clin Res Hepatol Gastroenterol. 2013 Nov;37(5): 519-26. doi: 10.1016/j.clinre.2013.02.003. Epub 2013 Apr 6.
18. Hanafi MI, Mohamed AM. Helicobacter pylori infection: seroprevalence and predictors among healthy individuals in Al Madinah, Saudi Arabia. J Egypt Public Health Assoc. 2013 Apr;88(1):40-5. doi: 10.1097/01. EPX.0000427043.99834.a4.
19. Ozaydin N, Turkyilmaz SA, Cali S. Prevalence and risk factors of Helicobacter pylori in Turkey: a nationally-representative, cross-sectional, screening with the 13C-Urea breath test. BMC Public Health. 2013 Dec 21;13:1215. doi: 10.1186/1471-2458-13-1215.
20. Sierra MS, Hastings EV, Fagan-Garcia K, et al. Epidemiology, transmission and public health implications of Helicobacter pylori infection in Western countries. Helicobacter pylori: a worldwide perspective. 2014: 25-79. doi: 10.2174/9781608057375114010006
21. Yokota S, Konno M, Fujiwara S, et al. Intrafamilial, preferentially mother-to-child and intraspousal, Helicobacter pylori infection in Japan determined by mutilocus sequence typing and random amplified polymorphic DNA fingerprinting. Helicobacter. 2015 Oct;20(5):334-42. doi: 10.1111/hel. 12217. Epub 2015 Feb 9.
22. Roesler BM, Rabelo-Goncalves EM, Zeitune JM. Virulence Factors of Helicobacter Pylori: A Review. Clin Med Insights Gastroenterol. 2014 Mar 27;7:9-17. doi: 10.4137/CGast.S13760. eCollection 2014.
23. Montecucco C, Rapuolli R. Living dangerously: how Helicobacter pylori survives in the human stomach. Nat Rev Mol Cell Biol. 2001 Jun;2(6):457-66.
24. Schoep TD, Fulurija A, Good F, et al. Surface properties of Helicobacter pylori urease complex are essential for persistence. PLoS One. 2010 Nov 29;5(11):e15042. doi: 10.1371/journal.pone.0015042.
25. Schreiber S, Konradt M, Groll C, et al. The spatial orientation of Helicobacter pylori in the gastric mucus. Proc Natl Acad Sci U S A. 2004 Apr 6;101(14):5024-9. Epub 2004 Mar 25.
26. Smolka AJ, Backert S. How Helicobacter pylori infection controls gastric acid secretion. J Gastroenterol. 2012 Jun;47(6):609-18. doi: 10.1007/s00535-012-0592-1. Epub 2012 May 8.
27. Cadamuro AC, Rossi AF, Maniezzo NM, Silva AE. Helicobacter pylori infection: host immune response, implications on gene expression and microRNAs. World J Gastroenterol. 2014 Feb 14;20(6):1424-37. doi: 10.3748/wjg.v20.i6.1424.
28. Lee MS, Kim YJ. Signaling pathways downstream of pattern-recognition receptors and their cross talk. Annu Rev Biochem. 2007;76:447-80.
29. Wang G, Ge Z, Rasko DA, Taylor DE. Lewis antigens in Helicobacter pylori: biosynthesis and phase variation. Mol Microbiol. 2000 Jun;36(6):1187-96.
30. Andersen-Nissen E, Smith KD, Strobe KL, et al. Evasion of toll-like receptor 5 by flagellated bacteria. Proc Natl Acad Sci U S A. 2005 Jun 28;102(26):9247-52. Epub 2005 Jun 13.
31. Telford JL, Covacci A, Rappuoli R. Immunobiology of Helicobacter pylori infection. Curr Opin Immunol. 1997 Aug; 9(4):498-503.
32. Satin B, Del Giudice G, Della Bianca V, et al. The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a protective antigen and a major virulence factor. J Exp Med. 2000 May 1;191(9):1467-76.
33. Schwartz JT, Allen LA. Role of urease in megasome formation and Helicobacter pylori survival in macrophages. J Leukoc Biol. 2006 Jun;79(6):1214-25. Epub 2006 Mar 16.
34. Dubois A, Boren T. Helicobacter pylori is invasive and it may be a facultative intracellular organism. Cell Microbiol. 2007 May;9(5):1108-16. Epub 2007 Mar 26. doi:10.1111/j.1462-5822.2007.00921.x.
35. O’Keeffe J, Moran AP. Conventional, regulatory, and unconventional T cells in the immunologic response to Helicobacter pylori. Helicobacter. 2008 Feb;13(1):1-19. doi: 10.1111/j.1523-5378.2008.00559.x.
36. Kä bisch R, Mejias-Luque R, Gerhard M. Involvement of Toll-like receptors on Helicobacter pylori-induced immunity. PLoS One. 2014 Aug 25;9(8):e104804. doi: 10.1371/ journal.pone.0104804. eCollection 2014.
37. Showji Y, Nozawa R, Sato K, Suzuki H. Seroprevalence of Helicobacter pylori infection in patients with connectivetissue diseases. Microbiol Immunol. 1996; 40(7):499-503.
38. Aragona P, Magazzu G, Macchia G, et al. Presence of antibodies against Helicobacter pylori and its heat-shock protein 60 in the serum of patients with Sjö gren’s syndrome. J Rheumatol. 1999 Jun;26(6):1306-11.
39. Sorrentino D, Faller G, DeVita S, et al. Helicobacter pylori associated antigastric autoantibodies: role in Sjö gren’s syndrome gastritis. Helicobacter. 2004 Feb;9(1):46-53.
40. Thieblemont C, Bertoni F, Copie-Bergman C, et al. Chronic inflammation and extra-nodal marginal-zone lymphomas of MALT-type. Semin Cancer Biol. 2014 Feb;24:33-42. doi: 10.1016/j.semcancer.2013.11.005. Epub 2013 Dec 9.
41. Theander E, Nilsson I, Manthorpe R, et al. Seroprevalence of Helicobacter pylori in primary Sjö gren’s syndrome. Clin Exp Rheumatol. 2001 Nov-Dec;19(6):633-8.
42. Francis L, Perl A. Infection in systemic lupus erythematosus: friend or foe? Int J Clin Rheumtol. 2010 Feb 1;5(1):59-74.
43. Magen E, Delgado JS. Helicobacter pylori and skin autoimmune diseases. World J Gastroenterol. 2014 Feb 14;20(6):1510-6. doi: 10.3748/wjg.v20.i6.1510.
44. Sawalha AH, Schmid WR, Binder SR, et al. Association between systemic lupus erythematosus and Helicobacter pylori seronegativity. J Rheumatol. 2004 Aug;31(8):1546-50.
45. Hamamdzic D, Kasman LM, LeRoy EC. The role of infectious agents in the pathogenesis of systemic sclerosis. Curr Opin Rheumatol. 2002 Nov;14(6):694-8.
46. Yazawa N, Fujimoto M, Kikuchi K, et al. High seroprevalence of Helicobacter pylori infection in patients with systemic sclerosis: association with esophageal involvement. J Rheumatol. 1998 Apr;25(4):650-3.
47. Danese S, Zoli A, Cremonini F, Gasbarrini A. High prevalence of Helicobacter pylori type I virulent strains in patients with systemic sclerosis. J Rheumatol. 2000 Jun;27(6):1568-9.
48. Radic M, Kaliterna DM, Bonacin D, et al. Is Helicobacter pylori infection a risk factor for disease severity in systemic sclerosis? Rheumatol Int. 2013 Nov;33(11):2943-8. doi: 10.1007/s00296-012-2585-z. Epub 2012 Dec 6.
49. Yamaguchi K, Iwakiri R, Hara M, et al. Reflux esophagitis and Helicobacter pylori infection in patients with scleroderma. Intern Med. 2008;47(18):1555-9. Epub 2008 Sep 16.
50. Gasbarrini A, Massari I, Serricchio M, et al. Helicobacter pylori eradication ameliorates primary Raynaud’s phenomenon. Dig Dis Sci. 1998 Aug;43(8):1641-5.
51. Savarino V, Sulli A, Zentilin P, et al. No evidence of an association between Helicobacter pylori infection and Raynaud phenomenon. Scand J Gastroenterol. 2000 Dec;35(12):1251-4.
Источник


