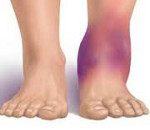
Иммуноглобулины для лечения артрита
Иммуноглобулин для в/в введения
Препарат нормального поливалентного IgG. Стандартный ВВИГ содержит 96% IgG, нестандартный — IgG, IgM, IgA.
• При полиартикулярном варианте ВВИГ вводят в дозе 1,5-2,0 г/кг на введение 2 раза в месяц в течение 2 мес, далее ежемесячно в течение последующих 6 мес. Однако эффект быстро теряется после отмены препарата.
• При системных вариантах ЮРА ВВИГ вводят в дозе 0,7-1 г/кг на курс: эффективен в отношении системных проявлений, вероятно, снижает риск развития интеркуррентных инфекций, но не влияет на течение артрита.
• ВВИГ противопоказан при селективном дефиците IgA.
Инфликсимаб
Инфликсимаб — моноклональные AT к ФНО-а (см. Ревматоидный артрит). Изучается возможность применения инфликсимаба при тяжёлых, резистентных к классическим БПВП формах ЮРА. В настоящее время препарат не зарегистрирован к применению у детей. У детей старше 16 лет в клинических испытаниях показана высокая эффективность препарата. Инфликсимаб в ряде случаев оказывает быстрый выраженный противовоспалительный эффект уже после первого введения.
Тактика назначения: 0, 2-, 6-я неделя и далее каждые 8 нед. Дозировка — 3— 20 мг/кг на введение. Начинать целесообразно с дозы 3 мг/кг. В случае недостаточной эффективности продолжают вводить препарат по указанной схеме, но повышают дозировку; либо уменьшают интервал между введениями до 4-5 нед и при необходимости увеличивают дозу.
Лечение инфликсимабом сочетают с приёмом метотрексата в дозе 7,5— 10 мг/м2 в неделю.
Перед началом лечения необходимо провести туберкулиновую пробу. В случае положительной или сомнительной туберкулиновой пробы лечение инфликсимабом проводить не следует.
Комбинированная иммуносупрессивная терапия
Цель комбинированной терапии — преодоление резистентности к предшествующей монотерапии БПВП.
• Метотрексат 7,5-10 мг/м2/нед и циклоспорин 4,4-4,5 мг/кг/сут. Комбинированная терапия метотрексатом и циклоспорином существенно снижает скорость прогрессирования деструкции в суставах по сравнению с монотерапией указанными препаратами (данные у взрослых).
Показания:
♦ сохранение высокой активности воспалительного процесса у больных системным ЮРА, получающих только метотрексат или циклоспорин;
♦ развитие коксита с асептическим некрозом костей, образующих тазобедренный сустав, или без него у больных, получающих метотрексат;
♦ развитие увеита у больных с олиго- и полиартикулярным ЮРА, получающих метотрексат;
♦ сохранение высоких лабораторных показателей активности заболевания у больных системным ЮРА при хорошем клиническом эффекте лечения циклоспорином.
• Циклоспорин 4,4—4,5 мг/кг/сут и сульфасалазин 30-40 мг/кг/сут.
Показания:
♦ развитие увеита у больных с олиго-или полиартикулярным вариантом ЮРА, получающих сульфасалазин;
♦ развитие коксита у больных с олигоартритом с поздним началом, получающих сульфасалазин.
• Метотрексат 7,5-10 мг/м2/нед и сульфасалазин 30-40 мг/кг/сут.
Показания:
♦ персистирующая активность воспалительного процесса у больных с полиартикулярными вариантами ЮРА, получающих метотрексат;
♦ прогрессирование поражения суставов у больных с олигоартритом с поздним началом, получающих сульфасалазин.
• Метотрексат 7,5—10 мг/м2/нед и гидроксихлорохин 5—7 мг/кг/сут.
Показания:
♦ сохраняющаяся активность воспалительного процесса у больных с оли-го- и полиартритом без поражения глаз, получающих метотрексат.
Лечение отдельных форм ЮРА описано в клинических рекомендациях по диагностике и лечению ювенильного ревматоидного артрита Союза педиатров России.
Дальнейшее ведение больного
Ведение больных ЮРА в амбулаторнополиклинических условиях должен осуществлять детский ревматолог, детский кардиоревматолог или врач-педиатр, прошедший цикл тематического усовершенствования по детской ревматологии, с учётом рекомендаций специализированного ревматологического отделения. Госпитализация показана всем детям с впервые установленным диагнозом, для его подтверждения и выработки тактики терапии.
В дальнейшем детям с системными вариантами ЮРА госпитализация целесообразна не менее 3 раз в год для проведения полного обследования и при необходимости коррекции терапии. Обязательна госпитализация в случае обострения системных проявлений. Детей с олиго- и полиартикулярным ЮРА госпитализируют в плановом порядке 1 —2 раза в год, а также при обострении заболевания, которое не удаётся купировать в амбулаторных условиях.
• Консультацию районного ревматолога необходимо осуществлять 1 раз в месяц для оценки клинических проявлений и переносимости терапии.
• При лечении БПВП 1 раз в 2 недели проводят клинический (содержание эритроцитов, гемоглобина, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) и биохимический (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) анализы крови.
При снижении содержания лейкоцитов, эритроцитов, тромбоцитов ниже нижней границы нормы и повышении концентрации мочевины, креатинина, трансаминаз, билирубина выше верхней границы нормы иммунодепрессанты отменяют на 5—7 дней; после контрольного анализа крови при нормализации показателей приём препарата возобновляют.
• ЭКГ проводят 1 раз в 3—6 месяцев.
• УЗИ органов брюшной полости, сердца, почек, рентгенографию органов грудной клетки, поражённых суставов — по показаниям.
• ФЭГДС с биопсией слизистой оболочки желудка с последующим тестированием на Н. pylori и морфологическим исследованием — 1 раз в 6 месяцев у больных, получающих лечение НПВП и ГК.
• Консультация окулиста и осмотр с помощью щелевой лампы проводят всем больным с поражением суставов 1 раз в 3 месяца.
Всем детям с ЮРА необходимо проведение освидетельствования в МСЭКдля решения вопроса об оформлении инвалидности. Больным с системными вариантами ЮРА следует решить вопрос о возможности организации школьного обучения на дому или в «школах поддержки» для соматически ослабленных детей. Детям с полиартритом и олигоартритом обучение на дому показано в периоды обострения.
Во время посещения школы запрещают занятия физкультурой в общей группе. Необходимы занятия ЛФК. Противопоказаны профилактические прививки, введение гамма-глобулинов, которые могут вызвать тяжёлые обострения заболевания на сроках от 2 недель до 2 месяцев. Детям, получающим комбинированную терапию БПВП, реакцию Манту и рентгенографию органов грудной клетки целесообразно выполнять каждые 6 месяцев.
Прогноз
При системных вариантах ЮРА прогноз неоднозначный. У 40—50% детей прогноз благоприятный: может наступить ремиссия продолжительностью от нескольких месяцев до нескольких лет, однако обострение заболевания может развиться спустя годы после стойкой ремиссии. У 1/3 больных отмечают непрерывно рецидивирующее течение заболевания.
Наиболее неблагоприятен прогноз у детей с упорной лихорадкой, тромбоцитозом, получающих длительную ГК-терапию. У 50% развивается тяжёлый деструктивный артрит. У 20% во взрослом возрасте развивается амилоидоз, у 65% — тяжёлая функциональная недостаточность. Неблагоприятный прогноз у всех детей с ранним дебютом полиартикулярного серонегативного ЮРА. У подростков с серопозитивным полиартритом высок риск развития тяжёлого деструктивного артрита, инвалидизации по состоянию опорно-двигательного аппарата.
У 40% больных с олигоартритом с ранним началом формируется деструктивный симметричный полиартрит. У больных с поздним началом возможна транс-формация заболевания в анкилозирующий спондилит. У 15% больных с увеитом возможно развитие слепоты. Смертность при ЮРА невысока. Большинство летальных исходов связано с развитием амилоидоза или инфекционными осложнениями, развивающимися у больных с системными формами ЮРА в результате длительной терапии ГК.
Насонов Е.Л.
Источник
Ревматоидный артрит (синоним: ревматоидное заболевание) — хроническое прогрессирующее заболевание, относящееся к группе болезней коллагеновых, характеризующееся иммунокомплексной патологией и проявляющееся в основном поражением суставов по типу прогрессирующего эрозивного артрита.
Ревматоидный артрит возникает в возрасте 20-50 лет, женщины болеют чаще, чем мужчины.
Этиология ревматоидного артрита
Этиология ревматоидного артрита не известна. Имеется генетическая предрасположенность к развитию заболевания. Ревматоидный артрит чаще (в 4-16 раз) болеют лица с аллергологическим анамнезом. Антигены гистосовместимости HLA -В27, HLA — В15, HLA — В8 выявляются у больных ревматоидным артритом с большей частотой, чем у здоровых. Инфекционная теория возникновения ревматоидного артрита не нашла подтверждения, однако роль вирусов в этиологии и патогенезе заболевания обсуждается. В пользу вирусной теории свидетельствуют обнаружение вирусоподобных частиц в синовиальной оболочке пораженного сустава, возникновение процесса на фоне вирусной инфекции, сходство рецепторов для компонента СЗЬ комплемента системы, выявленных на клетках синовиальной оболочки суставов, с рецепторами для вируса Эпштейна — Барра. Однако убедительных данных в пользу гипотезы прямого участия микроорганизмов и вирусов в возникновении ревматоидного артрита пока нет. Высказывается мнение о полиэтиоло гичности заболевания.
Патогенез ревматоидного артрита
Патогенез ревматоидного артрита связан с патологией иммунной системы, в частности образованием иммунных комплексов. Ряд фактов свидетельствует о нарушении иммунитета при ревматоидном артрите: наличие аутоантител в сыворотке крови и иммунных комплексов (иммуноглобулин G — антииммуноглобулин G) в синовиальной жидкости; активный синтез иммуноглобулинов плазматическими клетками, инфильтрирующими синовиальные ткани; депозиты иммунных комплексов в синовии; гиперфункция фагоцитирующих клеток и системы комплемента; выявление в сыворотке, синовиальной жидкости, на поверхности синовиальных и соединительнотканных клеток, на эпителии сосудов факторов ревматоидных, представляющих собой антитела, относящиеся к иммуноглобулину G, иммуноглобулину М, иммуноглобулину А, иммуноглобулину Е, против Fc-фрагмента иммуноглобулина G. При серопозитивном ревматоидном артрите определяется ревматоидный фактор типа иммуноглобулина М. Установлено, что более 60 % общего иммуноглобулина Е в сыворотке и синовиальной жидкости больных тяжелым ревматоидным артритом обладает активностью ревматоидного фактора типа иммуноглобулина Е. Уровень последнего коррелирует с активностью заболевания, причем эта корреляция более выражена, чем для ревматоидного фактора типа иммуноглобулина G. У больных ревматоидным артритом с ревматоидным фактором типа иммуноглобулина Е в сыворотке клинически отмечаются внесуставные поражения, чаще всего обусловленные ревматоидным васкулитом. Эти данные свидетельствуют о том, что в патогенезе заболевания большую роль играет ревматоидный фактор типа иммуноглобулина Е, особенно при некоторых формах ревматоидного артрита.
Патогенез синовита при ревматоидном артрите рассматривают следующим образом: плазматические клетки синовиальной оболочки продуцируют большое количество ревматоидного фактора с его избытком при низкой концентрации антигена (свободного иммуноглобулина G). Такое соотношение антигена и антител приводит к локальному образованию крупных ИК, способных индуцировать местное воспаление (ревматоидный синовит). В места воспаления привлекаются полиморфно-нуклеарные лейкоциты, фагоцитируя ИК, они выделяют лизосомальные энзимы, ответственные за повреждение ткани.
Др. авторы связывают патогенез ревматоидного артрита с гиперчувствительностью замедленного типа. В синовиальной ткани пораженных суставов определяется большое количество лимфоцитов и моноцитов, выделяющих монои лимфокины. Последние вызывают повышение сосудистой проницаемости и стимулируют продукцию латентных коллагеназ синовиальными клетками, которые также выделяют активатор плазминогена. Из плазминогена, поступающего в пораженный сустав из сыворотки крови, образуется плазмин, ннгибирующий ингибиторы коллагеназы и активирующий энзимы, вызывающие деструкцию коллагеновых фибрилл.
Выделяют три стадии патогенетического процесса при ревматоидном артрите:
I — возникновение синовита под действием первичного этиологического фактора;
II — последующее включение иммунологических механизмов;
III — развитие пролиферативнодеструктивных изменений с образованием гранулирующей ткани в синовии.
Иммунокомплексный процесс при ревматоидном артрите характеризуется частыми васкулитами, но редким вовлечением почек. Формирование васкулита при ревматоидном артрите связывают с «промежуточными» ИК, в состав которых входят высокоаффинные ревматоидные факторы типа иммуноглобулина G, обладающие высокой способностью к полимеризации с образованием димерных комплексов, имеющих большую константу связывания. Ведущим фактором такого воспаления является активация системы комплемента.
Патоморфология ревматоидного артрита
На ранних стадиях ревматоидного артрита поражаются мелкие сосуды (периваскулярный лимфоцитоз, облитерация нейтрофилами и мононуклеарами, тромбоз) и наблюдается незначительная клеточная пролиферация. В синовиальной жидкости выявляется большое количество мононуклеаров. При выраженном процессе отмечаются отек и утолщение синовиальной оболочки (гиперплазия и гипертрофия синовиальных клеток). Изменения в сосудах — постоянный признак синовита — следующие: обструкция капилляров, инфильтрация нейтрофилами стенок артерий, тромбоз, периваскулярные геморрагии и агрегация лимфоцитов и плазматических клеток. Для хронического ревматоидного артрита характерны деструкция суставного хряща, связок, сухожилий и костной ткани. Основные морфологические признаки ревматоидного артрита — формирование и разрастание грануляционной ткани (паннус) с разрушением хряща и эпифиза костей и образованием узур. Замещение хряща грануляционной тканью приводит к развитию анкилоза.
Клиника ревматоидного артрита
Различают три клинико-анатомические формы ревматоидного артрита:
ревматоидный артрит по типу поли-, олиго- и моноартрита;
ревматоидный артрит, сочетающийся с висцеритами;
ревматоидный артрит, сочетающийся с др. ревматоидными заболеваниями (ревматизм, деформирующий остеоартроз). Наиболее характерными симптомами ревматоидного артрита являются чувство утренней скованности и выраженный болевой синдром как при движении, так и в покое. Дефигурация суставов в первые годы незначительна за счет экссудативных явлений. По мере прогрессирования процесса она увеличивается, происходит вовлечение периартикулярных тканей. В области суставов часто определяются ревматоидные узелки. При объективном исследовании отмечается атрофия мышц, прилежащих к пораженному суставу.
На начальной стадии суставной формы ревматоидного артрита преобладают либо экссудативные явления (отек периартикулярных тканей, выпот с минимальными рентгенологическими изменениями), либо пролиферативные с небольшими дефигурациями, но выраженным разрушением кости, либо доброкачественное течение с полным обратным развитием симптомов и в дальнейшем появлением незначительной дефигурации (при этом варианте не отмечаются стойкие контрактуры).
Ревматоидный артрит может длительно протекать как монои олигоартрит, характеризуясь стойким воспалением в одном или двух суставах. У больных такой формой ревматоидного артрита на фоне моноартрита могут возникнуть воспалительные явления в мелких суставах кистей и стоп.
У части больных ревматоидного артрита (14-30%) поражаются внутренние органы. Суставной синдром у них ярко выражен, преобладают экссудативные изменения в суставах, функция последних стойко нарушена. Клинические проявления вовлечения в процесс легких весьма скудны или отсутствуют. Отмечаются плевральные боли, диспноэ, кашель, кровохарканье. Как правило, легочно-плевральные изменения следуют за суставными, иногда «ревматоидный легочный синдром» предшествует поражению суставов. Выделяют несколько групп поражений легких при ревматоидном артрите: некротизирующий ангиит (вовлечение плевры с неэозинофильными хроническими воспалительными экссудатами); экссудативный (с небольшим количеством жидкости) и адгезивный плевриты; острый и диффузный хронический интерстициальные фиброзы; ревматоидный пневмокониоз — синдром Каплана (заболевание легких, развивающееся у шахтеров, больных ревматоидным артритом); ревматоидные легочные узелки — специфичные для ревматоидного артрита изменения легких. Они чаще всего выявляются у больных с активным течением ревматоидного артрита.
Сердце при ревматоидном артрите поражается часто, но клинические симптомы выражены мало. Они характеризуются появлением ревматоидных гранулем и неспецифическими процессами — перикардитом, миокардитом, эндокардитом и коронаритом. Клапанные пороки отмечаются редко, стенозирование клапанных отверстий не обнаруживается. Часто изменения в сердце протекают по типу миокардиодистрофии.
Патология почек при ревматоидном артрите определяет тяжесть и прогрессирование заболевания, но встречается достаточно редко. Выделяют несколько групп поражений почек: амилоидоз, гломерулонефрит и «лекарственную почку». Этиология и патогенез последнего объясняются как самим ревматоидным артритом, так и воздействием лекарственных средств (противовоспалительных, иммунодепрессантов, препаратов золота, D-пеницилламина), которые применяются при ревматоидном артрите в течение многих лет. Чаще всего наблюдаются повреждения почек, протекающие со скудным мочевым синдромом. Развитие васкулита связано с действием «промежуточных» циркулирующих ИК. В основном поражаются сосуды мелкого калибра, реже — крупного. Поражения глаз редки и характеризуются симптомами склерита, эписклерита, кератита, иридоциклита.
Диагностика ревматоидного артрита
Используются критерии Американской ревматологической ассоциации:
утренняя скованность;
боль при движении или пальпации, по крайней мере в одном суставе (устанавливается врачом);
отечность периартикулярных мягких тканей или выпот в полость сустава, но не костные деформации (оценивается врачом);
припухание др. сустава (оценивается врачом); период отсутствия суставных симптомов до появления этого признака не должен превышать трех месяцев;
симметричность припухших суставов (оценивается врачом); в случаях поражения проксимальных межфаланговых, плюснеи пястно-фаланговых суставов строгая симметричность может отсутствовать; поражение дистальных межфаланговых суставов не удовлетворяет этому критерию;
подкожные узелки в области естественных костных утолщений, разгибательных поверхностей конечностей или периартикулярно (оценивается врачом);
рентгенологические изменения, характерные для ревматоидного артрита (они должны включать, по крайней мере, околосуставный остеопороз при отсутствии дегенеративных изменений, однако наличие дегенеративных изменений еще не исключает диагноз ревматоидного артрита);
ревматоидный фактор;
рыхлый муциновый сгусток при исследовании синовиальной жидкости;
характерные гистологические изменения синовиальной оболочки с наличием, по крайней мере, трех из следующих пяти признаков: значительная гипертрофия ворсин; пролиферация кроющих клеток, часто расположенных вокруг отложений фибрина; значительная лимфоидная инфильтрация с формированием ревматоидных узелков; отложения фибрина на поверхности или в глубине ткани; участки некроза;
характерные гистологические изменения подкожных узелков: образование гранулем с центрально расположенным некрозом, окруженным частоколом макрофагов и лимфоидными клетками.
Наличие семи критериев (причем продолжительность первых пяти должна быть не менее шести недель) характеризует «классический» ревматоидный артрит, наличие пяти (продолжительность которых должна быть не менее шести недель) — «определенный» ревматоидный артрит, наличие трех (продолжительность, по крайней мере, одного из них должна быть не менее трех недель) — «вероятный» ревматоидный артрит.
Дифференциальная диагностика ревматоидного артрита
Дифференциальная диагностика ревматоидного артрита проводится со следующими заболеваниями, в клинике которых встречается суставной синдром: волчанкой красной системной, периартериитом узелковым. ревматизмом, подагрой, острым инфекционным артритом бактериальной или вирусной природы, псориатической артропатией, Бехтерева болезнью, злокачественными опухолями, деформирующим остеоартрозом, синдромом плечо — кисть.
Лечение ревматоидного артрита
Лечение ревматоидного артрита включает медикаментозную терапию и комплекс реабилитационных мероприятий. Терапия проводится с помощью двух групп препаратов: быстродействующих противовоспалительных, влияющих на неспецифические факторы воспаления, и так называемых базисных — средств, которые прямо или опосредованно действуют на различные звенья иммунопатологического процесса. В качестве противовоспалительных используют нестероидные противовоспалительные препараты и глюкокортикостероидные препараты. К первым относят производные ацетилсалициловой (бензойной) кислоты — ацетилсалициловая кислота, салицилат натрия, салициламид; производные пиразолона и пиразолидона — бутадион, реопирин, бенетазон, амидопирин, анальгин; производные индола — индометацин, метиндол, теоремак; производные антраниловой (о-аминобензойной) кислоты — флюфенаминовая кислота (арлеф), мефенаминовая кислота (понстан, оприн, клотам); производные пропионовой кислоты — бруфен, ибупрофен, кетопрофен, напроксен, флюрбипрофен; производные фенилуксусной кислоты — вольтарен; пр. нестероидные противовоспалительные средства — производные метиазиновой, гидроксамовой, нифлумовой кислот, оксиназин.
В качестве базисных средств применяют: хинолиновые производные — делагил, плаквенил; соли золота — кризанол, санокризин, ауранофин; D-пеницилламин; иммунодепрессанты — алкилирующие агенты (хлорбутин, циклофосфамид) и антиметаболиты (азатиоприн); иммуностимулирующие препараты — декарис.
Основным клиническим различием противовоспалительных и базисных препаратов является срок наступления эффекта. Противовоспалительные оказывают анальгетический и противовоспалительный эффекты в первые сутки приема, действие базисных средств сказывается только через два-три месяца от начала терапии и достигает максимума через полгода-год. Действие нестероидных противовоспалительных препаратов разнообразно: они снижают активность лизосомальных ферментов, синтез простогландинов, хемотаксическую активность лейкоцитов, ингибируют сосудистую проницаемость. Ацетилсалициловая кислота до сих пор успешно применяется для снижения утренней скованности при ревматоидном артрите. Однако длительное, многолетнее использование препарата невозможно из-за развития побочного эффекта. Вольтарен, напроксен, бруфен не только высокоэффективны при ревматоидном артрите, но и относительно хорошо переносятся больными. Глюкокортикостероидные препараты предпочтительнее для лечения системных вариантов ревматоидного артрита. При ревматоидном системном васкулите оправдано применение пульс-терапии урбазоном (6-метилпреднизолоном) при суточной дозе 1 г, вводимой внутривенно, обычно в три приема. Хороший эффект оказывает внутрисуставное введение пролонгированных глюкокортикостероидных препаратов (кеналога, депо-медрола).
Препараты базисной, или патогенетической (специфической), терапии относятся к таковым второго ряда, за исключением аминохинолиновых производных, которые назначаются уже в первые месяцы ревматоидного артрита. Однако в связи с низкой эффективностью и развитием ретинопатий аминохинолиновые производные рекомендуют применять при легких формах ревматоидного артрита или в его начальной стадии при благоприятном течении, назначая их непостоянно для предотвращения кумуляции. Большие дозы аминохинолиновых производных могут применяться при ревматоидном артрите, осложненном амилоидозом почек. Препараты золота широко используются при лечении активного, прогрессирующего ревматоидного артрита. Необходимо помнить, что последние являются наиболее частой причиной ятрогенных осложнений. Большие надежды возлагают на новый пероральный препарат золота — ауранофин. D-пеницилламин оказывает выраженное патогенетическое действие при ревматоидном артрите, влияя на альтерацию и пролиферацию клеток, синтез коллагена, образование ревматоидных факторов и ИК. Большое значение при лечении этим препаратом имеет индивидуальный подбор дозы, колеблющийся в широких пределах — от 150 до 1 500 мг в сутки. Длительность лечения D-пеницилламином является основным фактором, определяющим положительный эффект препарата, тогда как величина дозы не имеет столь решающего значения. Отмечено, что прием D-пеницилламина в перерывах между едой способствует получению терапевтического эффекта от меньших доз препарата и лучшей его переносимости. Необходимо помнить о способности D-пеницилламина вызывать иммунокомплексную нефропатию, которая при наличии предшествующих изменений в моче может быть расценена как проявление основного заболевания. D-пеницилламин противопоказан больным с патологией легких, так как может вызвать альвеолит с синдромом бронхоспастическим и последующим пневмосклерозом.
Иммунодепрессанты при ревматоидном артрите считаются патогенетическими препаратами третьего ряда. Циклофосфамид более эффективен при васкулите, а хлорбутин (лейкеран) — при ревматоидном артрите с системными проявлениями. Вопрос о назначении декариса и др. иммуностимулирующих препаратов (гепарина, поливинилпиролидона, гиалуроновой кислоты, хондроитинсульфата) находится в стадии изучения. Декарис показан при поражении почек, когда нельзя использовать препараты золота и D-пеницилламин. Наиболее общепринят при лечении ревматоидного артрита декарисом режим, при котором больной получает 150 мг препарата в течение трех дней в неделю. Все более широко в лечении ревматоидного артрита применяются методы очистки организма от продуктов, индуцирующих воспаление и иммунокомплексную патологию,плазмаферез, замена плазмы, карбогемосорбция. Предварительные результаты свидетельствуют о том, что эти методы часто дают положительный результат даже в тех случаях, когда др. средства оказываются неэффективными.
Источник