Коморбидные состояния при ревматоидном артрите
1. Насонов ЕЛ, редактор. Ревматология: клинические рекомендации. 2-е изд., испр. и доп. Москва: ГЭОТАР- Медиа; 2010. 752 c. [Nasonov EL, editor. Revmatologiya: klinich- eskie rekomendatsii [Rheumatology: clinical recommendations]. 2st ed., ispr. i dop. Moscow: GEOTAR-Media; 2010. 752 p.]
2. Michaud K, Wolfe F. Comorbidities in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 2007;21(5):885–906. DOI: https://dx.doi.org/10.1016/j.berh.2007.06.002.
3. Nicola PJ, Crowson CS, Maradit-Kremers H, et al. Contribution of congestive heart failure and ischemic heart disease to excess mortality in rheumatoid arthritis. Arthritis Rheum. 2006;54(1):60–7. DOI: https://dx.doi.org/10.1002/art.21560.
4. Goodson N, Marks J, Lunt M, Symmons D. Cardiovascular admissions and mortality in an inception cohort of patients with rheumatoid arthritis with onset in the 1980s and 1990s. Ann Rheum Dis. 2005;64(11):1595–601. DOI: https://dx.doi.org/10.1136/ard.2004.034777.
5. Van Doornum S, Brand C, King B, Sundararajan V. Increased case fatality rates following a first acute cardiovascular event in patients with rheumatoid arthritis. Arthritis Rheum. 2006;54(7):2061–8. DOI: https://dx.doi.org/10.1002/art.21932.
6. Sodergren A, Stegmayr B, Lundberg V, et al. Increased incidence of and impaired prognosis after acute myocardial infarction among patients with seropositive rheumatoid arthritis. Ann Rheum Dis. 2007;66(2):263–6.
7. Solomon DH, Goodson NJ, Katz JN, et al. Patterns of cardiovas- cular risk in rheumatoid arthritis. Ann Rheum Dis. 2006;65(12):1608–12. DOI: https://dx.doi.org/10.1136/ard.2005.050377.
8. Franklin J, Lunt M, Bunn D, et al. Risk and predictors of infec- tion leading to hospitalisation in a large primary-care-derived cohort of patients with inflammatory polyarthritis. Ann Rheum Dis. 2007;66(3):308–12. DOI: https://dx.doi.org/10.1136/ard.2006.057265.
9. Wolfe F, Michaud K. Data collection, maintenance, analysis for rheumatic disease research. Rheum Dis Clin North Am. 2004;30(4):753–68. DOI:
10. https://dx.doi.org/10.1016/j.rdc.2004.07.007.
11. Prevoo ML, van’t Hof MA, Kuper HH, et al. Modified disease
12. activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum. 1995;38(1):44–8. DOI: https://dx.doi.org/10.1002/art.1780380107.
13. Shourt CA, Crowson CS, Gabriel SE, Matteson EL. Orthopedic surgery among patients with rheumatoid arthritis 1980–2007: a population-based study focused on surgery rates, sex, and mortali- ty. J Rheumatol. 2012;39(3):481–5. DOI: 10.3899/jrheum.111056.
14. Salliot C, van der Heijde D. Long-term safety of methotrexate monotherapy in patients with rheumatoid arthritis: a systematic literature research. Ann Rheum Dis. 2009;68(7):1100–4. DOI: 10.1136/ard.2008.093690.
15. Schoels M, Knevel R, Aletaha D, et al. Evidence for treating rheumatoid arthritis to target: results of a systematic literature search. Ann Rheum Dis. 2010;69(4):638–43. DOI: 10.1136/ard.2009.123976.
16. Wolfe F, Mitchell DM, Sibley JT, et al. The mortality of rheuma- toid arthritis. Arthritis Rheum. 1994;37(4):481–94. DOI: https://dx.doi.org/10.1002/art.1780370408.
17. Gabriel SE, Michaud K. Epidemiological studies in incidence, prevalence, mortality, and comorbidity of the rheumatic diseases. Arthritis Res Ther. 2009;11(3):229. DOI: 10.1186/ar2669.
18. Gabriel SE. Why do people with rheumatoid arthritis still die pre- maturely? Ann Rheum Dis. 2008;67(3):30–4. DOI: 10.1136/ard.2008.098038.
19. Avina-Zubieta JA, Choi HK, Sadatsafavi M, et al. Risk of cardio- vascular mortality in patients with rheumatoid arthritis: a meta- analysis of observational studies. Arthritis Rheum. 2008;59(12):1690–7. DOI: 10.1002/art.24092.
20. Lindhardsen J, Ahlehoff O, Gislason GH, et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes melli- tus: a Danish nationwide cohort study. Ann Rheum Dis. 2011;70(6):929–34. DOI: 10.1136/ard.2010.143396.
21. Sokka T, Abelson B, Pincus T. Mortality in rheumatoid arthritis: 2008 update. Clin Exp Rheumatol. 2008;26(51):35–61.
22. Meune C, Touzе E, Trinquart L, Allanore Y. Trends in cardiovas- cular mortality in patients with rheumatoid arthritis over 50 years: a systematic review and meta-analysis of cohort studies. Rheumatology (Oxford). 2009;48(10):1309–13. DOI: 10.1093/rheumatology/kep252.
23. Van Halm VP, Peters MJ, Voskuyl AE, et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross- sectional study, the CARRE Investigation. Ann Rheum Dis. 2009;68(9):1395–400. DOI: 10.1136/ard.2008.094151.
24. Maradit-Kremers H, Crowson CS, Nicola PJ, et al. Increased unrecognized coronary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study. Arthritis Rheum. 2005;52(2):402–11. DOI: https://dx.doi.org/10.1002/art.20853.
25. Maradit-Kremers H, Nicola PJ, Crowson CS, et al. Cardiovascular death in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2005;52(3):722–32. DOI: https://dx.doi.org/10.1002/art.20878.
26. Попкова ТВ, Новикова ДС, Насонов ЕЛ. Атеротромбоз при аутоиммунных заболеваниях: современное состояние проблемы. Consilium medicum. 2008;10(11):128–35. [Popkova TV, Novikova DS, Nasonov EL. Aterotromboz at autoimmune diseases: current state of a problem. Consilium medicum. 2008;10(11):128–35. (In Russ.)]
27. Suissa S, Bernatsky S, Hudson M. Antirheumatic drug use and the risk of acute myocardial infarction. Arthritis Rheum. 2006;55(4):531–6. DOI: https://dx.doi.org/10.1002/art.22094.
28. Turesson C, Jarenros A, Jacobsson L. Increased incidence of car- diovascular disease in patients with rheumatoid arthritis: results from a community based study. Ann Rheum Dis. 2004;63(8):952–5. DOI: https://dx.doi.org/10.1136/ard.2003.018101.
29. Naranjo A, Sokka T, Descalzo MA, et al.; QUEST-RA Group. Cardiovascular disease in patients with rheumatoid arthritis: results from the QUEST-RA study. Arthritis Res Ther. 2008;10(2):R30. DOI: 10.1186/ar2383.
30. Новикова ДС, Попкова ТВ, Насонов ЕЛ. Артериальная гипертензия при ревматоидном артрите. Научно- практическая ревматология. 2011;50(3):52–68. [Novikova DS, Popkova TV, Nasonov EL. Arterial hypertension in rheumatoid arthritis. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2011;50(3):52–68. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2011-574.
31. Насонов ЕЛ, Попкова ТВ. Кардиоваскулярные проблемы ревматологии. Научно-практическая ревматология. 2004;44(4):4–9. [Nasonov EL, Popkova TV. Cardiovascular prob- lems of rheumatology. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2004;44(4):4–9. (In Russ.)]
32. Del Rincon ID, Williams K, Stern MP, et al. High incidence of cardiovascular events in a rheumatoid arthritis cohort not explained by traditional cardiac risk factors. Arthritis Rheum. 2001;44(12):2737–45. DOI: https://dx.doi.org/10.1002/1529- 0131(200112)44:12%3C2737::AID-ART460%3E3.0.CO;2-#.
33. Dessein PH, Joffe BI, Veller MG, et al. Traditional and nontradi- tional cardiovascular risk factors are associated with atherosclerosis in rheumatoid arthritis. J Rheumatol. 2005;32(3):435–42.
34. Sattar N, McCarey DW, Capell H, McInnes IB. Explaining how «high-grade» systemic inflammation accelerates vascular risk in rheumatoid arthritis. Circulation. 2003;108(24):2957–63. DOI: https://dx.doi.org/10.1161/01.CIR.0000099844.31524.05.
35. Попкова ТВ, Новикова ДС, Новиков АА и др. Роль нарушений в системе транспорта холестерина крови
36. в развитии атеросклероза при ревматоидном артрите. Научно-практическая ревматология. 2007;46(5):4–10. [Popkova TV, Novikova DS, Novikov AA, et al. Role of blood cholesterol transport system disturbances in atherosclerosis devel- opment in rheumatoid arthritis. Nauchno-prakticheskaya revma- tologiya = Rheumatology Science and Practice. 2007;46(5):4–10. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2007-14.
37. Van Halm VP, Nielen MM, Nurmohamed MT, et al. Lipids and inflammation: serial measurements of the lipid profile of blood donors who later developed rheumatoid arthritis. Ann Rheum Dis. 2007;66(2):184–8.
38. Graham I, Atar D, Borch-Johnson K и др. Европейские рекомендации по профилактике сердечно-сосудистых заболеваний в клинической практике. Рациональная фармакотерапия в кардиологии. 2008;4(3):111–28. [Graham I, Atar D, Borch-Johnson K, et al. European guidelines on cardio- vascular disease prevention in clinical practice. Ratsional’naya far- makoterapiya v kardiologii. 2008;4(3):111–28. (In Russ.)].
39. Solomon DH, Love TJ, Canning C, Schneeweiss S. Risk of dia- betes among patients with rheumatoid arthritis, psoriatic arthritis and psoriasis. Ann Rheum Dis. 2010;69(12):2114–7. DOI: 10.1136/ard.2009.125476.
40. Simard JF, Mittleman MA. Prevalent rheumatoid arthritis and dia- betes among NHANES III participants aged 60 and older.
41. J Rheumatol. 2007;34(3):469–73.
42. Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care. 2004;27(5):1047–53. DOI: https://dx.doi.org/10.2337/diacare.27.5.1047.
43. Wasko MC, Hubert HB, Lingala VB, et al. Hydroxychloroquine and risk of diabetes in patients with rheumatoid arthritis. JAMA. 2007;298(2):187–93. DOI: https://dx.doi.org/10.1001/jama.298.2.187.
44. Wasko MC, Kay J, Hsia EC, Rahman MU. Diabetes mellitus and insulin resistance in patients with rheumatoid arthritis: risk reduc- tion in a chronic inflammatory disease. Arthritis Care Res (Hoboken). 2011;63(4):512–21. DOI: 10.1002/acr.20414.
45. Hoes JN, van der Goes MC, van Raalte DH, et al. Glucose toler- ance, insulin sensitivity and β-cell function in patients with rheumatoid arthritis treated with or without low-to-medium dose glucocorticoids. Ann Rheum Dis. 2011;70(11):1887–94. DOI: 10.1136/ard.2011.151464.
46. Johnsen SP, Larsson H, Tarone RE, et al. Risk of hospitalization for myocardial infarction among users of rofecoxib, celecoxib, and other NSAIDs: a population-based case-control study. Arch Intern Med. 2005;165(9):978–84. DOI: https://dx.doi.org/10.1001/arch- inte.165.9.978.
47. Jü ni P, Nartey L, Reichenbach S, et al. Risk of cardiovascular events and rofecoxib: cumulative meta-analysis. Lancet. 2004;364(9450):2021–9. DOI: https://dx.doi.org/10.1016/S0140- 6736(04)17514-4.
48. Maxwell SR, Moots RJ, Kendall MJ. Corticosteroids: do they damage the cardiovascular system? Postgrad Med J. 1994;70(830):863–70. DOI: https://dx.doi.org/10.1136/pgmj.70.830.863.
49. Kumeda Y, Inaba M, Goto H, et al. Increased thickness of the arterial intima-media detected by ultrasonography in patients with rheumatoid arthritis. Arthritis Rheum. 2002;46(6):1489–97. DOI: https://dx.doi.org/10.1002/art.10269.
50. Van Halm VP, Nurmohamed MT, Twisk JW, et al. Disease-modify- ing antirheumatic drugs are associated with a reduced risk for car- diovascular disease in patients with rheumatoid arthritis: a case control study. Arthritis Res Ther. 2006;8(5):R151. DOI: https://dx.doi.org/10.1186/ar2045.
51. Jacobsson LT, Turesson C, Gü lfe A, et al. Treatment with tumor necrosis factor blockers is associated with a lower incidence of first cardiovascular events in patients with rheumatoid arthritis.
52. J Rheumatol. 2005;32(7):1213–8.
53. Davis JM 3rd, Maradit Kremers H, Crowson CS, et al. Glucocorticoids and cardiovascular events in rheumatoid arthritis: a population-based cohort study. Arthritis Rheum. 2007;56(3):820–30. DOI: https://dx.doi.org/10.1002/art.22418.
54. Peters MJ, Symmons DP, McCarey D, et al. EULAR evidence- based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325–31. DOI: 10.1136/ard.2009.113696.
55. Haugeberg G, Uhlig T, Falch JA, et al. Bone mineral density and frequency of osteoporosis in female patients with rheumatoid arthritis: results from 394 patients in the Oslo County Rheumatoid Arthritis register. Arthritis Rheum. 2000;43(3):522–30. DOI: https://dx.doi.org/10.1002/1529-0131(200003)43:3%3C522::AID- ANR7%3E3.0.CO;2-Y.
56. Van Staa TP, Geusens P, Bijlsma JW, et al. Clinical assessment of the long-term risk of fracture in patients with rheumatoid arthritis. Arthritis Rheum. 2006;54(10):3104–12. DOI: https://dx.doi.org/10.1002/art.22117.
57. Lane NE, Pressman AR, Star VL, et al. Rheumatoid arthritis and bone mineral density in elderly women. The Study of Osteoporotic Fractures Research Group. J Bone Miner Res. 1995;10(2):257–63. DOI: https://dx.doi.org/10.1002/jbmr.5650100212.
58. Kröger H, Honkanen R, Saarikoski S, Alhava E. Decreased axial bone mineral density in perimenopausal women with rheumatoid
59. arthritis: a population based study. Ann Rheum Dis.
60. ;53(1):18–23. DOI: https://dx.doi.org/10.1136/ard.53.1.18. 54. Oelzner P, Schwabe A, Lehmann G, et al. Significance of risk fac-
61. tors for osteoporosis is dependent on gender and menopause in rheumatoid arthritis. Rheumatol Int. 2008 Sep;28(11):1143–50. DOI: 10.1007/s00296-008-0576-x.
62. Orstavik RE, Haugeberg G, Mowinckel P, et al. Vertebral deformi- ties in rheumatoid arthritis: a comparison with population-based controls. Arch Intern Med. 2004;164(4):420–5. DOI: https://dx.doi.org/10.1001/archinte.164.4.420.
63. Беневоленская ЛИ, Торопцова НВ. Остеопороз. В кн.: Ревматология. Национальное руководство. Под ред.
64. Е.Л. Насонова, В.А. Насоновой. Москва: ГЭОТАР-Медиа; 2008. С. 589–607. [Benevolenskaya LI, Toroptsova NV. Osteoporoz. In: Revmatologiya. Natsional’noe rukovodstvo [Rheumatology. National Guide]. Nasonov EL, Nasonova VA, editors. Moscow: GEOTAR-Media; 2008. P. 589–607.]
65. Смирнов АВ, Насонова ВВ. Минеральная плотность костной ткани по данным денситометрического исследования у больных ревматоидным артритом. В кн.: Тезисы Всероссийской конференции с международным участием «Медико-социальные проблемы костно- мышечных заболеваний в ХХI веке». Москва; 2000. С. 93 . [Smirnov AV, Nasonova VV. The mineral density of bone fabric according to densitometrical research at patients with rheumatoid arthritis. In: Tezisy Vserossiiskoi konferentsii s mezhdunarodnym uchastiem «Mediko-sotsial’nye problemy kostno-myshechnykh zabolevanii v XXI veke» [Theses of the All-Russian conference with the international participation «Medico-social problems of bone and muscular diseases in the XXI century»]. Moscow; 2000. P.93.]
66. Sinigaglia L, Nervetti A, Mela Q, et al. A multicenter cross sec- tional study on bone mineral density in rheumatoid arthritis. Italian Study Group on Bone Mass in Rheumatoid Arthritis.
67. J Rheumatol. 2000;27(11):2582–9.
68. Sinigaglia L, Varenna M, Girasole G, Bianchi G. Epidemiology of osteoporosis in rheumatic diseases. Rheum Dis Clin North Am. 2006;32(4):631–58. DOI: https://dx.doi.org/10.1016/j.rdc.2006.07.002.
69. Solomon DH, Katz JN, Cabral D, et al. Osteoporosis manage- ment in patients with rheumatoid arthritis: Evidence for improve- ment. Arthritis Rheum. 2006;55(6):873–7. DOI: https://dx.doi.org/10.1002/art.22350.
70. Dougados M, Soubrier M, Antunez A, et al. Prevalence of comor- bidities in rheumatoid arthritis and evaluation of their monitoring: results of an international, cross-sectional study (COMORA). Ann Rheum Dis. 2014;73(1):62–8. DOI: 10.1136/annrheumdis-2013- 204223.
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
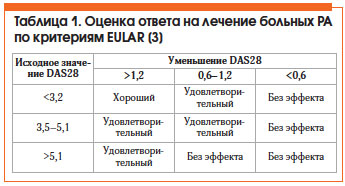
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

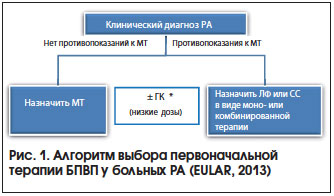
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
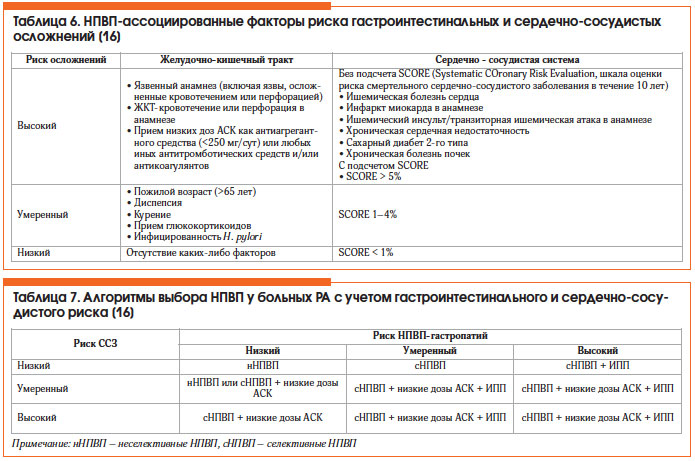
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник


