Подходы к лечению ревматоидного артрита
Лекция 1. Проф. В.И. Мазуров
Современные подходы к выбору тактики
печения ревматоидного артрита.
Рабочая классификация ревматических
болезней
I Ревматизм
II Диффузные болезни соединительной
ткани
II Системные воспалительные васкулиты
IV Ревматоидный артрит
V Ювенильный артрит
VI Болезнь Бехтерева и др.
VII Артриты связанные с инфекцией
VIII Микрокристаллические артриты
IX Паранеопластические артропатии
X Артриты при лекарственной болезни
XI Артриты при метаболических нарушениях
XII Артриты при заболеваниях системы
крови
XIII Артрит при саркоидозе
XIV Артриты с неясным патогенезом
Современные подходы к терапии ревматоидного
артрита
Ревматоидный артрит (РА) — хроническое
заболевание, для которого характерно
неспецифическое воспаление периферических
суставов (обычно с симетричным их
поражением); может приводить к
прогрессирующему разрушению как
суставных, так и внесуставных структур;
возможны также системные проявления.
1. Широкое распространение ревматоидного
артрита РА, в С. Петербурге 56 тысяч
больных РА
2. Хотя имеются общие признаки с ювенильным
артритом, их следует различать
3. Болеют преимущественно женщины 3:1
4:1.
РА — это хроническое аутоимунное системное
заболевание, характеризующееся
преимущественно поражением периферических
суставов ведущее к развитию деструкции
и нарушению функции
Поражаются преимущественно суставы
кистей (проксимальных межфаланговых,
II и III пястно-фаланговых и запястных) и
стоп (плюснефаланговых). Реже крупных
суставов. Боли при движении, веретенообразная
припухлость, симметричность полиартрита,
утренняяя скованность более 30 минут.
После повторных обострений деформации
пальцев — «пуговичная петля», «шея
лебедя»; ульнарная девиация костей
«плавники моржа», атрофия мышц
кистей. Внесуставные проявления —
подкожные ревматоидные узелки, чаще в
области локтевых суставов, реже в
суставах пальцев; полинейропатия;
дигитальный артериит как проявление
системного васкулита; миокардит;
редко эндокардит; диффузный фиброзирующий
аьвеолит; узелковые поражения легких;
адгезивные полисерозиты; поражения
почек — гломерулонефриты, амилоидоз,
лекарственные нефпопатии.
Диагностика: Гипохромная анемия,
повышение СОЭ, сдвиги биохимических
показателей воспаления, ревматоидный
фактор — реакция Ваалера-Розе титр
1:32, по латекс тесту 1:20 (по зарубежным
данным 1:160).
Синовиальная жидкость — мутность, низкая
вязкость, рыхлый муциновый сгусток,
лейкоцитоз, снижение уровня комплемента,
наличие рагоцитов, ревматоидного
фактора.
R—исследование — околосуставной
эпифизарный остеопороз, сужение суставной
щели, краевые узуры (эрозивный артрит),
кистовидные просветления в области
эпифизов, в поздней стадии заболевания
— подвывихи, сгибательные контрактуры,
костные анкилозы.
Биопсия подкожных узелков — ревматоидные
гранулемы, при биопсии синовиальной
оболочки — гипертрофия ворсин, пролиферация
и «палисадообразное» располложение
кроющих клеток вокруг отложений фибрина,
лимфоидная инфильтрация с формированием
ревматоидных узелков.
Синдром Фелти, вариант суставно-висцерального
РА, обычно появляется у больных в
возрасте 40-60 лет. Острое начало: лихорадка,
похуда-
ние, пеллагроподобная пигментация кожи.
Поражение суставов типичное
для РА. Нередки ревматоидные васкулиты.
Отмечается спленомегалия, возможна
гепатомегалия. В 50% увеличены лимфатические
узлы.
Анализ крови — лейкопения, тромбоцитопения,
анемия (гиперспленизм). Ревматоидный
фактор в высоких титрах, нередко
обнаруживается антинуклеарный фактор,
антитела к ДНК, LE-клетки.
Ревматические заболевания
* Иммуноваскулиты (ревматоидный артрит)
диффузные заболевания соединительной
ткани
* Обменно-дистрофические артриты
(деформирующий остеоартрит
* Инфекционные артриты
Существуют 3 основных составляющих
лечения ревматоидного артрита.
* Базисная
* Актуальная
* Дополнительная
I. Базисная терапия — патогенетически
обусловленная терапия влияющая на
основу имунно-воспалительного процесса
предшеественников формирующих
имунно-воспалительный процесс и
действующих на другие клетки
— Т-хелперы, на плазматические клетки и
В-лимфоциты, на системные моноциты
и макрофаги и влияют на систему
комплемента. Эта терапия связана со
снижением активности имунного комплекса
клеток на уровне активации системы
комплемента и уровне фагоцитов и
подавление основного звена специфической
и неспецифической имунной системы.
Эта терапия зависит от течения РА.
— быстро прогрессирующая форма
— медленно прогрессирующая форма
При медленно прогрессирующей форме,
базисная терапия проводится препаратами
аминохинолинового ряда
— делагил 0,25
— плаквинил 0,2
Если нет активности проявления РА — эту
терапию проводят с назначения 2-х
таблеток в день во время приема пищи
илли делагил или плаквенил в течение
4-х недель. В последующем переходят по
1 таблетке на месяцы, а при ее эффективности
и на годы. Отмена препарата недопустима.
Если речь идет о высокой степени
активности РА, если в течение 4-х месяцев
нет эффекта от препаратов аминохинолинового
ряда, то переходят на лечение
сульфаниламидами
— сульфапиридазин 0,5
— сульфасалазин 0,5
Назначать лучше сульфасалазин и особенно
он показан, если есть локальная
воспалительная инфекция или инфекция
со стороны ЖКТ или урогениталльного
тракта.
В первые месяцы 2 г в сутки 1таблетка 4
раза в день или 2 таблетки 2 раза в
день.
Как аминохинолины так и сульфаниламиды
действуют на уровне подавления
Т-хелперов в большей степени на клетки
проявляющие активность на уровне
гуморального иммунитета. Они угнетают
активность фагоцитоза и обладают
способностью к снижению выхода из клеток
гидралаз. Эти ферменты вызывают
дезорганизацию и гибель окружающих
клеток. Эти препараты влияют на
провоспалительные цитокины. Имеются 3
цитокина снижающие свое действие при
лечении этими препаратами — это
интерлейкины 4, 10 и 13, все остальные
интерлейкины провоспалительного
действия, и наиболее активны интерлейкин
1 и опухолевый. Терапия 2-3 месяца. Оценка
ее не
столько эффективности сколько
переносимости и снижения локального
воспалительного процесса но не
подавление.
Если речь идет о прогрессировании
воспалительного процесса. т.е. высокая
частота обострений РА и с каждым новым
обострением вовлекются другие суставы,
если нет возможности управлять
патологическим процессом аминохинолинами
и сульфаниламидами, то назначают
препараты следующего уровня.
D-пенициламин или купренил 0,25, назначается
если нет поражения печени и почек по 1
таблетке 2 раза в день т.е. 500 мг первые
4 неде-
ли и при хорошей переносимости дозу
увеличивают до 750 мг/сутки до
получения эффекта и поддерживающая
терапия 250 мг/сутки длительно месяцы
и годы. Особенно подчеркивается — в
ревматологии при лечении аутоимунных
заболеваний, терапия длительная.
В случаях быстро прогрессирующего РА
или при медленном прогрессировании,
но при наличии узур на R-граммах
целесообразно назначать цитостатики.
Это препараты относятся к антиметаболитам
подавляющим ДНК и РНК и подавляют синтез
фолиевой кислоты.
— метатрексат 7,5 мг в неделю интервал
между приемами 12 часов. Схема назначения
следующая:
1. Понедельник вечером после ужина 2,5
мг.
2. Вторнник по 2,5 мг с интервалом 12 часов
и до следующего понедельника, не
чаще.
Почему доза 7,5 мг/неделю? Эта проблема
однозначно не решена. В Америке назначают
15 мг/нед. Но у нас другая популяция, много
больных с заболеваниями печени и почек.
Метотрексат не дает дозозависимого
эффекта. Но метатрексат при дозе 10
мг/нед. дает дозозависимый эффект. Но
эта доза требует анализа крови каждые
3 недели. Это цитостатик и он подавляет
костно-мозговое кроветворение, особенно
если изначально был снижен уровень
лейкоцитов или при нормальном содержании
лейкрцитов снижен уровень гранулоцитов.
Если есть сомнения, то необходима
стернальная пункция, так как развиваются
тяжелые агранулоцитозы. При получении
эффекта от метатрексата поддерживающая
доза 5 мг в неделю, месяцы и годы.
Следующие препарататы:
Хлоралбутил (лейкеран) 2 мг. Его назначают
в дозе 6-8 мг в день т. е. 3-4 таблетки, но
обязательный контроль периферической
крови и мочи, так как велика опасность
нарушения костно-мозгового кроветворения
и развития нефритов. Поддерживающая
доза при наличии эффекта 4-2 мг в день.
Циклофосфан, препарат вводится
внутримышечно в неактивном состоянии,
активация происходит в митохондриях
печеночных клеток и в активном
состоянии поступает в кровь и оказывает
системное воздействие. При введении
внутримышечно, в полости и перорально
не вызывает побочных эффектов.
Лимфопролиферативные цитостатики
вызывают тяжелые локальные некрозы, а
циклофосфан можно вводить как угодно.
Доза 200 мг 2-3 раза в неделю.
— назначают при костно-висцеральной
форме РА, быстро прогрессирующем
— при РА и формирующемся гломерулонефрите
Пероральная форма эндоксан или
циклофосфамид 150-200 мг лечебная доза и
50 мг в день поддерживающая доза, препарат
хорошо переносится и хорошо дозируется.
Побочные эффекты — угнетение кроветворение,
поражение паренхиматозных органов,
поражение ЖКТ в виде диареи, вздутия,
болевого синдрома.
Циклофосфан назначается при высокой
степени активности РА в сочетании с
васкулитами распространенными или
нераспространенными. Проводится
пульс терапия трехдневными циклами:
1-й день 1000-1200 мг циклофосфана в/венно
капельно + 1 г преднизолона.
2-й день только 1 г преднизолона в/венно.
3-й день только 1 г преднизолона в/венно.
Эта мощная терапия направлена на
подавление воспалительного процесса,
но она эффективна при высокой степени
активности воспалительного процесса.
Следующий препарат из базисной терапии:
— Иммуран (азатиоприн) таблетка 50 мг, 150
мг в сутки до получения клинического
эффекта и затем поддерживающая доза 50
мг в сутки месяцы и годы.
— Циклоспорин А — он избирательно подавляет
Т-хелперы, назначается при трансплантации
органов. Назначается при РА 3 мг/кг веса
тела в день не менее полгода. Но этот
препарат оказывает мощное нефротоксическое
действие и если есть проявления со
стороны почек его не назначать.
Базисная терапия препаратами золота,
их назначают если нет патологии
печени и почек, нет выраженных изменений
со стороны кроветворения и кокда
речь идет о медленно прогрессирующей
форме РА.
— Кризанол отечественный препарат —
масляный раствор, ампулы 5% 1-2 мл, содержит
в 21 мл 17 мг золота и в 43 мл 62 мг золота.
Терапия начинается с введения 8,5 мг
чистого золота в первую неделю 1 раз в
неделю, при хорошей переносимости в
следующую неделю вновь 17 мг золота
и так в течение 3-4 месяцев по 17 мг
еженедельно, а при хорошей переносимости
34 мг в неделю общее количество 2-3 г
чистого золота.
— Санокризин, миокризин содержат по по
10 и 25 мг золота. Препапаты золота в
виде кризанола и саноризина дают побочные
эффекты, аллергические реакции,
действуют на паренхиматозные органы.
— Тауредон — у него меньше побочных
эффектов. Форма выпуска 0,5 мл в ампуле
с содержанием золота 10 мг, 20 мг и 50 мг.
Вызывает торможение антиген-индуцированной
стимуляции лимфоцитов, угнетение
моноцитарного и гранулоцитарного
фагоцитоза, стабилизацию лизосомальных
мембран, укрепление коллагеновых волокон
с занятием имунологически активных
участков, способных спровоцировать
аутоимунный процесс. назначают 1-я
неделя 10 мг золота, 2-я 20 мг, 3-я 50 мг и
далее по 50 мг в течение 5 месяцев в
последующем 50 мг 1 раз в месяц суммарная
доза золота 3 г на курс.
Ни один из базисных препаратов не лишен
побочных эффектов и достаточно
значительных.
За рубежом базисная терапия не всегда
применяется , так как ухудшается
качество жизни, но длительность жизни
не укорачивается. У нас считается, что
без базисной терапии активность РА не
тормозится.
II. Актуальная терапия.
Эта терапия направлена на противовоспалительное
действие и на уменьшение боли. Для
больного базисная терапия не ощутима,
ее эффект проявляется не ранее 6 месяцев
и не подавляет боль. Актуальная терапия
оказывает эффект сразу в первые дни.
1. Нестероидные противовоспалительные
средства (НПВС).
* Монокомпоонентные препараты
— диклофенак натрия таблетки 25-50 мг,
ретард-таблетки 50-100 мг, раствор 0,5% — 3
мл, свечи 50-100 мг обладает мощным
противовоспалительным действием,
он же вольтарен.
— подавляет воспалительный процесс
— подавляет болевой синдром хороший
препарат при в/мышечном введении.
Побочные действия
— изменения со стороны ЖКТ, тошнота,
боль, анорексия, запоры и диарея.
Он относится к ингибиторам циклогеназ
и при подавлении ЦОГ-1 ко-
торая необходима для работы обкладочных
клеток развиваются эрозивные
гастриты и язвенная болезнь.
— риводин 25-50 мг и ретардная форма 100 мг
— синонимы диклаф-15, дикломас, алкофен,
вольтарен и др.
— индометацин (метиндол) 25 мг — масса
побочных эффектов
— ибупрофен 200-400-600-800 мг действует на
печень 0,6 2 раза в день
— напроксен 125-250-500-750 мг 1-2 г в сутки
— пироксикам 10-20 мг эффект развивается
через 30-40 минут.
Все перечисленные препараты обладают
побочными эффектами.
ЦОГ-2 формируется только при воспалительном
процессе и ее надо подавлять, но нужно
помнить что ЦОГ-2 находится в ЦНС.
— Мовалис 7,5 мг таблетки — применять 15 мг
3 недели и затем 7,5 мг, т. е. по 1 таблетке.
III. Дополнительная терапия.
— Глюкокортикоиды в первое время их не
назначают, если в дебюте заболевания
назначить метилпреднизолон, то он даст
хороший эффект, но через 3-4 месяца
развиваются побочные эффекты «синдром
рикошета» и при увеличении дозы эффект
отсутствует и развивается рецидив РА.
Показания для назначения кортикостероидов:
* Высокая степень активности воспалительного
процесса
* Отсутствие эффекта от предшествующей
терапии
30-40 мг преднизолона в сутки до получения
эффекта и постепенно снижая дозу до
полной отмены через 1,5-2 месяца.
— Системная энзимотерапия — это ферментные
препараты растительного и животного
происхождения.
— вобензим таблетки состав: панкреатин
100 мг трипсин 24 мг химотрипсин 1 мг
бромелаин 45 мг папаин 60 мг рутозид
50 мг
— флогензим состав: трипсин 48 мг
бромелаин 90 мг рутозид 100 мг
Оказывают противовоспалительное,
местное противоотечное и вторичное
болеутоляющее действие, улучшает
реологические своства крови и
микроциркуляцию. Вобензим 7 драже 3 раза
в день за 40-50 минут до еды и обильно
запивать водой. молекулы крупные и
всасывамость до 20%, поддерживающая
доза 5 драже 3 раза в день. Эта терапия
подключается к уже проводимой терапии
и позволяет снизить дозы НПВС, а иногда
полностью отменить базисную терапию.
Но она должна быть непрерывной. 30%
резистентны к этой терапии, но 73%
чувствительны.
При выраженном синовите назначают
кеналог в крупные суставы 100 мг, в мелкие
0,25 мг. Но можно вводить и периартикулярно.
Гидрокортизон лучше не вводить —
развивается атрофия синовиальной
оболочки.
Дипроспан в/мышечно целесообразно
повторное введение через неделю.
— Экстракорпоральный плазмоферез 3-5
сеансов 2 сеанса в неделю с замещением
до 1,5 л плазмы с заменой кристаллоидными
растворами, повышается чувствительность
к базисной терапии и действию НПВС.
Имунные препараты при РА не показаны.
Есть самые современные препараты
моноклоновые соединения к противоопухолевым
клеткам — 3-х кратное введение препарата
дает блестящий эффект на 2-3 месяца и
затем вновь надо вводить эти препараты.
Препараты очень дорогие.
— Физиотерапевтические методы ультразвук
с гидрокортизоном, диадинамик.
— Санаторно-курортное лечение не
увлекаться на фоне санаторного лечения
тяжелейшие обострения.
Центр «Дюны», 25 больница.
Источник
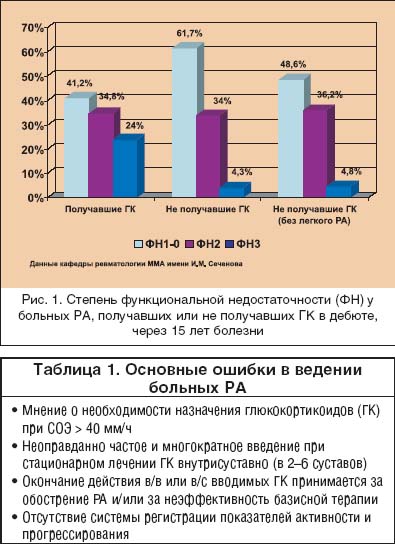
Ревматоидный артрит (РА) – одно из самых тяжелых заболеваний человека, основой которого является хронический пролиферативный синовит, поражение внутренних органов и систем (васкулит или гранулемы), с многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. В течение первых 5 лет болезни до сих пор более 40% больных РА становятся инвалидами [1]. Кроме того, многими авторами сообщается, что РА уменьшает продолжительность жизни больных в среднем на 10 лет [2,3], хотя при контролируемом многолетнем лечении она может быть сопоставима с популяцией [4,5]. РА – болезнь с неизвестной этиологией, чрезвычайно сложным многокомпонентным патогенезом, поэтому терапия его в течение многих лет осуществлялась по сути “ex juvantibus”. Еще недавно клиницисты назначали базисные противовоспалительные препараты (БПВП) только при наличии всех диагностических критериев РА, а подчас только после появления первых эрозий [6]. В настоящее время активно внедряется в практику раннее назначение (БПВП) для улучшения отдаленных исходов болезни. Кроме того, ранняя активная патогенетически обоснованная терапия РА позволяет уменьшить частоту назначения высоких доз симптоматических средств (нестероидных и стероидных противовоспалительных препаратов) и, соответственно, уменьшить частоту побочных реакций, неизбежно сопутствующих их использованию (повреждение слизистой желудочно–кишечного тракта, стероидный остеопороз, синдром Кушинга и др.). Основные ошибки в лечении больных РА представлены в таблице 1, и одной из основных ошибок в лечении больных РА является переоценка значимости симптоматической терапии глюкокортикоидами и слишком частое их использование в дозах, превышающих безопасные. Значение внедрения глюкокортикоидов в терапевтическую практику трудно переоценить. Однако назначение их без явных показаний сопряжено с развитием тяжелых осложнений и, по нашим данным, не приводит к улучшению отдаленного функционального прогноза (рис. 1).
При выборе терапевтической тактики врачи ориентируются на выраженность клинических проявлений суставного синдрома и уровень лабораторных параметров, отражающих активность воспаления (СОЭ и СРБ). К препаратам «первой линии» отнесены те БПВП, которые обладают доказанной эффективностью при РА и хорошей переносимостью [6]: метотрексат, сульфасалазин и аминохинолиновые препараты. При высокой активности РА, как правило, первым БПВП является метотрексат, при умеренной или слабой – сульфасалазин или аминохинолиновые препараты. В последние годы появились данные о высокой эффективности лефлуномида на ранней стадии РА [7]. Действительно, назначение БПВП в первые 3–5 месяцев от дебюта заболевания может улучшить отдаленный функциональный [8] и даже жизненный [5] прогноз. Большинство клиницистов уже адаптированы к раннему назначению БПВП. Наибольшие трудности для практического врача представляет дальнейшее ведение больных, то есть оценка достаточности эффекта проводимой терапии. В настоящее время широко применяются критерии, предложенные Американским колледжем ревматологов (АКР) и Европейской антиревматической лигой (EULAR) для оценки эффекта лечения больных РА [9,10], Однако не ясно, как коррелирует достижение эффекта по предложенным критериям с отдаленным исходом РА и его прогрессированием. Даже при 50–70%–м улучшением по критериям ACR у больного могут сохраняться 3–5 болезненных (БС) или припухших (ВС) сустава, отсутствовать нормализация концентрации СРБ. Является ли это не существенным для изменения терапии или врач должен менять терапевтическую тактику? Существуют данные, что начало лечения РА с комбинации БПВП имеет преимущества перед монотерапией [11].
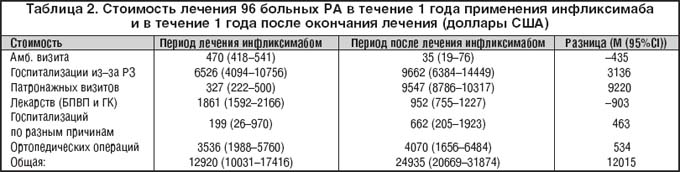
В последние годы в клиническую практику внедрен новый класс лекарственных средств для лечения РА: биологические агенты, воздействующие на основные провоспалительные медиаторы, образующиеся в синовиальной оболочке при РА. Эти препараты способны либо блокировать продуцируемые клетками синовии провоспалительные цитокины (ФНО–a, интерлейкин–1 и др.), либо блокировать клеточные рецепторы к этим цитокинам, воздействовать на ко–стимуляторные молекулы [12]. В России в настоящий момент зарегистрирован единственный препарат из группы биологических агентов – инфликсимаб. Высокая эффективность инфликсимаба при РА и других хронических артритах доказана многочисленными контролируемыми исследованиями [13,14,15]. Первый отечественный опыт применения инфликсимаба в лечении РА и других аутоиммунных заболеваний [16,17] продемонстрировал несомненные преимущества лечения этим препаратом: быстроту развития эффекта (после 1–й инфузии), выраженность клинико–лабораторного эффекта, вплоть до полного отсутствия суставного синдрома и внесуставных проявлений болезни, нормализации СОЭ, СРБ у больных с тяжелым (практически некурабельным) вариантом течения РА, сохранение эффекта при поддерживающей терапии, подавление рентгенологического прогрессирования деструкции суставов и после окончания курса лечения инфликсимабом. Однако в большинстве случаев назначение инфликсимаба планируется только при отсутствии эффекта от последовательно назначаемых БПВП, сохранении высокой активности воспалительного процесса, чем быстром прогрессировании деструкции (появлении более 4–5 новых эрозий за 12 месяцев), наличии ярких внесуставных проявлений [18]. То есть врачи рассматривают инфликсимаб как препарат «резерва». Возможно, высокая стоимость лечения биологическими агентами также повлияла на взгляд, что подобная терапия необходима в случаях отсутствия успеха лечения классическими препаратами. Хотя фармакоэкономическое исследование, проведенное в Финляндии [19] и оценившее стоимость госпитализаций больных РА, стоимость лечения базисными и симптоматическими средствами, посещений врача, проведения различных процедур и ортопедических оперативных вмешательств, показало, что лечение РА блокаторами ФНО–a обходится государству дешевле, чем классические способы лечения (табл. 2).
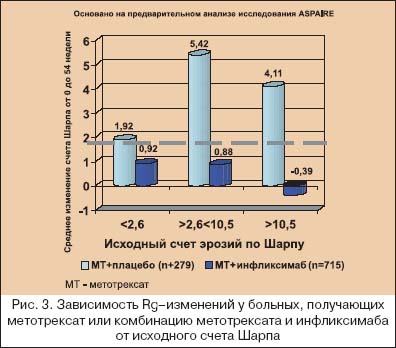
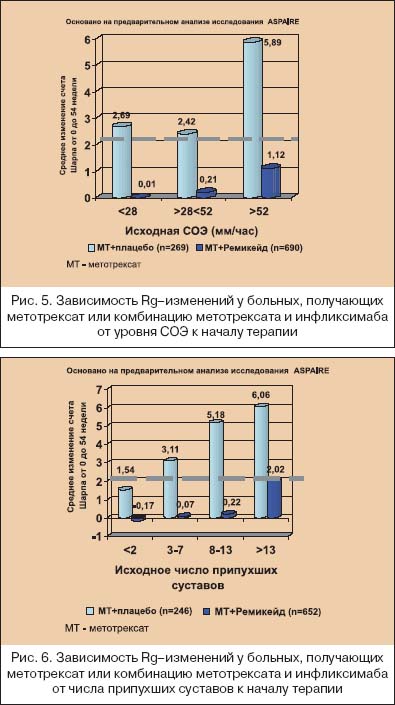
В последние годы многие исследователи склоняются к тому, что ранняя терапия РА означает не только назначение классических БПВП в первые месяцы от дебюта болезни, но и выбор максимально активно (агрессивно) воздействующих лекарственных средств на быстро пролиферирующий синовит. Как показано на рисунке 2, различные звенья патогенеза РА являются мишенями для лечебного воздействия различных групп БПВП. Видно, что максимального эффекта от «классических» БПВП следует ожидать на стадии активации иммуннокомпетентных клеток, которая практически облигатно проходит до появления клинических симптомов, а при развитии артритов в синовиальной оболочке обнаруживаются уже на ранней стадии выраженные пролиферативные процессы [20]. В этой связи становится обоснованным начало терапии РА с метотрексата и лефлуномида. Начало лечения РА с базисных средств основано не только на понимании, что ранняя болезнь не всегда легкая болезнь, но и связано с тем, что при РА отсутствуют четкие критерии прогноза течения и прогрессирования болезни. Известно, что ухудшение функционального исхода болезни четко коррелирует с исходными величинами HAQ (опросника состояния здоровья), количеством ВС, возрастом и женским полом, а более быстрое прогрессирование деструкции суставов – с увеличением количества БС и ВС, уровнем СРБ и т.д. Но до сих пор не было установлено, какая именно выраженность этих параметров должна быть критерием для коррекции терапии или предопределять изначальный выбор более активных методов лечения. Исследование ASPIRE [14] показало, как динамика деструктивного процесса в суставах зависит от исходной выраженности суставного синдрома, лабораторных воспалительных тестов и исходного количества эрозий под влиянием монотерапии метотрексатом и комбинации инфликсимаба с метотрексатом. Деструктивные изменения в мелких суставах кистей и стоп оценивали по модифицированному методу Шарпа [21], который включает в себя подсчет количества эрозий и подсчет степени сужения суставных щелей в мелких суставах кистей и стоп. Считается, что изменение общего счета Шарпа до 2,0 обозначает минимальное прогрессирование деструктивного артрита. Как видно из рисунков 3, 4, 5 и 6, комбинация инфликсимаба и метотрексата в гораздо большей степени подавляла прогрессирование при РА, чем монотерапия метотрексатом. Но особенный интерес вызывают полученные данные, что монотерапия метотрексатом подавляла прогрессирование только при исходно минимальном деструктивном артрите (счет Шарпа не более 2,6), при исходной концентрации СРБ менее чем 0,6 mg/dl, уровне СОЭ<28 мм/ч (по Westgren) и, что представляется особенно важным для клинициста – при исходном количестве припухших суставов не более 2–х, а при наличии 3–х и более припухших суставов подавление деструктивных процессов отмечено только у тех больных, которые получали комбинацию инфликсимаба и метотрексата.
Эти данные заставляют пересмотреть само понятие «агрессивная» терапия РА. Сложилось мнение, что только высокоактивные варианты РА нуждаются в быстром назначении комбинированной базисной терапии, в том числе и комбинаций с биологическими агентами, или использования высоких доз цитостатических препаратов (пульс–терапия метотрексатом или циклофосфамидом), то есть в использовании «агрессивной» терапии. Начиная с 70–х годов прошлого столетия, нами осуществлялся принцип раннего назначения БПВП, независимо от уровня исходной клинико–лабораторной активности РА, всем больным РА. Такой подход позволил добиться развития стойкой клинико–лабораторной ремиссии у 65% больных РА, которым БПВП были назначены в первые 5 месяцев от дебюта заболевания [5]. Внедрение в клиническую практику биологических агентов, специфически подавляющих медиаторы воспаления при РА, на ранних сроках болезни позволит индуцировать стойкие ремиссии болезни у большинства больных. Изучению таких возможностей инфликсимаба посвящено исследование DINORA, в котором инфликсимаб назначается в первые 2–6 недель болезни. Рассматривается даже вопрос о возможности полного излечения РА при максимально раннем начале базисной терапии с использованием инфликсимаба.
Таким образом, тактика лечения РА должна быть направлена на быстрое выявление больных с дебютом суставного синдрома, оперативное проведение диагностических мероприятий и быстрое направление этих больных к специалисту–ревматологу. Очевидно, что трагические исходы РА с полной утратой функции суставов осложнениями болезни в виде утраты функции внутренних органов из–за массивного отложения масс амилоида, асептическими некрозами головок крупных суставов, на современном этапе развития ревматологии не должны допускаться. Тем более, что клиницисты получили новый класс препаратов (биологические агенты), которые реально могут изменить течение РА.


Литература
1. Балабанова Р.М., 1997, гл.9 Руководства по внутренним болезням, стр. 257–294.
2. Goodson N., Symmons D. “Rheumatoid arthritis in women: still associated with increased mortality” Ann. Rheum. Dis., 2002, 61: 955–956
3. Riise T., Jacobsen B.K., Gran J.T. et.al. “Total mortality is increased in rheumatoid arthritis. A 17–year prospective study.” Clin. Rheum., 2002, 20: 123–127
4. Kroot E.J.A., van Leeuwen M.A., van Rijswijk M.H. et.al. “No increased mortality in patient with rheumatoid arthritis: up to 10 years of follow–up from disease onset.” Ann. Rheum. Dis., 2000, 59: 954–958
5. Kanevskaya M.Z., Chichasova N.V. “Treatment of early rheumatoid arthritis: influence on parameters of activity and progression in long–term prospective study”. Ann. Rheum. Dis., Vol. 672, Suppl. 1, 2003, P. 179 (Annual European Congress of Rheumatology, EULAR 2003, Abstracts, Lisbon, 18–21 June 2003)
6. Aletano D., Eberl G., Nell V.P.K. et.al. “Practical progress in realisation of early diagnosis and treatment of patients with suspected rheumatoid arthritis: results from two matched questionnaires within three years” Ann. Rheum. Dis., 2006, V. 61, pp.630–634
7. Scott D.L. “Comparing the benefits of DMARDs in early rheumatoid arthritis” Abstr. Book “Advancing arthritis therapy: addressing patients needs”, Feb. 2006, Seville, Spain, pp.8–9
8. Egmose C., Lund B., Pettersson H. et.al. “Patients with rheumatoid arthritis benefit from early 2nd line therapy: 5 years follow–up of a prospective double–blind placebo controlled study.” J. Rheum., 1995, V.22, pp.2208–2213
9. Felson DT., Anderson J., Boers M. et. al.”The American College of Rheumatology preliminary definition of improvement in rheumatoid arthritis” Arthr. Rheum., 1995, V.38: 727–735
10. Van Gestel AM, Prevoo MLL, van’t Hof MA et.al. “Development and validation of the European League Against Rheumatism response criteria for RA” Arthritis Rheum. 1996; 39:34–40
11. Dougados M., Combe B., Cantagrel A. et.al. “Combination therapy in early rheumatoid arthritis: a randomised, controlled, double blind 52 week clinical trial of sulphasalazine and methotrexate compared with the single components.” Ann. Rheum. Dis., 1999, V.58, pp. 220–225
12. Насонов Е.Л. «Лечение ревматоидного артрита: современное состояние проблемы» РМЖ, 2006, том 14, №8,573–577.
13. Maini R., St Clair E., Breedveld F. et.al. “Infliximab (chimeric antitumour necrosis factor alpha monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randimised phase III trial. ATTRACT Study Group.” Lancet, 1999, 354(9194): 1932–1939
14. St Clair E., van der Heijde D., Smolen J. et.al. “Combination on infliximab and methotrexate therapy for early rheumatoid arthritis:a randomised, controlled trial.” Arthr. Rheum., 2004, 50 (11): 3432–3443
15. Насонов Е.Л. «Инфликсимаб при спондилоатропатиях и псориатическом артрите: новые показания» РМЖ, 2005, том 13, №8, 528–531
16. Чичасова – Ремикейд
17. Мазуров В.И., Лила А.М, Жигурова Е.С. «Опыт применения Ремике0йда при некоторых аутоиммунных заболеваниях», РМЖ, 2005, том 13, №10, 700–73
18. Лукина Г.В., Сигидин Я.А., Чичасова Н.В. и др. «Применение моноклональных антител к фактору некроза опухоли (Ремикейд) при ревматоидном артрите: предварительные результаты» Тер. Архив, 2003, №5, стр. 9–12
19. Laas K., Peltomaa R., Kautiainenet H. al. “Pharmacoeconomic study of patients with chronic inflammatory join disease before and during infliximab treatment” Ann. Rheum. Dis., 2006, 65: 924–928
20. Чичасова Н.В., Шехтер А.Б., Крель А.А. «Эволюция морфологических проявлений синовита с начальной стадией ревматоидного артрита при различных вариантах его дальнейшего течения» Ревматология, 1988, №2, стр. 3–16
21. Van der Hejde D.M. “How to read radiographs to the Sharp/van der Hejde method.” J. Rheum., 1999, 26:743–745
Источник