Ревматоидный артрит это насонова
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
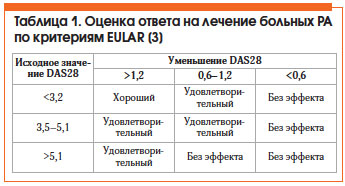
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
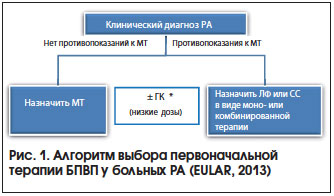
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
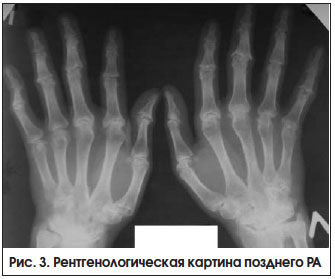
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
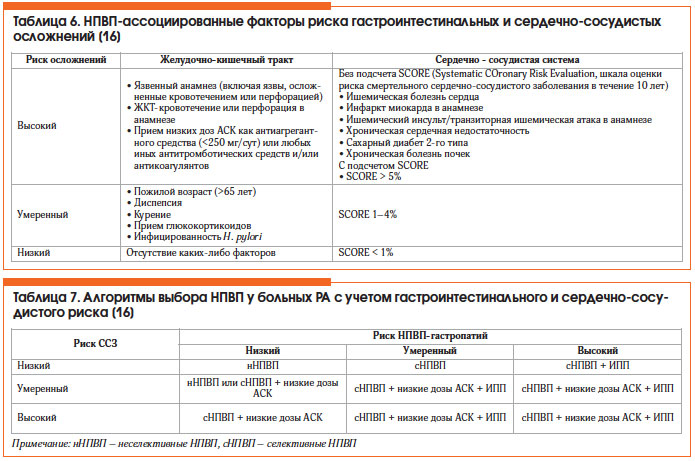
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
Ревматоидный артрит (РА) – наиболее частое воспалительное заболевание суставов, распространенность которого в популяции около 1%, а экономические потери от РА для общества сопоставимы с ишемической болезнью сердца. Через 20 лет от начала болезни примерно 90% пациентов в большей или меньшей степени теряют трудоспособность, а треть становятся полными инвалидами. Жизненный прогноз у пациентов РА столь же неблагоприятен, как и при лимфогранулематозе, инсулин–зависимом сахарном диабете и трехсосудистом поражении коронарных артерий (рис. 1). Увеличение смертности во многом обусловлено нарастанием частоты сопутствующих заболеваний (инфекции, поражение сердечно–сосудистой системы и почек, остеопоретические переломы и др.), развитие которых патогенетически связано с плохо контролируемыми ревматоидным воспалением и дефектами иммунитета.
Рис. 1. Ревматоидный артрит: общие сведения
В последние годы в лечении РА достигнуты существенные успехи. С помощью современных базисных противоревматических препаратов (метоторексат, лефлюномид и др.) и особенно «биологических» агентов (например, моноклональных антител к фактору некроза опухоли–a – Ремикейд) у многих пациентов удается достигнуть существенного снижения активности заболевания (70% «ответа» по критериям Американской коллегии ревматологов – АКР) и в целом улучшить прогноз болезни. Тем не менее фармакотерапия этого заболевания остается одной из наиболее сложных проблем медицины, а возможность полного «излечения» пациентов представляется сомнительной. Это объясняется многими причинами (рис. 2).
Рис. 2. Трудности лечения ревматоидного артрита
РА – чрезвычайно гетерогенное заболевание, основу патогенеза которого составляет сложное, плохо изученное сочетание генетически детерминированных и приобретенных дефектов («дисбаланс») нормальных (иммуно)регуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные, а нередко и физиологические стимулы [1] (рис. 3). Это определяет чрезвычайное разнообразие клинических, патологических и иммунологических проявлений, сочетание которых делает РА более похожим на клинико–иммунологический синдром. Кроме того, несмотря на интенсивные исследования, РА по–прежнему остается заболеванием с неизвестной этиологией. Более того, есть веские основания предполагать, что даже если удастся доказать роль какого–либо инфекционного агента в развитии некоторых форм РА, его элиминация с помощью антибактериальных или противовирусных препаратов (и даже вакцинации) вряд ли позволит «излечить» заболевание. Это связано с тем, что потенциальный этиологический фактор вероятней всего принимает не прямое, а опосредованное участие в развитии болезни, например, путем активации иммунопатологического процесса, за счет «молекулярной» мимикрии или каких–либо других неизвестных механизмов. Предполагается, что самый ранний этап иммунопатогенеза РА определяется не специфическим иммунным распознаванием «артритогенного» (инфекционного?) агента, а связан с «неспецифической» воспалительной реакцией, индуцированной различными стимулами, которая в дальнейшем индуцирует аберантную реакцию синовиальных клеток у генетически предрасположенных индивидуумов. Затем в результате «рекрутирования» иммунных клеток (Т– и В–лимфоциты, дендритные клетки) в полости сустава происходит формирование как бы «эктопического» лимфоидного органа, клетки которого запускают синтез аутоантител к компонентам синовиальной оболочки. Аутоантитела, наряду с активированными Т–лимфоцитами, еще больше усиливают (амплифицицируют) воспалительную реакцию, вызывающую прогрессирующее повреждение суставных тканей. В недавних исследованиях было убедительно показано, что не только ревматоидный фактор, но и аутоантитела с другой специфичностью (например, к цитрулинированным пептидам, глюкозо–6–фосфат изомеразе) могут играть важную роль в иммунопатогенезе РА.
Рис. 3. Патогенез ревматоидного артрита
Почему необходима «ранняя» диагностика ревматоидного артрита?
Имеются данные о том, что «субклинически» текущий иммунопатологический процесс развивается задолго до появления клинически очевидных признаков артрита. Действительно, по данным биопсии синовиальной оболочки суставов признаки хронического синовита выявляются уже в самом начале болезни даже в клинически не пораженных суставах. У двух третей пациентов структурные изменения (эрозии) суставов обнаруживаются уже в течение первых двух лет с момента появления болезни (рис. 4). Уже в самом начале «вклад» структурных повреждений в показатель «потеря трудоспособности» весьма значителен (около 25%) и в дальнейшем неуклонно нарастает с развитием болезни (рис. 5). Доказано, что предотвращение структурных повреждений на ранних стадиях заболевания способствует сохранению функциональной активности пациентов в долговременной перспективе. Однако промежуток времени, в течение которого даже самая активная противовоспалительная терапия может эффективно затормозить прогрессирование поражения суставов, весьма короткий и иногда составляет всего несколько месяцев от начала болезни [2,3]. Все это вместе взятое свидетельствует о том, что РА является ярким примером заболеваний, при которых отдаленный прогноз во многом зависит от того, насколько рано удается поставить диагноз и начать активную фармакотерапию. В этом отношении РА в определенной степени напоминает другие хронические заболевания, такие как сахарный диабет и артериальная гипертензия [4] (рис. 6). Однако между этими заболеваниями и РА имеются и существенные различия. Если «ранняя» диагностика артериальной гипертензии и сахарного диабета в подавляющем большинстве случаев не представляет трудностей, поскольку основывается на оценке хорошо известных врачам клинических проявлений и использовании доступных лабораторных и инструментальных методов, то диагностика РА в дебюте болезни является значительно более трудной (иногда неразрешимой) задачей. Это связано с рядом объективных и субъективных обстоятельств. Во–первых, симптомы «раннего» РА часто не специфичны и могут наблюдаться при чрезвычайно широком круге как ревматических, так и неревматических заболеваний (рис. 7). При этом общепринятые классификационные критерии «достоверного» РА не подходят для ранней постановки диагноза. Во–вторых, для диагностики РА требуются специальные знания и навыки в отношении оценки клинических и рентгенологических признаков поражения суставов, а также интерпретации лабораторных (иммунологических) тестов, с которыми плохо знакомы врачи общей практики. По оценке зарубежных исследователей, «не ревматологи» значительно реже (и позже), чем ревматологи ставят диагноз РА и назначают эффективные «базисные» противоревматические препараты. Пациенты РА, наблюдающиеся у ревматологов, имеют лучший функциональный статус и более высокое «качество жизни» на протяжении всего периода болезни. Наконец, лечение новыми эффективными противоревматическими препаратами может осуществляться только ревматологами, поскольку требуют специальных знаний для обеспечения максимальной эффективности и безопасности терапии. Все это вместе взятое подчеркивает необходимость всемерного развития специализированной ревматологической помощи, созданной в нашей стране более 40 лет назад.
Имеются данные о том, что «субклинически» текущий иммунопатологический процесс развивается задолго до появления клинически очевидных признаков артрита. Действительно, по данным биопсии синовиальной оболочки суставов признаки хронического синовита выявляются уже в самом начале болезни даже в клинически не пораженных суставах. У двух третей пациентов структурные изменения (эрозии) суставов обнаруживаются уже в течение первых двух лет с момента появления болезни (рис. 4). Уже в самом начале «вклад» структурных повреждений в показатель «потеря трудоспособности» весьма значителен (около 25%) и в дальнейшем неуклонно нарастает с развитием болезни (рис. 5). Доказано, что предотвращение структурных повреждений на ранних стадиях заболевания способствует сохранению функциональной активности пациентов в долговременной перспективе. Однако промежуток времени, в течение которого даже самая активная противовоспалительная терапия может эффективно затормозить прогрессирование поражения суставов, весьма короткий и иногда составляет всего несколько месяцев от начала болезни [2,3]. Все это вместе взятое свидетельствует о том, что РА является ярким примером заболеваний, при которых отдаленный прогноз во многом зависит от того, насколько рано удается поставить диагноз и начать активную фармакотерапию. В этом отношении РА в определенной степени напоминает другие хронические заболевания, такие как сахарный диабет и артериальная гипертензия [4] (рис. 6). Однако между этими заболеваниями и РА имеются и существенные различия. Если «ранняя» диагностика артериальной гипертензии и сахарного диабета в подавляющем большинстве случаев не представляет трудностей, поскольку основывается на оценке хорошо известных врачам клинических проявлений и использовании доступных лабораторных и инструментальных методов, то диагностика РА в дебюте болезни является значительно более трудной (иногда неразрешимой) задачей. Это связано с рядом объективных и субъективных обстоятельств. Во–первых, симптомы «раннего» РА часто не специфичны и могут наблюдаться при чрезвычайно широком круге как ревматических, так и неревматических заболеваний (рис. 7). При этом общепринятые классификационные критерии «достоверного» РА не подходят для ранней постановки диагноза. Во–вторых, для диагностики РА требуются специальные знания и навыки в отношении оценки клинических и рентгенологических признаков поражения суставов, а также интерпретации лабораторных (иммунологических) тестов, с которыми плохо знакомы врачи общей практики. По оценке зарубежных исследователей, «не ревматологи» значительно реже (и позже), чем ревматологи ставят диагноз РА и назначают эффективные «базисные» противоревматические препараты. Пациенты РА, наблюдающиеся у ревматологов, имеют лучший функциональный статус и более высокое «качество жизни» на протяжении всего периода болезни. Наконец, лечение новыми эффективными противоревматическими препаратами может осуществляться только ревматологами, поскольку требуют специальных знаний для обеспечения максимальной эффективности и безопасности терапии. Все это вместе взятое подчеркивает необходимость всемерного развития специализированной ревматологической помощи, созданной в нашей стране более 40 лет назад.
Рис. 4. Признаки прогрессирования ревматоидного артрита
Рис. 5. Связь между рентгенологическим повреждением суставов и функциональной недостаточностью
Рис. 6. Ревматоидный артрит, сахарный диабет и артериальная гипертензия: сравнительный анализ
Рис. 7. Заболевания, с которыми необходимо дифференцировать «ранний» ревматоидный артрит
Таким образом, одна из причин неблагоприятного прогноза при РА – длительный период времени между началом болезни и поступлением пациента под наблюдение ревматолога, который может, уточнив диагноз, назначить адекватную терапию. Учитывая высокую частоту РА (как и других заболеваний опорно–двигательного аппарата) в популяции, очевидно, что одним из важных факторов, который может способствовать улучшению прогноза у пациентов РА – активное выявление этого заболевания на поликлиническом этапе врачами общей практики. Группа авторитетных европейских и американских ревматологов разработала алгоритм, цель которого создать условия для более активного выявления пациентов с «ранним» РА на поликлиническом этапе [5] (рис. 8). В качестве диагностического признака «раннего» РА (а также показателя «активности» болезни) предлагается учитывать длительность утренней скованности (более 30 мин). Напомним, что длительность «утренней скованности» более 60 минут (на протяжении 6 недель) является диагностическим критерием «достоверного» РА, а при невоспалительных заболеваниях суставов она не должна превышать 30 мин. При осмотре пациентов следует оценить тест «сжатия» пястно–фаланговых и плюсне–фаланговых суставов, положительные результаты которого отражают наличие воспаления суставов. Следует принимать во внимание, что быстрое прогрессирование поражения суставов более вероятно при наличии высоких титров ревматоидного фактора (РФ), увеличении СОЭ и С–реактивного белка. Однако поскольку эти показатели на очень ранней стадии болезни часто находятся в пределах нормы, отрицательные результаты лабораторных тестов не исключают диагноз РА, равно как и необходимость направления пациентов на консультацию к ревматологу.
Рис. 8. Показания для консультации у ревматолога пациента с подозрением на ранний ревматоидлный артрит
Почему при ревматоидном артрите необходима ранняя базисная терапия
Ранее считалось, что лечение РА должно начинаться с «монотерапии» НПВП, а назначение «базисных» противоревматических препаратов следует зарезервировать за пациентами, «не отвечающими» на эти препараты. Это положение основывалось главным образом на представлении о том, что РА – «доброкачественное» заболевание, а лечение НПВП более безопасно, чем «базисными» противоревматическими препаратами, токсичность которых превосходит «пользу» от их назначения. Однако в настоящее время убедительно доказано, что «монотерапия» НПВП ассоциируется с высокой частотой побочных эффектов (в первую очередь, со стороны ЖКТ). Кроме того, НПВП обладают только симптоматическим действием, не влияя на прогрессирование болезни. Фактически по частоте и выраженности побочных эффектов каких–либо различий между НПВП и «базисными» противоревматическими препаратами не отмечено. Более того, результаты плацебо–контролируемых исследований свидетельствуют о том, что назначение в ранний период болезни даже наименее эффективных «базисных» противоревматических препаратов (пероральные препараты золота и гидроксихлорохин) и особенно сульфасалазина позволяет уменьшить выраженность клинических проявлений и улучшить функциональное состояние пациентов [7] (рис. 9). Важно, что пациенты, длительно страдающие РА, значительно хуже «отвечают» на «базисные» противоревматические препараты, чем пациенты, получавшие эту терапию, начиная с ранней стадии болезни.
Ранее считалось, что лечение РА должно начинаться с «монотерапии» НПВП, а назначение «базисных» противоревматических препаратов следует зарезервировать за пациентами, «не отвечающими» на эти препараты. Это положение основывалось главным образом на представлении о том, что РА – «доброкачественное» заболевание, а лечение НПВП более безопасно, чем «базисными» противоревматическими препаратами, токсичность которых превосходит «пользу» от их назначения. Однако в настоящее время убедительно доказано, что (в первую очередь, со стороны ЖКТ). Кроме того, НПВП обладают только симптоматическим действием, не влияя на прогрессирование болезни. Фактически по частоте и выраженности побочных эффектов каких–либо различий между НПВП и «базисными» противоревматическими препаратами не отмечено. Более того, результаты плацебо–контролируемых исследований свидетельствуют о том, что назначение в ранний период болезни даже наименее эффективных «базисных» противоревматических препаратов (пероральные препараты золота и гидроксихлорохин) и особенно сульфасалазина позволяет [7] (рис. 9). Важно, что пациенты, длительно страдающие РА, значительно хуже «отвечают» на «базисные» противоревматические препараты, чем пациенты, получавшие эту терапию, начиная с ранней стадии болезни.
Рис. 9. Преимущества раннего назначения базисной терапии при ревматоидном артрите
Принципиальное значение имеют данные, касающиеся влияния базисной терапии на жизненный прогноз пациентов РА. Оказалось, что у тех из них, которые получали адекватную «базисную» терапию на протяжении всего периода болезни, продолжительность жизни достоверно выше (практически не отличается от популяционной), чем у пациентов, которые в силу различных причин не принимали базисные препараты или принимали их эпизодически. Примечательно, что эффективное лечение метотрексатом (но не другими базисными препаратами) позволяет существенно снизить кардиоваскулярную летальность у пациентов РА, которая является одной из основных причин уменьшения продолжительности жизни.
Таким образом, результаты клинических исследований, во многом базирующихся на опыте работы специализированных клиник, куда госпитализируются больные с подозрением на «ранний» РА, организованных в середине 90–х годов в ряде стран Западной Европы, свидетельствует о том, что раннее активное лечение больных РА позволяет снизить риск ранней инвалидизации и улучшить отдаленный прогноз болезни. Хотя исследования в этом направлении еще только разворачиваются, имеющиеся данные со всей очевидностью свидетельствуют о насущной необходимости скорейшего внедрения концепции «ранняя диагностика–ранняя терапия» и в нашей стране.
Литература:
1. El–Gabalawy H.D., Lipsky P.E. Why do we not have a cure for rheumatoid arthritis? Arthritis Rheum., 2002:4 (suppl 3):S297–S301
2. O`Dell. Treating rheumatoid arthritis early: a window of opportunity? Arthritis Rheum., 2002;46:283–185
3. Scott D.L. The diagnosis and prognosis of early arthritis: rationale for new prognostic criteria. Arthritis Rheum., 2002; 46: 286–290
4. Pincus T., Gibofsky A., Weinblatt M.E. Urgent care and tight control of rheumatoid arthritis as in diabetes and hypertension: better treatment but shortage of rheumatology. Arthritis Rheum., 2002; 46: 851–854.
5. Emery P., Breedveld F.C., Dougados M., et al. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide. Ann. Rheum. Dis., 2002; 61: 290–297.
6. Quinn M.A., Conaghan P.G., Emery P. The therapeutic approach of early intervention for rheumatoid arthritis: what is the evidence? Rheumatology 2001;40:1211–1220
Источник


