Ревматоидный артрит консилиум медикум
- Журналы
- Consilium Medicum и приложения
- Consilium Medicum
- Consilium Medicum №02 2007
Применение инфликсимаба при лечении ревматоидного артрита
Автор:Е.С.Жугрова, В.И.Мазуров, В.В.Рассохин, Е.В.Завьялкина
Номера страниц в выпуске:21-23
Для цитированияСкрыть список
Е.С.Жугрова, В.И.Мазуров, В.В.Рассохин, Е.В.Завьялкина . Применение инфликсимаба при лечении ревматоидного артрита. Consilium Medicum. 2007; 2: 21-23
Ревматоидный артрит (РА) является хроническим аутоиммунным системным заболеванием с преимущественным поражением периферических суставов эрозивно-деструктивного характера, распространенность которого в популяции составляет 0,6-1,6% [1, 2]. РА поражает лиц трудоспособного возраста, ведет к ранней инвалидизации и прогрессирующему снижению функциональной способности суставов [3].
В настоящее время важная роль в патогенезе заболевания отводится дисбалансу провоспалительных и антивоспалительных цитокинов [7, 8]. Установлено, что при РА в тканях суставов продуцируется избыточное количество цитокинов макрофагального происхождения (фактор некроза опухолей-a — ФНО-a, интерлейкин-1 — ИЛ-1, ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор) при минимальной выработке Т-клеточных цитокинов (ИЛ-2, ИЛ-3, ИЛ-4, g-интерферон) [9]. Согласно современным представлениям провоспалительными цитокинами, прежде всего ФНО-a, обусловлены основные проявления заболевания, в том числе хронический синовит, деструктивные поражения хряща и кости [10-12]. Биологическая активность ФНО-a опосредуется связыванием со специфическими рецепторами, экспрессированными на разных клетках, в том числе на нейтрофильных лейкоцитах, эндотелиоцитах, фибробластах, кератиноцитах и др. ФНО-a запускает механизм активации факторов транскрипции (NF-kB, АР-1, JNK и др.), которые в свою очередь регулируют активность генов, кодирующих синтез провоспалительных цитокинов и других медиаторов воспаления, и индуцируют программированную гибель клеток (апоптоз) [13]. Универсальная роль ФНО-a в патогенезе воспаления послужила основанием для изучения эффективности блокаторов этого цитокина в лечении различных заболеваний иммунной природы.
Большинство исследователей считают, что основными направлениями в лечении РА являются уменьшение боли и скованности в суставах, достижение контроля над воспалением, сохранение способности пациента выполнять соответствующий объем повседневной нагрузки и работы, предупреждение деструкции суставов. Своевременное назначение адекватной терапии способствует не только уменьшению выраженности симптомов заболевания, но и замедлению прогрессирования РА. Достижение ремиссии является основной целью в выборе тактики лечения больных РА. Следует обратить внимание на то, что критериями ремиссии РА являются отсутствие воспалительной боли в суставах (боль механического характера не учитывается), утренней скованности, слабости, объективных признаков синовита, прогрессирования структурного повреждения суставов по данным рентгенографии (магнитно-резонансной томографии — МРТ, допплеровского ультразвукового исследования), повышения СОЭ и уровня С-реактивного белка [7].
Однако несмотря на современные принципы лечения у 23% пациентов не удается достигнуть клинического улучшения течения РА. Применяемые базисные противовоспалительные препараты (БПВП) не всегда контролируют активность заболевания и нередко вызывают побочные эффекты. В связи с этим продолжается поиск наиболее эффективных препаратов, обладающих способностью улучшать течение РА [3,4].
Таблица 1. Динамика клинических показателей
| Показатель | Год | |||||
| 1993 | 1994 | 1996 | 2002 | 2004 | 2007 | |
| ВАШ боль, мм | 87 | 93 | 85 | 96 | 10 | 5 |
| ВАШ оценки активности заболевания пациентом, мм | 79 | 76 | 68 | 91 | 6 | 4 |
| Утренняя скованность, мин | 120 | 240 | 180 | 240 | 30 | |
| DAS28 | 5,6 | 5,7 | 5,4 | 6,2 | 2,8 | 1,2 |
Таблица 2. Динамика лабораторных показателей
| Показатель | Норма | Год | |||||
| 1993 | 1994 | 1996 | 2002 | 2004 | 2007 | ||
| СОЭ, мм/ч | 10-12 | 45 | 36 | 47 | 50 | 12 | 5 |
| IgA, г/л | 0,7-4,0 | 0,9 | 0,9 | 2,1 | 3,2 | 2,6 | 2,7 |
| IgM, г/л | 0,4-2,4 | 3,6 | 4,5 | 2,8 | 4,8 | 0,5 | 0,6 |
| IgG, г/л | 7,0-16,0 | 18 | 18,4 | 19 | 19,1 | 14,0 | 12,4 |
| ЦИК, усл. ед. | 50,0-100,0 | 340 | 320 | 288 | 360 | 82 | 68 |
| РФ, мг/л | 0-8,0 | 120 | 135 | 142 | 180 | 5 | 4 |
Моноклональные антитела к ФНО-a (Infliximab).

Начало ХХI века ознаменовалось внедрением в клиническую практику нового класса БПВП, так называемых биологических препаратов [3, 4]. Одним из представителей данной группы является инфликсимаб (ИНФ).
Инфликсимаб — это селективный антагонист ФНО-a, представляет собой химерные моноклональные IgG1k-антитела, которые получают генно-инженерным методом. Они на 75% состоят из человеческого белка и на 25% — из мышиного. Мышиный фрагмент соединяется с растворимым и связанным с мембранами ФНО-a, а человеческий фрагмент обеспечивает эффекторные функции препарата (см. рисунок).
Первоначальная разовая доза ИНФ для внутривенного введения больным РА составляет 3 мг/кг. Затем препарат вводят в той же дозе через 2 и 6 нед после первого введения и далее через каждые 8 нед. Препарат вводится внутривенно капельно в течение не менее 2 ч, скорость введения составляет не более 2 мл в 1 мин. Используются инфузионные системы со встроенным стерильным апирогенным фильтром, обладающим низкой белковосвязывающей активностью [14].
Наибольшая продолжительность терапии инфликсимабом, которая известна на данный момент, колеблется от 7 лет (при болезни Крона) до 1 года (при язвенном колите). Самая длительная терапия РА составляет 4 года. В данной публикации мы хотели бы привести описание клинического случая успешного использования инфликсимаба в течение 5-летнего срока [15-20].
Больная Л., 49 лет, наблюдается в клинике терапии №1 им. Э.Э.Эйхвальда Санкт-Петербургской медицинской академии последипломного образования с 1993 г. При первом поступлении пациентка предъявляла жалобы на боль и отечность мелких суставов кистей, коленных суставов, слабость, повышение температуры до 37-38°С, утреннюю скованность до 3 ч. В анализах крови отмечались гипохромная анемия, тромбоцитоз, СОЭ 45 мм/ч, повышение уровня IgM до 3,6 г/л (N 0,4-2,4), IgG — до 18 г/л (норма 7,0-16,0), циркулирующий иммунный комплекс (ЦИК) — до 340 усл. ед. (норма 50,0-100,0 усл. ед.), ревматоидный фактор (РФ) 120 IU/ml (латексный метод до 8), С-реактивный белок — до 30 мг/л (норма 0-6 мг/л), рентгенологически околосуставный остеопороз, суставные щели неравномерно сужены, эрозии суставов кистей.
На основании клинических и лабораторных показателей был установлен диагноз «серопозитивный ревматоидный полиартрит с системными проявлениями (анемия, амиотрофия), активность 3-й степени, стадия 2. ФНС 2». В качестве базисной терапии был назначен метотрексат в дозе 7,5 мг/нед с последующим увеличением дозы до 12,5 мг/нед. Через 12 мес терапии метотрексатом появились боли в правом подреберье, повышение уровней трансаминаз, что послужило поводом для отмены метотрексата. В 1994 г. больная была переведена на циклофосфамид в дозе 150 мг/сут, который принимала до 1996 г. На фоне проводимой терапии в 1996 г. у больной развился геморрагический цистит, в связи с чем циклофосфамид был отменен. С 1996 г. в комплексную терапию РА были включены глюкокортикостероиды — метипред в дозе 4-8 мг/сут. Несмотря на получаемую терапию, суставной синдром прогрессировал. В 2001 г. в связи с высокой клинико-иммунологической активностью проводилась пульс-терапия метипредом 3000 мг на курс. Однако эффект был нестойким, сохранялась высокая клинико-лабораторная активность заболевания и в 2002 г. была начата антицитокиновая терапия ИНФ в дозе 3 мг/кг по схеме. После 3-й инфузии ИНФ наблюдалось клиническое улучшение, которое выражалось в уменьшении болей и отечности пораженных суставов, улучшении общего самочувствия, снижении показателей лабораторной активности. На 24-й неделе лечения отмечалось значительное улучшение состояния, уменьшение болей в суставах согласно шкале ВАШ с 85 до 12 мм, исчезла утренняя скованность, нормализовались лабораторные показатели, снизился комплексный показатель активности РА DAS28<2,4.
С 2004 г. в связи со стойким положительным клинико-лабораторным эффектом решался вопрос о назначении базисной терапии циклофосфамида с отменой ИНФ. Однако при назначение терапии БПВП у больной возобновились явления геморрагического цистита, что послужило поводом для отмены БПВП и назначения монотерапии ИНФ с увеличением промежутков между введениями. В связи с этим больной была продолжена монотерапия ИНФ, но с промежутками между инфузиями не более 12 нед. На фоне данной терапии достигнуто 70% улучшение РА согласно критериям ACR, индекс DAS28<1,6, что соответствует ремиссии заболевания (по критериям Американской ревматологической ассоциации).
Таким образом, включение ИНФ в комплексное лечение больной способствовало значительному увеличению эффективности проводимой терапии с индукцией ремиссии РА, привело к значимому клиническому улучшению, увеличению функциональных возможностей суставов.
Список исп. литературыСкрыть список
1. Мазуров В.И. Ревматоидный артрит (клиника, диагностика, лечение). В.И.Мазуров, А.М.Лила. СПб.: Мед Масс Медиа, 2000.
2. Pincus T, Ferraccioli G, Sokka T et al. Evidence from clinical trials and long-term observational studies that disease-modifying anti-rheumatic drugs slow radiographic progression in rheumatoid arthritis: updating a 1983 review. Rheumatology (Oxford) 2002; 41: 1346-56.
3. Hurst S, Kallan MJ, Wolfe FJ et al. Methotrexate, hydroxychloroquine, and intramuscular gold in rheumatoid arthritis: relative area under the curve effectiveness and sequence effects. J Rheumatol 2002; 29: 1639-45.
4. Aletaha D, Smolen JS. The rheumatoid arthritis patient in the clinic: comparing more than 1,300 consecutive DMARD courses. Rheumatology (Oxford) 2002; 41: 1367-74.
5. Zink A, Listing J, Kary S et al. Treatment continuation in patients receiving biological agents or conventional DMARD therapy. Ann Rheum Dis 2005; 64: 1274-9.
6. Aletaha D, Smolen JS. Effectiveness profiles and dose dependent retention of traditional disease modifying antirheumatic drugs for rheumatoid arthritis. An observational study. J Rheumatol 2002; 29: 1631-8.
7. Dinarello CA, Moldawer LL. Proinflammatory and antiinflammatory cytokines in rheumatoid arthritis. A primer for clinicians/2nd ed. Amgen Inc., 2000.
8. Feldman M, Brennan F, Maini RN. Ann Rev Immunol 1996; 14: 397-440.
9. Endresh S, Ghorbani R, Lonnemann G et al. Clin Immunol Immunopathol 1988; 49 (3).
10. Endresh S, Ghorbani R, Lonnemann G et al. Clin Immunol Immunopathol 1988; 49 (3).
11. Kahaleh M, Smirh E, Leroy E. Clin Immunol Immunopathol 1992; 2: 261-72.
12. McCarthy ET, Sharma R, Sharma M. Amer Soc Nephr 1998; 3: 434-8.
13. Bazzoni F, Beutler B. N Engl J Med 1996; 334: 1717-25.
14. Bettier BA. The role of tum necrosis factor in health and disease. Rheum 1999; 26 (suppl. 57): 16-21.
15. Rutgeerts et al. Aliment Pharmacol Ther, 2006; 23: 451-463
16. Vander Cruyssen et al. EULAR 2006: FRI0206
17. Baraliakos et al. EULAR 2006: THU0295
18. Я Epagelis et al. EULAR 2006: AB0312
19. Я Reich et al. British Journal of Dermatology 2006: e-pub DOI 10.1111/j.1365-2133.2006.07237.x
20. Rutgeerts et al. N Engl J Med, 2005; 353: 2462-76).
1 февраля 2007
Количество просмотров: 528
Источник
- Журналы
- Consilium Medicum и приложения
- Consilium Medicum
- Consilium Medicum №09 2001
Ювенильный ревматоидный артрит
Автор:Д. Уоллис, А. Метцгер, Р. Эшман
Номера страниц в выпуске:425-426
Для цитированияСкрыть список
Д. Уоллис, А. Метцгер, Р. Эшман. Ювенильный ревматоидный артрит. Consilium Medicum. 2001; 09: 425-426
А. Клиническая картина. Ювенильный ревматоидный артрит начинается в возрасте до 16 лет. Для него характерны следующие признаки: 1) асимметричность поражения; 2) раннее вовлечение крупных суставов; 3) поражение одного или нескольких суставов; 4) отсутствие связи между наличием системных проявлений и тяжестью поражения суставов; 5) редкое выявление ревматоидного фактора. В зависимости от клинической картины можно выделить три основные формы ювенильного ревматоидного артрита (см. таблицу): 1) синдром Стилла (характеризуется поражением внутренних органов); 2) олигоартрит; 3) полиартрит. Заболевание, подобное синдрому Стилла, может впервые возникнуть и в более позднем возрасте.
Б. Лабораторные исследования. Результаты лабораторных исследований, проведенных во время обострения заболевания, свидетельствуют об остром воспалении. Однако у многих больных, несмотря на клинические признаки обострения, СОЭ остается нормальной. У 15% больных в сыворотке выявляется ревматоидный фактор, что свидетельствует о неблагоприятном прогнозе заболевания. Антинуклеарные антитела выявляются в основном у больных с хроническим передним увеитом и изредка у больных с серонегативным полиартритом. В последнем случае, несмотря на отсутствие ревматоидного фактора, в сыворотке больных нередко обнаруживаются IgG к IgМ. У носителей гена HLA-B27 ювенильный ревматоидный артрит обычно проявляется олигоартритом с сакроилеитом (в большинстве случаев это наблюдается у мальчиков). С возрастом у них может развиться анкилозирующий спондилит.
В. Лечение
1. Аспирин – средство выбора на раннем этапе лечения. Начальная доза – 80 мг/кг/сут внутрь в несколько приемов. При сохранении высокой лихорадки и боли в суставах дозу увеличивают до 120 мг/кг/сут. При подборе дозы препарата иногда оценивают концентрацию салицилата в сыворотке (терапевтическая концентрация – 20–30 мг%). Для оценки токсического действия у детей этот показатель ненадежен. Поскольку у детей аспирин оказывает гепатотоксическое действие чаще, чем у взрослых, каждые полгода, а также при появлении симптомов поражения печени определяют активность АсАТ и АлАТ и уровень билирубина в сыворотке.
2. Среди других НПВП эффективны толметин, напроксен и ибупрофен. Эффективность остальных препаратов этой группы при ювенильном ревматоидном артрите недостаточно изучена. Индометацин не применяется из-за выраженного гепатотоксического действия.
3. Кортикостероиды. Поскольку кортикостероиды вызывают нарушение роста, они редко применяются при ювенильном ревматоидном артрите. Короткие курсы кортикостероидов назначают только при переднем увеите и высокой лихорадке, когда аспирин неэффективен. Иногда эффективны препараты золота (1мг/кг/мес внутрь), однако они часто вызывают сыпь, протеинурию и угнетение кроветворения. По данным ряда авторов, при ювенильном ревматоидном артрите более безопасны метотрексат, сульфасалазин и гидроксихлорохин, однако их эффективность ниже, чем при ревматоидном артрите.
Г. Прогноз. Ювенильный ревматоидный артрит – хроническое прогрессирующее заболевание, протекающее с обострениями и ремиссиями. У большинства больных серонегативным ювенильным ревматоидным артритом прогрессирование заболевания прекращается в юношеском возрасте.
Формы ювенильного ревматоидного артрита
Варианты течения | Частота, % | Характерные симптомы | Лабораторные признаки | Прогноз |
Синдром Стилла (начинается с общих симптомов) | 20 | Лихорадка, озноб, сыпь, миалгия, боль в животе, увеличение лимфоузлов, серозиты, позднее присоединяется артрит | Анемия, лейкоцитоз, нарушение биохимических показателей функции печени, антинуклеарные антитела и ревматоидный фактор отсутствуют | Часто имеет хроническое, прогрессирующее течение, в 30% случаев заболевание приводит к инвалидизации |
Олигоартрит (поражается не более 4 суставов) | 35 | Артрит коленных, голеностопных, локтевых, межфаланговых суставов | При хроническом переднем увеите антинуклеарные антитела выявляются в 90%, у остальных – в 30% случаев | Деструкция суставных хрящей, не приводящая к инвалидизации |
с сакроилеитом (чаще болеют мальчики) | 15 | Сакроилеит, спондилит, поражение тазобедренных и коленных суставов, острый передний увеит, аортит | Повышена частота выявления антигена HLA-В27 | Течение и прогноз непредсказуемы |
с преимущественным поражением периферических суставов (чаще болеют девочки) | 20 | Тазобедренные и плечевые суставы не поражаются или поражаются на поздней стадии заболевания, у 50% больных наблюдается хронический передний увеит | Частота выявления антигена HLA-В27 не повышена | Не приводит к инвалидизации |
Полиартрит | 45 | Артрит с поражением мелких и крупных суставов, тендовагиниты и периоститы, преждевременное закрытие эпифизарных зон роста, приводящее к низкорослости | У 25% больных выявляется ревматоидный фактор | Часто иммет хроническое прогрессирующее течение |
Серонегативный | 30 | Ревматоидный фактор не выявляется, у 25% больных методом иммунофлюоресценции выявляются антинуклеарные антитела | Примерно у 17% больных приводит к инвалидизации | |
Серопозитивный | 15 (более позднее начало) | Типичные симптомы ревматоидного артрита: ревматоидные узелки, васкулит, тендовагинит, лихорадка и сыпь нехарактерны | Выявляется ревматоидный фактор | Часто быстро прогрессирует, приводя к инвалидизации, и продолжается в зрелом возрасте |
Список исп. литературыСкрыть список
1 сентября 2001
Количество просмотров: 677
Источник
- Журналы
- Consilium Medicum и приложения
- Consilium Medicum
- Consilium Medicum №09 2014
Современные рекомендации по лечению ревматоидного артрита
Автор:Р.М.Балабанова
Номера страниц в выпуске:119-122
Для цитированияСкрыть список
Р.М.Балабанова. Современные рекомендации по лечению ревматоидного артрита. Consilium Medicum. 2014; 09: 119-122
В изучении ревматоидного артрита (РА) в последнее десятилетие отмечается значительный прогресс, что в основном связано с разработкой и внедрением нового класса лекарственных средств – генно-инженерных биологических препаратов (ГИБП), воздействующих на основные звенья иммунопатологических нарушений, характеризующих это заболевание. В 2013 г. Европейской антиревматической лигой (European League Against Rheumatism – EULAR) подготовлены и опубликованы новые рекомендации по лечению РА [1]. Они подробно изложены в отечественной периодике с обсуждением ряда дискуссионных проблем [2].
Классификационные критерии РА
В основе современной стратегии ведения пациентов с РА лежат ранняя диагностика болезни и лечение до достижения цели – ремиссии или низкой активности. Для ранней диагностики РА (рекомендация 1) рекомендуется использовать классификационные критерии РА, разработанные европейскими и американскими ревматологами (критерии ACR/EULAR, 2010) [3]. Для постановки диагноза РА у пациента должно присутствовать 6 баллов из 10 возможных, при этом врач должен выявить у больного хотя бы один припухший сустав при исключении других заболеваний, которые могут сопровождаться воспалением суставов (системная красная волчанка, псориатический, реактивный артрит и др.); табл. 1.
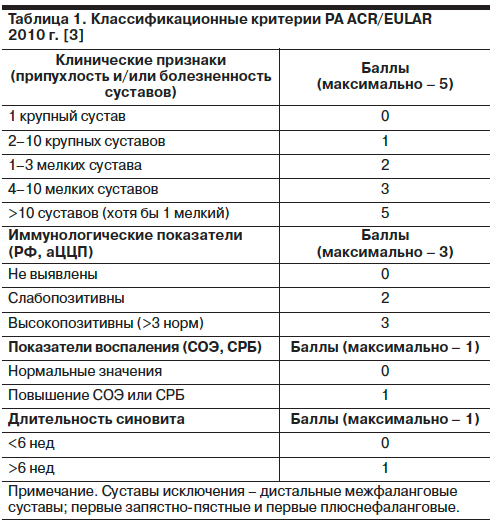
Для верификации диагноза на ранней стадии существенную помощь оказывают ультразвуковое исследование мелких суставов кисти и запястья, магнитно-резонансная томография этих суставов, выявляющие воспаление и деструкцию значительно раньше, чем рентгенологическое обследование, а также исследование синовиальной жидкости и морфология синовии.
Оценка активности РА
Тактика ведения пациентов с РА в первую очередь зависит от активности РА, оцениваемой по клиническим, лабораторным показателям (табл. 2).

Врач при осмотре больного выявляет число болезненных (ЧБС) и припухших суставов (ЧПС) из 28 суставов, включающих проксимальные межфаланговые, пястно-фаланговые, лучезапястные, плечевые, локтевые, коленные. ЧБС и ЧПС входят во все индексы активности и являются объективными показателями. Кроме того, включены такие показатели как оценка активности болезни врачом (ООАВ) и общая оценка активности болезни больным (ООАБ). Из лабораторных показателей С-реактивный белок (СРБ) более информативен, чем скорость оседания эритроцитов (СОЭ), и является лучшим предиктором прогрессирования суставной деструкции. Простой индекс активности болезни (SDAI) суммирует ООАБ, ООАВ, ЧПС, ЧБС, СРБ.
Использование упрощенного по сравнению с индексом DAS 28 индекса активности SDAI основано на том, что этот показатель более строго отражает состояние ремиссии [4]. Следует отметить, что состояние ремиссии легче достичь при раннем РА. В развернутой стадии болезни конечной целью является достижение ее низкой активности.
Лечение до достижения цели – ремиссии или низкой активности (рекомендация 2) – основано на разработке более строгих критериев ремиссии (табл. 3) [5].

Важным фактором для достижения цели является тщательный контроль за эффективностью терапии (рекомендация 3). У пациентов с активным РА мониторинг эффективности следует проводить каждые 1–3 мес, если через 3 мес не наблюдается улучшения и через 6 мес не достигнута цель терапии – ремиссия/низкая активность, то следует модифицировать терапию. Если же цель достигнута, то мониторинг проводится реже – через 6–12 мес.
Стратегия первой линии лечения
«Метотрексат (МТ) следует рассматривать как основной компонент стратегии первой линии лечения активного РА» (рекомендация 4). Механизм действия МТ обусловлен инактивацией фермента дегидрофолатредуктазы, что снижает образование пуринов и тимидилата, необходимых для синтеза ДНК. Антипролиферативное действие МТ проявляется при использовании высоких доз, а противовоспалительное – при низких дозах за счет влияния на аденозиновые рецепторы.
Проведение рандомизированных плацебо-контролируемых исследований продемонстрировало дозозависимость клинического эффекта МТ. При пероральном приеме МТ в дозе 10–25 мг в неделю абсорбция препарата в желудочно-кишечном тракте колеблется от 25 до 100%, а биодоступность – от 28 до 94%. Низкая биодоступность МТ может быть причиной недостаточного эффекта препарата при его пероральном приеме [6].
Ряд исследований показал, что МТ замедляет трансформацию раннего (недифференцированного) артрита в достоверный РА, особенно у позитивных пациентов, имеющих антитела к циклическому цитруллинированному белку (аЦЦП). Через 30 мес РА развился у 30% больных с сохраняющейся активностью процесса, леченных МТ в дозе 15 мг в неделю с последующей эскалацией дозы до 30 мг в неделю, против 53%, получавших плацебо [7].
Усиление эффекта МТ отмечено при добавлении низких доз преднизолона при раннем РА, что подтверждено более быстрым наступлением ремиссии, снижением скорости прогрессирования деструкции суставов, меньшим числом пациентов, у которых потребовалось переключение на комбинированную терапию ингибиторами фактора некроза опухоли или на подкожное введение МТ [8].
В последние годы отмечена тенденция к более широкому использованию парентеральных форм МТ, особенно при необходимости использования высоких доз, что связано с большей биодоступностью и стабильностью МТ, а также накоплением длинных цепей глютаминизированных форм МТ в эритроцитах, что в свою очередь приводит к более выраженному подавлению синтеза пуринов.
Эффективность перехода с перорального приема на подкожное введение МТ доказана в ряде рандомизированных контролируемых исследований. В исследовании, проведенном J.Braun и соавт., пациентам с активным РА, раннее не получавшим МТ, назначали 15 мг в неделю перорально(1-я группа) либо подкожно (2-я группа). Через 16 нед при отсутствии эффекта пациентов 1-й группы переключали на подкожное введение МТ, а во 2-й – повышали дозу до 20 мг в неделю. Через 24 нед ответ по ACR 70 был у 41% больных на подкожном введении МТ и у 33% – при пероральном приеме. Частота умеренных/тяжелых нежелательных явлений была выше у больных на пероральном приеме препарата [9].
Данные о более выраженном эффекте подкожного МТ получены и в других исследованиях. Канадские исследователи сравнили эффект подкожного введения МТ более 20 мг в неделю в качестве первого препарата при раннем РА, пероральной формы МТ с другими синтетическими базисными противовоспалительными препаратами (БПВП). У больных, получавших МТ подкожно, частота ремиссий составила 50% против 31% через 6 мес и 80% против 40% – через 12 мес [10].
Важно отметить, что регулярный длительный прием МТ снижает частоту летальных исходов при РА на 70% [11]. Расширенный анализ роли МТ в лечении РА представлен в работе Е.Л.Насонова и соавт., в которой представлен тщательный анализ отечественных и зарубежных работ по эффективности монотерапии МТ и его комбинаций с БПВП/ГИБП [12].
При наличии противопоказаний для МТ или его ранней непереносимости препаратами первой линии могут быть лефлуномид или сульфасалазин (рекомендация 5). Лечение МТ можно проводить не только в виде монотерапии, но и в комбинации с другими БПВП – сульфасалазином и гидроксихлорохином (рекомендация 6). Возможны как последовательное присоединение этих препаратов, так и начало с «тройной» терапии, которая по эффективности не уступает комбинации МТ с ГИБП [13].
Что касается использования глюкокортикоидов (ГК) при РА, то «в течение первых 6 мес болезни следует рассматривать применение низких (<7,5 мг/сут) доз в комбинации с одним или несколькими БПВП» (рекомендация 7), при этом отмена ГК должна осуществляться как можно быстрее, насколько это возможно с клинической точки зрения. Монотерапия ГК может назначаться только в виде исключения, когда применение всех БПВП и ГИБП противопоказано. Внутрисуставное введение ГК не обсуждается, но их эффективность не вызывает сомнений, следует лишь помнить, что частое введение также может вызвать ГК-зависимость и осложнения, характерные для ГК: артериальную гипертензию, сахарный диабет, остеопороз и др.
При недостаточной эффективности МТ и/или других БПВП (с ГК или без них), особенно при наличии факторов неблагоприятного прогноза (высокая активность, раннее развитие эрозий, высокие показатели ревматоидного фактора – РФ и аЦЦП) следует рассматривать назначение ГИБП (рекомендации 8, 9).
В Российской Федерации зарегистрировано несколько препаратов этого класса – моноклональных антител и рекомбинантнах белков, подавляющих активность важных провоспалительных цитокинов, участвующих в иммуновоспалительных процессах при РА (табл. 4).
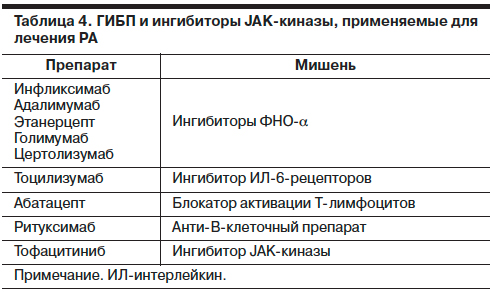
Если в предыдущих рекомендациях советуют начинать терапию с ингибиторов фактора некроза опухоли a (ФНО-а), то в последних таких ограничений нет, поскольку доказаны сходная эффективность и профиль безопасности всех ГИБП. В проведенных исследованиях не было выявлено преимущество монотерапии ГИБП, за исключением тоцилизумаба. Все ГИБП применяются в комбинации с МТ, который повышает эффективность ингибиторов ФНО-а за счет подавления иммуногенности этих моноклональных антител. Ограничением для использования ингибиторов ФНО-а является латентная форма туберкулеза, поэтому перед назначением этой группы ГИБП необходимо тщательное обследование пациента на возможность возникновения или обострения этой инфекции. Противопоказанием служат также вирусные гепатиты В и С, наличие хронических инфекций.
При недостаточной эффективности первого ГИБП следует назначить другой ГИБП. Так при неэффективности первого ингибитора ФНО-а можно перейти на терапию другим ингибитором ФНО-а или ГИБП с другим механизмом действия (рекомендация 10). Здесь важно отметить, что самое главное не столько выбор препарата, сколько соблюдение стратегии терапии РА [14].
Одним из последних препаратов, зарегистрированных в России, является тофацитиниб – ингибитор JAK-киназы, первый синтетический «таргетный» препарат для перорального приема при РА. Эффективность его и безопасность доказаны в ряде рандомизированных плацебо-контролируемых клинических исследований [15]. В клинической практике препарат используется относительно недавно, поэтому требуется накопление данных по его безопасности, учитывая более частое возникновение герпетической и оппортунистической инфекции. Именно поэтому в рекомендациях несколько осторожно указывают, что «при неэффективности ГИБП следует рассмотреть возможность назначения тофацитиниба» (рекомендация 11).
Вопросы, которые остаются с момента внедрения ГИБП в практику, – длительность их применения и возможность отмены. За это время получены результаты исследований, в которых указывается на возможность сохранения ремиссии без ГИБП на фоне терапии МТ, особенно при раннем РА и своевременно начатой патогенетической терапии [16]. При развернутом РА сохранение ремиссии возможно при использовании низких доз ГИБП. Эксперты пришли к заключению, что «у пациентов, находящихся в состоянии ремиссии после отмены ГК, следует рассмотреть возможность прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП» (рекомендация 12).
Относительно БПВП принято решение о целесообразности снижения дозы в случае достижения длительной стойкой ремиссии на основе согласованного решения пациента и врача (рекомендация 13). Отмена БПВП может спровоцировать обострение РА, особенно при развернутом заболевании.
Последняя рекомендация касается подбора терапии с учетом наличия коморбидных заболеваний и безопасности лечения. Известно, что высокая активность РА ассоциируется с повышенным риском кардиоваскулярной патологии; эффективная терапия, особенно МТ, снижает риск развития коморбидности и удлиняет продолжительность жизни пациентов [17]. В то же время чрезмерно активная терапия может привести к осложнениям. Именно поэтому «при подборе терапии необходимо учитывать не только активность РА, но и прогрессирование деструкции суставов, наличие коморбидных заболеваний и безопасность лечения» (рекомендация 14).
Купирование боли при РА
 Рекомендации ACR/EULAR 2013 г. касаются двух групп препаратов – БПВП и ГИБП. Однако основным клиническим симптомом при РА, который заставляет обратиться пациента к врачу, является боль, для ее купирования при любой стадии болезни назначают нестероидные противовоспалительные препараты (НПВП), обладающие обезболивающим и антивоспалительным эффектом, но не влияющие на основной патогенетический процесс – аутоиммунное воспаление и деструкцию суставов. НПВП назначают пациентам в минимально эффективной дозе, дальнейший прием и доза препарата могут варьироваться в зависимости от выраженности боли и воспаления, а также переносимости препарата. При выборе НПВП для каждого больного врач должен учитывать наличие сопутствующих заболеваний: гастропатии, кардиоваскулярные, астмоидные состояния и т.д. К сожалению, эта группа препаратов при высокой клинической эффективности может вызывать достаточно серьезные нежелательные явления, а именно: эрозивный процесс в разных отделах желудочно-кишечного тракта: пищеводе, желудке, кишечнике. НПВП могут способствовать повышению артериального давления, спровоцировать развитие бронхиальной астмы. При мониторинге пациентов, находящихся на патогенетической терапии, необходимо учитывать и влияние НПВП.
Рекомендации ACR/EULAR 2013 г. касаются двух групп препаратов – БПВП и ГИБП. Однако основным клиническим симптомом при РА, который заставляет обратиться пациента к врачу, является боль, для ее купирования при любой стадии болезни назначают нестероидные противовоспалительные препараты (НПВП), обладающие обезболивающим и антивоспалительным эффектом, но не влияющие на основной патогенетический процесс – аутоиммунное воспаление и деструкцию суставов. НПВП назначают пациентам в минимально эффективной дозе, дальнейший прием и доза препарата могут варьироваться в зависимости от выраженности боли и воспаления, а также переносимости препарата. При выборе НПВП для каждого больного врач должен учитывать наличие сопутствующих заболеваний: гастропатии, кардиоваскулярные, астмоидные состояния и т.д. К сожалению, эта группа препаратов при высокой клинической эффективности может вызывать достаточно серьезные нежелательные явления, а именно: эрозивный процесс в разных отделах желудочно-кишечного тракта: пищеводе, желудке, кишечнике. НПВП могут способствовать повышению артериального давления, спровоцировать развитие бронхиальной астмы. При мониторинге пациентов, находящихся на патогенетической терапии, необходимо учитывать и влияние НПВП.
В России одним из наиболее широко применяемых ингибиторов циклооксигеназы 2 является нимесулид (Найз®), анальгетический эффект которого опосредован снижением активности ноцицептивной системы на периферическом и спинальном уровне. Центральная анальгетическая активность нимесулида зависит от ингибиции как циклооксигеназы 2, так и NOS в спинном мозге, что подтверждено подавлением активации рецепторов NMDA (N-метил-D-аспартат-рецепторов) при воспалительной гипералгезии [16]. Преимущество нимесулида обусловлено не только его высоким противовоспалительным и анальгетическим действием, но и возможностью применения у пациентов с так называемой аспириновой астмой, низкой частотой развития осложнений стороны желудочно-кишечного тракта [18].
Таким образом, соблюдение стратегии лечения РА, а именно ранней диагностики и рано начатой патогенетической терапии с тщательным контролем активности болезни позволит улучшить ее прогноз и предупредить инвалидизацию.
Список исп. литературыСкрыть список
1. Smolen JS, Landewe R, Breedveld FC et al. EULAR recomendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs; 2013 update. Ann Rheum Dis 2013. DOI: 10.1136/annrheumdis-2013-204573
2. Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая характеристика и дискуссионные проблемы. Научно-практическая ревматология. 2013; 6 (51): 609–22. DOI:https://dx.doi.org/10.14412/1995-4484-2013-609-22
3. Aletaha D, Neogi T, Silman AJ et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010; 69 (2): 2569–81. DOI:10.1002/art/27584
4. Balsa A, De Miguel E, Castillo C et al. Superiority of SDAI jver DAS 28 in assessment of remission in rheumatoid arthritis hatients using power Doppler ultrasonography as a gold standart. Rheumatology (Oxford) 2010; 49 (4): 683–90. DOI:10.1093/rheumatology/kep442.Epub 2010 Jan 4
5. Felson DT, Smolen JS, Wells G et al. American College of Rheumatology/European League Against Rheumatism provisional definition of remission in rheumatoid arthritis for clinical trials. Arthritis Rheum 2011; 63 (3): 573–86. DOI: 10.1002/art.30129
6. Насонов Е.Л. Лечение ревматоидного артрита 2012: место метотрексата. Научно-практическая ревматология. 2012; 51 (2): 1–24.
7. Van Dongen H, Van Aken J, Lard L et al. Efficacy of methotrexate treatment in patients with probable rheumatoid arthritis: a double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2007; 56 (5): 1424–32. DOI: https://dx.doi.org/10.1002/art.22525
8. Wewers-de Boer K, Visser K, Heimans L et al. Remission induction therapy with methotrexate and prednisolone in patients with early rheumatoid and undifferentiated arthritis. (the IMPROVED study). Ann Rheum Dis 2012; 71 (9): 1472–7. DOI:10.1136/annrheumdos-2011-200736
9. Braun J, Kastner P, Flaxenberg P et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis: results of a six-month, multicenter, randomized, double-blind, controlled, phase IV trial. Arthritis Rheum 2008; 58 (1): 73–81. DOI:10.1002/art.23144
10. Bykerk V, Rowe D, Thorne C et al. Increased remission rates in patients receiving early optimal doses of parenteral methotrexat vs other therapeutic strategies from a nationwade early rheumatoid cohort. Ann Rheum Dis 2010; 69 (Suppl. 3): 65.
11. Wasco MCM, Dasgupta A, Hubert H et al. Propensity-adjusted association of methotrexat with overall survival in rheumatoid arthritis. Arthritis Rheum 2012; 10: 3772.
12. Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Новые рекомендации по лечению ревматоидного артрита (EULAR, 2013): место ?

