Ревматоидный артрит в рамн
Ревматоидный артрит (РА) — иммуновоспалительное ревматическое заболевание неизвестной этиологии. Характеризуется не только развитием хронического эрозивного артрита периферических суставов, но и системным поражением внутренних органов, таких как сердце, почки, легкие, сосуды и др. Несвоевременная диагностика РА приводит к ранней инвалидности и сокращению продолжительности жизни пациентов. РА является частым и одним из наиболее тяжелых иммуновоспалительных заболеваний человека. Соотношение среди заболевших женщин и мужчин – 3:1.
Симптомы
Ранние симптомы заболевания, которые помогут Вам заподозрить развитие РА:
- Утренняя скованность в суставах более 30-60 минут.
- Боль в суставах, болезненность суставов при пальпации и движении.
- Припухлости мягких тканей в области суставов и сухожилий.
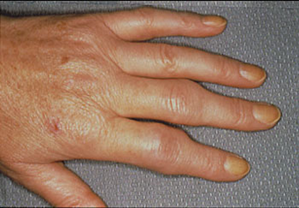
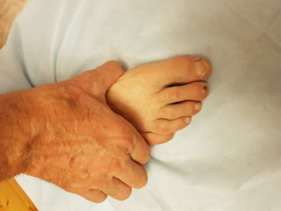
Воспаление суставов проявляется болью, припухлостью и ограничением движений в них. Особенно ярко эти симптомы проявляются утром, после сна. Многие заболевшие жалуются на «утреннюю скованность» в суставах. «Визитной карточкой» ревматоидного артрита считается поражение суставов кистей и стоп, хотя начинаться заболевание может с развития воспаления практически в любом суставе. Боль при рукопожатии (положительный тест поперечного сжатия кисти), невозможность полностью сжать кисть в кулак являются типичными проявлениями воспаления в суставах кистей и служат тревожным сигналом, свидетельствующим о необходимости обращения к ревматологу в ближайшее время.
Диагностика
Правильно и своевременно поставить диагноз, оценить тяжесть заболевания и его прогноз (активность воспаления, функция и деструкция суставов, иммунологические показатели) – задача врача-ревматолога!!! В нашем институте Вы сможете провести подробное обследование с применением иммунологических и инструментальных методов, направленных на раннюю диагностику ревматоидного артрита: рентгенографическое исследование суставов кистей и стоп, магнитно-резонансную томография суставов (которая позволяет выявить изменения еще не видимые на рентгенограммах), ультразвуковое исследование суставов, иммунологический анализ крови (РФ и АЦЦП — которые являются основными диагностическими лабораторными биомаркерами РА), определение СОЭ и СРБ — биомаркеров воспалительного процесса.
Если вовремя поставить диагноз и назначить современное лечение, то болезнь можно контролировать. Люди с таким диагнозом могут жить совершенно нормальной жизнью, работать, завести семью, детей.
Очень важным является своевременное выявление факторов риска неблагоприятного прогноза течения РА:
Наличие у больного АЦЦП и РФ.
Высокая воспалительная активность (высокие показатели СОЭ и СРБ, число припухших и болезненных суставов).
Ранние структурные изменения (выявление эрозий при рентгенологическом исследовании суставов в первые 6 месяцев от начала заболевания).
Наличие тяжелой сопутствующей патологии.
Лечение
Доказанными принципами успешного лечения РА («Лечение до достижения цели») являются:
- немедленное начало активной терапии после установления диагноза;
- активное ведение больного, тщательный контроль врачом-ревматологом его состояния (1 раз в 3-6 месяцев);
- своевременный подбор новой схемы терапии при недостаточной эффективности предыдущей.
В настоящее время врач-ревматолог располагает широким арсеналом высокоэффективных и относительно безопасных лекарственных средств, используемых для лечения РА. Терапия синтетическими базисными противоревматическими препаратами (метотрексат, лефлуномид, сульфасалазин) должна начинаться, как только врачом-ревматологом устанавливается диагноз РА.
Основными целями лечения РА являются:
купирование симптомов заболевания, достижение клинико-лабораторной ремиссии или как минимум низкой активности болезни;
торможение прогрессирования структурных изменений в суставах и соответствующих функциональных нарушений;
улучшение качества жизни больных, сохранение трудоспособности;
предупреждение кардиоваскулярных заболеваний;
предупреждение развития АА-амилоидоза, который приводит к хронической почечной недостаточности.
При недостаточной эффективности БПВТ (сохранение умеренной/высокой активности заболевания), или плохой переносимости БПВТ рекомендовано назначение генно-инженерных биологических препаратов (ГИБП). В нашем учреждении работает государственная система оказания высокотехнологичной медицинской помощи (ВМП), которая позволяет получить лечение новейшими лекарственными препаратами.
Лаборатория ранних артритов специализируется на ранней диагностике и лечении больных с воспалительными заболеваниями периферических суставов, в первую очередь, ревматоидным артритом.
Диагностикой и лечением ревматоидного артрита в ФГБНУ НИИР им. В.А. Насоновой занимаются ведущие специалисты в этой области:
Авдеева Анастасия Сергеевна, к.м.н.
Гриднева Галина Игоревна, к.м.н.
Дыдыкина Ирина Степановна, к.м.н.
Касумова Камаля Авязовна, к.м.н.
Муравьев Юрий Владимирович, д.м.н.
Погожева Елена Юрьевна, к.м.н.
Стребкова Екатерина Александровна, к.м.н.
Шубин Сергей Васильевич, к.м.н.
Запишитесь на приём к специалисту по телефонам: +7 495 109-29-10; +7 495 109-39-99
Источник
Ревматоидный артрит (РА) — это хроническое воспалительное аутоиммунное заболевание с прогрессирующим деструктивным поражением крупных имелких суставов и нередким поражением внутренних органов. Причина возникновения заболевания неизвестна. Страдает ревматоидным артритом по данным разных стран до 1 % населения. Зачастую РА поражает пациентов наиболее трудоспособного возраста — 30-60 лет. При отсутствии лечения РА очень быстро приводит к полной инвалидизации и может стать причиной сокращения продолжительности жизни на 5-10 лет.
Помимо тяжёлого поражения суставов, приводящего к деформации и потери подвижности РА характеризуется поражениями сосудов и внутренних органов (васкулит, амилоидоз и др.), а также быстрым развитием атеросклероза и высокой частотой сердечно-сосудистых катастроф, что отражается в статистике повышенной смертности от сердечно-сосудистых заболеваний по сравнению с популяцией. В основе механизма развития заболевания лежит изменение активности многих иммунных клеток, что приводит к изменению иммунного ответа, с другой стороны это выработка иммунными клетками цитокинов и других биологически активных веществ, что приводит к хроническому пролиферативно-деструктивному воспалению, а с третьей стороны активируются клетки других тканей, что приводит к разрастанию синовиальной оболочки сустава и разрушению костной ткани. Поэтому представляется очень важным при появлении подозрения на РА направлять пациента к ревматологу для уточнения диагноза как можно скорее, ввиду того, что рано назначенное лечение существенным образом может изменить прогноз при данном заболевании.
Цели терапии РА — это предотвращение деструкции, деформации суставов и нарушения их функции, подавление симптоматики (боль, скованность и пр.), сохранение качества жизни, но в настоящее время реальными целями терапии являются достижение клинической ремиссии и увеличение продолжительности жизни больных. Воздействие на звенья патогенеза ревматоидного артрита возможно на двух уровнях: основной и наиболее перспективный ввиду возможности подавления значительно большего количества патогенетических механизмов — это уровень регуляции иммунного ответа, состоящий в контролируемой иммуносупрессии, и более низкий уровень — это блокада выработки медиаторов воспаления.
В настоящее время помимо стандартных медикаментозных групп препаратов, применяемых для лечения РА, включающих в себя препараты базисной терапии (метотрексат, лефлуномид, сульфасалазин и др.), глюкокортикоидные препараты и нестероидные противовоспалительные препараты, в мире зарегистрированы так называемые генно-инженерные биологические препараты (ГИБП), представляющие собой новый этап в развитии лечения РА. Последняя группа позволяет осуществлять целенаправленное, так называемое таргетное воздействие на ключевые механизмы развития ревматоидного воспаления. Наиболее широко в России применяются препараты из группы ингибиторов фактора некроза опухоли-альфа, ключевого цитокина, участвующего в развитии ревматоидного воспаления. Стандартным является применение данной группы препаратов для лечения ревматоидного артрита тяжёлой степени активности, устойчивого к применению базисных препаратов, таких как метотрексат. Однако известны и другие группы ГИБП, в частности препарат, подавляющий В-лимфоциты, которые играют большую роль в патофизиологии РА. Они отвечают за продукцию антител, цитокинов, а также в самой ранней стадии болезни они осуществляют презентацию антигенов и активацию Т-лимфоцитов, наряду с макрофагами, тем самым инициируя ревматоидное воспаление.
Среди дополнительных методов лечения РА применяются физиотерапия, лечебная физкультура, ортезирование и ортопедическая хирургия.
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
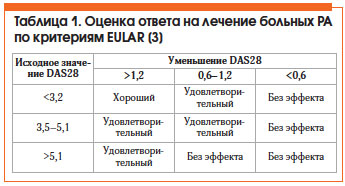
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

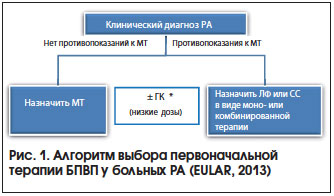
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
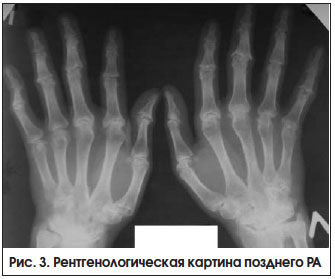
III. Пациент с поздним РА и остеопоротическими переломами
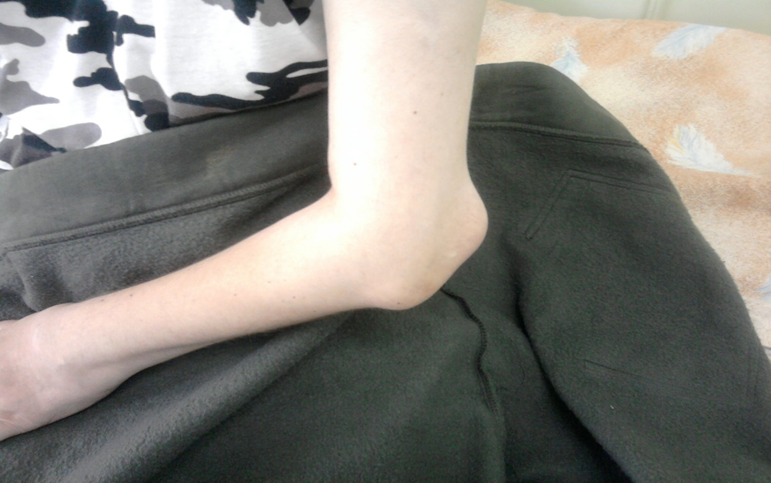
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
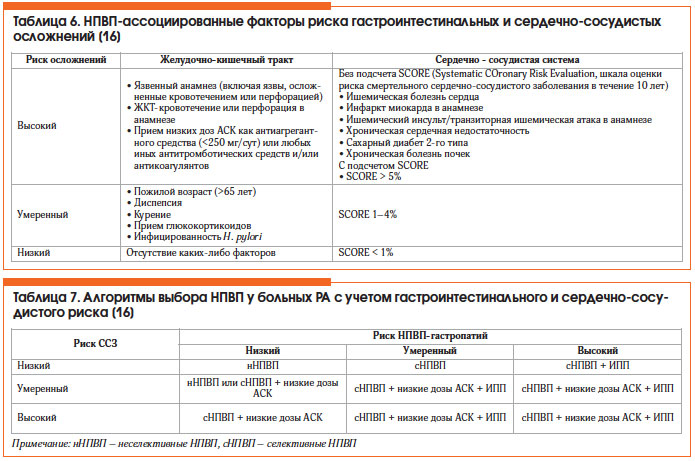
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник


