Современная фармакотерапия ревматоидного артрита
Воспалительные (аутоиммунные) ревматические заболевания относятся к числу распространенных и тяжелых форм патологии человека [1]. Они могут быстро приводить к инвалидности, а нередко и к уменьшению продолжительности жизни пациентов. Неблагоприятный жизненный прогноз определяется прогрессирующим поражением внутренних органов, связанным как с тяжестью самого патологического заболевания, которое плохо контролируется противовоспалительными препаратами, так и токсическим воздействием этих препаратов.
Причины большинства воспалительных ревматических болезней пока остаются не установленными, но основные механизмы патогенеза многих из них изучены достаточно подробно. Это послужило основанием для разработки концепции «патогенетической терапии». К «патогенетическим» относят большое число разнообразных по химической структуре и фармакологическим свойствам лекарственных средств (глюкокортикоиды, цитотоксические препараты и др.), которые объединяет способность подавлять воспаление и/или патологическую активацию системы иммунитета [2]. Однако у многих больных эти препараты недостаточно эффективны.
Ревматоидный артрит (РА) – распространенное (около 1% населения планеты) аутоиммунное ревматическое заболевание, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений [3]. Характерными проявлениями РА являются боли, нарушение функции суставов и неуклонно прогрессирующая деформация суставов, необратимое поражение внутренних органов, приводящие к ранней потере трудоспособности (около трети пациентов становятся инвалидами в течение 20 лет от начала болезни) и сокращению продолжительности жизни пациентов (в среднем на 5–15 лет). Преждевременная летальность во многом связана с высокой частотой сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия, остеопоротические переломы костей скелета и др.) [4].
Современная концепция фармакотерапии РА основана на следующих основных принципах [1,5–12]:
• Целью лечения является достижение полной (или хотя бы частичной) ремиссии.
• Для достижения этой цели лечение базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), должно начинаться как можно раньше, желательно в течение первых 3–х месяцев от начала болезни.
• Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ до 20–25 мг/нед. и последующим изменением (при необходимости) схемы лечения в течение 2–4 мес. для достижения максимально возможного терапевтического эффекта.
• В случае недостаточной эффективности терапии БПВП – назначение генно–инженерных биологических препаратов (ГИБП).
Напомним, что к ГИБП относится широкий спектр препаратов, полученных с помощью методов генной инженерии: моноклональные антитела против определенных детерминант иммунокомпетентных клеток или «провоспалительных» цитокинов, «анти–воспалительные» цитокины и ингибиторы цитокинов (растворимые рецепторы, антагонисты) [13,14]. Все они обладают высокой специфичностью, обеспечивающей селективное воздействие на определенные звенья иммунопатогенеза, в минимальной степени затрагивая нормальные механизмы функционирования иммунной системы. Это позволяет существенно снизить риск «генерализованной» иммуносупрессии, которая характерна для других лекарственных препаратов (в первую очередь глюкокортикоидов и цитотоксиков). Более того, изучение клинических и иммунологических эффектов этих препаратов позволяет получить новые данные о механизмах патогенеза заболеваний человека. Наиболее изученной и широко применяемой при РА группой ГИБП являются ингибиторы ФНО–a (инфликсимаб, адалимумаб и этанерцепт), однако примерно у 40% пациентов с тяжелым активным РА они недостаточно эффективны или вызывают побочные эффекты, являющиеся основанием для прекращения лечения [15–17]. Это диктует необходимость совершенствования подходов к фармакотерапии РА.
Поскольку по современным представлениям Т–клетки имеют фундаментальное значение в развитии РА [18], одним из важных направлений в лечении этого заболевания является подавление патологической активации Т–лимфоцитов [19]. Установлено, что для оптимальной активации Т–лимфоцитов требуется, как минимум, 2 сигнала (рис. 1). Один из них реализуется в процессе взаимодействия Т–клеточных рецепторов (ТКР) с молекулами главного комплекса гистосовместимости (ГКГ), экспрессирующимся на мембране антиген–презентирующих клеток (АПК), другой – за счет взаимодействия так называемых «ко–стимулирующих» рецепторов на Т–клетках и соответствующих лигандов на АПК [20,21]. Ключевой «ко–стимуляторный» сигнал обеспечивается за счет взаимодействия CD28 на Т–лимфоцитах и СD80/СD86 на АПК. CD28 постоянно экспрессируется на наивных CD4+ и CD8+ Т клетках, а CD80 и CD86 – только после стимуляции АПК. При наличии обоих сигналов Т–лимфоциты подвергаются пролиферации и синтезируют цитокины, которые, в свою очередь, активируют другие клетки иммунной системы, и прежде всего макрофаги. В отсутствие «ко–стимуляторного» сигнала Т–лимфоциты теряют способность эффективно «отвечать» на антигенные стимулы и подвергаются апоптозу. Наиболее мощным физиологическим ингибитором взаимодействия CD28–CD80/CD86 является CTLA4 (cytotoxic T–lymphocyte–associated antigen 4) – рецептор для CD80/CD86, который экспрессируется после активации АПК и взаимодействует с этими лигандами с более высокой авидностью (примерно в 500–2500 раз выше), чем CD28. Эта молекула рассматривается, как негативный регуляторный рецептор, который ограничивает неконтролируемую активацию Т–клеток в процессе иммунного ответа.
Это послужило основанием для разработки препарата абатацепт (Abatacept, Orencia, Bristol Myers Squibb), который представляет собой растворимую гибридную белковую молекулу, состоящую из двух компонентов – внеклеточного домена CTLA4 человека и модифицированного Fc (CH2 и CH3 области) фрагмента IgG1 (рис. 2). Модификация Fc фрагмента обеспечивает низкую способность абатацепта индуцировать комплемент–зависимые и антитело–зависимые клеточные цитотоксические реакции. Как и нативный CTLA4, этот белок связывается с более высокой авидностью с CD80/86, чем с CD28, и блокирует активацию Т–клеток (рис. 3).
По данным экспериментальных исследований, абатацепт подавляет развитие коллагенового артрита (классическая лабораторная модель РА у человека) при введении препарата во время иммунизации лабораторных животных коллагеном и замедляет прогрессирование артрита при введении на фоне его развития [22].
Абатацепт разрешен к применению для лечения РА в США (декабрь 2005), Канаде (июнь 2006) и Европе (май 2007) и проходит клиническую апробацию для лечения рассеянного склероза, псориаза и системной красной волчанки.
Лечение абатацептом проводится путем внутривенной инфузии препарата в дозе 10 мг/кг (500 мг при весе пациента менее 60 кг; 750 мг при весе 60–100 кг и 1000 мг при весе более 100 кг), затем через 2 и 4 нед., ежемесячно.
Эффективность
Клинические испытания, в которых была продемонстрирована высокая эффективность и безопасность абатацепта при РА, начались еще в конце прошлого века [23–25]. В дальнейшем была проведена серия рандомизированных плацебо–контролируемых исследований (РКПИ) в рамках фазы III клинических испытаний, которые соответствовали современным стандартам исследования современных БПВП [26–36].
Целью исследования AIM (Abatacept in Inadequate responders to Methotrexate) [26] являлось изучение клинической эффективности и влияния на прогрессирование деструкции суставов комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с активным РА с неадекватным ответом на МТ. В этом исследовании установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ (рис. 4). Результаты 2–летнего наблюдения за пациентами продемонстрировали длительное сохранение эффекта комбинированной терапии: ACR20/50/70 наблюдался соответственно у 80,3, 55,6 и 34,3% пациентов, низкая активность по DAS28 – у 56,1%, а ремиссия – у 30,9% (рис. 5). Установлено: в целом комбинированная терапия оказывает более выраженное влияние, чем монотерапия на прогрессирование деструкции суставов (1,07 ед. по сравнению с 2,4 ед.), в первую очередь за счет влияния насчет эрозий, но не на сужение суставной щели. Эффект в отношении замедления деструкции суставов сохранялся в течение двух лет терапии [31]. У тех пациентов, которые в течение второго года терапии вместо плацебо получали лечение абатацептом, наблюдалось замедление прогрессирования деструкции суставов (2,4 ед. через год лечения плацебо и 3,1 через год лечения абатацептом). В группе больных, получавших абатацепт в течение 2 лет, этот показатель составил 1,07 ед. в конце первого года и только 1,5 ед. в течение второго года. Эти данные указывают на нарастание эффективности абатацепта в отношении замедления деструктивного процесса в суставах в процессе длительного лечения препаратом.
В открытой фазе исследования [25], в котором была установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ, было показано, что лечение абатацептом и МТ эффективно в течение 5 лет терапии (рис. 6) и не сопровождается нарастанием частоты побочных эффектов [36].
ATTEST (Abatacept or infliximab versus placebo, A Trial for Tolerability, Efficacy and Safety in Treating RA) – первое и пока единственное исследование, в котором сравнивалась эффективность и безопасность двух ГИБП – абатацепта и ингибитора ФНО–a инфликсимаба [29] (рис. 7). Через 6 мес. пациенты, получавшие плацебо, переключались на лечение абатацептом. Через 6 мес. все анализируемые параметры эффективности (критерии ACR и EULAR) в группе пациентов, получавших абатацепт и инфликсимаб, были достоверно лучше, чем у пациентов, получавших плацебо (рис. 8 и 9). Отмечена определенная тенденция к более высокой эффективности и длительности сохранения эффекта у абатацепта по сравнению с инфликсимабом (рис. 8). Однако следует подчеркнуть: в группе пациентов, получавших инфликсимаб, не допускалась эскалация дозы препарата (более 3 мг/кг). Это не позволяет сделать заключение о более высокой эффективности абатацепта по сравнению с инфликсимабом.
Исследование ATTAIN (Abatacept Trial in Treatment of Anti–TNF Inadequate Responders) было посвящено оценке эффективности абатацепта у пациентов с неэффективностью ингибиторов ФНО–a [27]. Через 6 мес. эффективность абатацепта (ACR20) была существенно выше (50,4%), чем в группе плацебо (19,5%). Сходные данные получены при анализе числа пациентов с низкой активностью и достигших ремиссии по критерию EULAR (p<0,001) (рис. 10). Данные 18–месячной открытой фазы этого исследования свидетельствуют о длительном сохранении эффекта (ACR20 – 56,2%).
Важные результаты получены в открытом исследовании ARRIVE (Abatacept Researched in RA patients with an Inadequete anti–TNF response to Validate Effectiveness), в которое вошло 1046 больных с активным РА, несмотря на лечение ингибиторами ФНО–a [28]. Основной целью исследования было получение данных об эффективности и безопасности абатацепта у пациентов с РА в условиях, максимально приближенных к реальной клинической практике. В исследование были включены пациенты с побочными эффектами (или плохой переносимостью) ингибиторов ФНО–a и пациенты, которым проводилось профилактическое лечение по поводу латентного туберкулеза (положительная туберкулиновая проба, но отсутствие изменений при рентгенологическом исследовании легких). Кроме того, допускались прием любых БПВП и монотерапия абатацептом и возможность прямого перехода на лечение абатацептом без периода предварительной «отмывки» после завершения лечения ингибиторами ФНО–a. Было выделено 2 группы пациентов. В первую вошли 449 пациентов, которым проводилась «отмывка» перед назначением абатацепта, и 597 пациентов, которым лечение назначалось сразу после прекращения лечения ингибиторами ФНО–a. Установлено, что схема перехода на лечение абатацептом не влияет на эффективность (рис. 11) и, что самое важное – на безопасность терапии, по крайней мере, в течение первых 6 мес. наблюдения за пациентами. Так, частота ПЭ составила в сравниваемых группах 78% vs. 79,2%, тяжелых ПЭ – 11,1 и 9,9%, а частота прерывания лечения из–за побочных эффектов 3,8% vs. 4/0%.
Как уже отмечалось, современные принципы фармакотерапии РА основаны на ранней агрессивной терапии в дебюте болезни. Особый интерес представляют данные недавно завершенного исследования [34], целью которого было изучение эффективности комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с ранним РА, впервые начавших получать МТ. При этом пациенты с РА страдали прогностически неблагоприятной формой заболевания, характеризующейся высокими титрами ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (аЦЦП), которые рассматриваются, как маркер агрессивного течения РА [37]. Установлено, что комбинированная терапия абатацептом и МТ существенно превосходит по эффективности монотерапию МТ, в том числе по частоте развития ремиссии (рис. 12). Интересно, что сходные данные получены в процессе исследования COMET, в котором сравнивалась эффективность комбинированной терапии ингибитором ФНО–a – этанерцептом по сравнению с монотерапией МТ у пациентов с ранним РА [38]. Эти данные свидетельствуют о потенциальной возможности применения не только ингибиторов ФНО–a, но и абатацепта при раннем РА.
В недавних исследованиях было показано, что назначение МТ у пациентов с недифференцированным артритом (НДА) позволяет замедлить (и в некоторых случаях предотвратить) трансформацию НДА в достоверный РА [39], причем эффективность МТ ассоциировалась с обнаружением аЦЦП в сыворотках крови пациентов. Возникает вопрос: может ли агрессивная терапия ГИБД на стадии НДА приостановить развитие РА на самой ранней стадии болезни? Это послужило основанием для проведения специального РКПИ (фаза II) [35], в которое вошли 55 аЦЦП–позитивных пациентов с НДА (
Источник
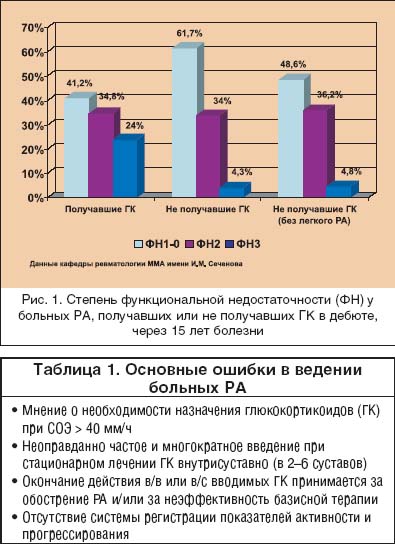
Ревматоидный артрит (РА) – одно из самых тяжелых заболеваний человека, основой которого является хронический пролиферативный синовит, поражение внутренних органов и систем (васкулит или гранулемы), с многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. В течение первых 5 лет болезни до сих пор более 40% больных РА становятся инвалидами [1]. Кроме того, многими авторами сообщается, что РА уменьшает продолжительность жизни больных в среднем на 10 лет [2,3], хотя при контролируемом многолетнем лечении она может быть сопоставима с популяцией [4,5]. РА – болезнь с неизвестной этиологией, чрезвычайно сложным многокомпонентным патогенезом, поэтому терапия его в течение многих лет осуществлялась по сути “ex juvantibus”. Еще недавно клиницисты назначали базисные противовоспалительные препараты (БПВП) только при наличии всех диагностических критериев РА, а подчас только после появления первых эрозий [6]. В настоящее время активно внедряется в практику раннее назначение (БПВП) для улучшения отдаленных исходов болезни. Кроме того, ранняя активная патогенетически обоснованная терапия РА позволяет уменьшить частоту назначения высоких доз симптоматических средств (нестероидных и стероидных противовоспалительных препаратов) и, соответственно, уменьшить частоту побочных реакций, неизбежно сопутствующих их использованию (повреждение слизистой желудочно–кишечного тракта, стероидный остеопороз, синдром Кушинга и др.). Основные ошибки в лечении больных РА представлены в таблице 1, и одной из основных ошибок в лечении больных РА является переоценка значимости симптоматической терапии глюкокортикоидами и слишком частое их использование в дозах, превышающих безопасные. Значение внедрения глюкокортикоидов в терапевтическую практику трудно переоценить. Однако назначение их без явных показаний сопряжено с развитием тяжелых осложнений и, по нашим данным, не приводит к улучшению отдаленного функционального прогноза (рис. 1).
При выборе терапевтической тактики врачи ориентируются на выраженность клинических проявлений суставного синдрома и уровень лабораторных параметров, отражающих активность воспаления (СОЭ и СРБ). К препаратам «первой линии» отнесены те БПВП, которые обладают доказанной эффективностью при РА и хорошей переносимостью [6]: метотрексат, сульфасалазин и аминохинолиновые препараты. При высокой активности РА, как правило, первым БПВП является метотрексат, при умеренной или слабой – сульфасалазин или аминохинолиновые препараты. В последние годы появились данные о высокой эффективности лефлуномида на ранней стадии РА [7]. Действительно, назначение БПВП в первые 3–5 месяцев от дебюта заболевания может улучшить отдаленный функциональный [8] и даже жизненный [5] прогноз. Большинство клиницистов уже адаптированы к раннему назначению БПВП. Наибольшие трудности для практического врача представляет дальнейшее ведение больных, то есть оценка достаточности эффекта проводимой терапии. В настоящее время широко применяются критерии, предложенные Американским колледжем ревматологов (АКР) и Европейской антиревматической лигой (EULAR) для оценки эффекта лечения больных РА [9,10], Однако не ясно, как коррелирует достижение эффекта по предложенным критериям с отдаленным исходом РА и его прогрессированием. Даже при 50–70%–м улучшением по критериям ACR у больного могут сохраняться 3–5 болезненных (БС) или припухших (ВС) сустава, отсутствовать нормализация концентрации СРБ. Является ли это не существенным для изменения терапии или врач должен менять терапевтическую тактику? Существуют данные, что начало лечения РА с комбинации БПВП имеет преимущества перед монотерапией [11].
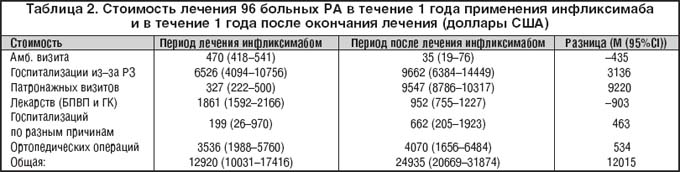
В последние годы в клиническую практику внедрен новый класс лекарственных средств для лечения РА: биологические агенты, воздействующие на основные провоспалительные медиаторы, образующиеся в синовиальной оболочке при РА. Эти препараты способны либо блокировать продуцируемые клетками синовии провоспалительные цитокины (ФНО–a, интерлейкин–1 и др.), либо блокировать клеточные рецепторы к этим цитокинам, воздействовать на ко–стимуляторные молекулы [12]. В России в настоящий момент зарегистрирован единственный препарат из группы биологических агентов – инфликсимаб. Высокая эффективность инфликсимаба при РА и других хронических артритах доказана многочисленными контролируемыми исследованиями [13,14,15]. Первый отечественный опыт применения инфликсимаба в лечении РА и других аутоиммунных заболеваний [16,17] продемонстрировал несомненные преимущества лечения этим препаратом: быстроту развития эффекта (после 1–й инфузии), выраженность клинико–лабораторного эффекта, вплоть до полного отсутствия суставного синдрома и внесуставных проявлений болезни, нормализации СОЭ, СРБ у больных с тяжелым (практически некурабельным) вариантом течения РА, сохранение эффекта при поддерживающей терапии, подавление рентгенологического прогрессирования деструкции суставов и после окончания курса лечения инфликсимабом. Однако в большинстве случаев назначение инфликсимаба планируется только при отсутствии эффекта от последовательно назначаемых БПВП, сохранении высокой активности воспалительного процесса, чем быстром прогрессировании деструкции (появлении более 4–5 новых эрозий за 12 месяцев), наличии ярких внесуставных проявлений [18]. То есть врачи рассматривают инфликсимаб как препарат «резерва». Возможно, высокая стоимость лечения биологическими агентами также повлияла на взгляд, что подобная терапия необходима в случаях отсутствия успеха лечения классическими препаратами. Хотя фармакоэкономическое исследование, проведенное в Финляндии [19] и оценившее стоимость госпитализаций больных РА, стоимость лечения базисными и симптоматическими средствами, посещений врача, проведения различных процедур и ортопедических оперативных вмешательств, показало, что лечение РА блокаторами ФНО–a обходится государству дешевле, чем классические способы лечения (табл. 2).
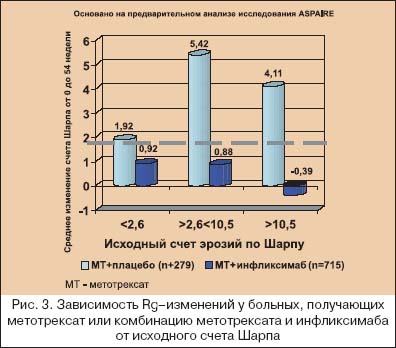
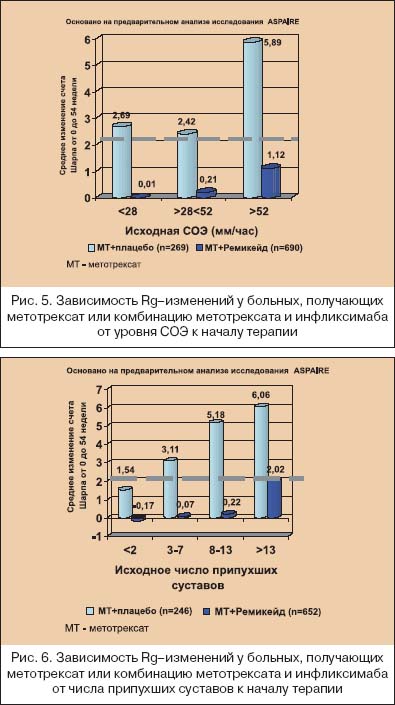
В последние годы многие исследователи склоняются к тому, что ранняя терапия РА означает не только назначение классических БПВП в первые месяцы от дебюта болезни, но и выбор максимально активно (агрессивно) воздействующих лекарственных средств на быстро пролиферирующий синовит. Как показано на рисунке 2, различные звенья патогенеза РА являются мишенями для лечебного воздействия различных групп БПВП. Видно, что максимального эффекта от «классических» БПВП следует ожидать на стадии активации иммуннокомпетентных клеток, которая практически облигатно проходит до появления клинических симптомов, а при развитии артритов в синовиальной оболочке обнаруживаются уже на ранней стадии выраженные пролиферативные процессы [20]. В этой связи становится обоснованным начало терапии РА с метотрексата и лефлуномида. Начало лечения РА с базисных средств основано не только на понимании, что ранняя болезнь не всегда легкая болезнь, но и связано с тем, что при РА отсутствуют четкие критерии прогноза течения и прогрессирования болезни. Известно, что ухудшение функционального исхода болезни четко коррелирует с исходными величинами HAQ (опросника состояния здоровья), количеством ВС, возрастом и женским полом, а более быстрое прогрессирование деструкции суставов – с увеличением количества БС и ВС, уровнем СРБ и т.д. Но до сих пор не было установлено, какая именно выраженность этих параметров должна быть критерием для коррекции терапии или предопределять изначальный выбор более активных методов лечения. Исследование ASPIRE [14] показало, как динамика деструктивного процесса в суставах зависит от исходной выраженности суставного синдрома, лабораторных воспалительных тестов и исходного количества эрозий под влиянием монотерапии метотрексатом и комбинации инфликсимаба с метотрексатом. Деструктивные изменения в мелких суставах кистей и стоп оценивали по модифицированному методу Шарпа [21], который включает в себя подсчет количества эрозий и подсчет степени сужения суставных щелей в мелких суставах кистей и стоп. Считается, что изменение общего счета Шарпа до 2,0 обозначает минимальное прогрессирование деструктивного артрита. Как видно из рисунков 3, 4, 5 и 6, комбинация инфликсимаба и метотрексата в гораздо большей степени подавляла прогрессирование при РА, чем монотерапия метотрексатом. Но особенный интерес вызывают полученные данные, что монотерапия метотрексатом подавляла прогрессирование только при исходно минимальном деструктивном артрите (счет Шарпа не более 2,6), при исходной концентрации СРБ менее чем 0,6 mg/dl, уровне СОЭ<28 мм/ч (по Westgren) и, что представляется особенно важным для клинициста – при исходном количестве припухших суставов не более 2–х, а при наличии 3–х и более припухших суставов подавление деструктивных процессов отмечено только у тех больных, которые получали комбинацию инфликсимаба и метотрексата.
Эти данные заставляют пересмотреть само понятие «агрессивная» терапия РА. Сложилось мнение, что только высокоактивные варианты РА нуждаются в быстром назначении комбинированной базисной терапии, в том числе и комбинаций с биологическими агентами, или использования высоких доз цитостатических препаратов (пульс–терапия метотрексатом или циклофосфамидом), то есть в использовании «агрессивной» терапии. Начиная с 70–х годов прошлого столетия, нами осуществлялся принцип раннего назначения БПВП, независимо от уровня исходной клинико–лабораторной активности РА, всем больным РА. Такой подход позволил добиться развития стойкой клинико–лабораторной ремиссии у 65% больных РА, которым БПВП были назначены в первые 5 месяцев от дебюта заболевания [5]. Внедрение в клиническую практику биологических агентов, специфически подавляющих медиаторы воспаления при РА, на ранних сроках болезни позволит индуцировать стойкие ремиссии болезни у большинства больных. Изучению таких возможностей инфликсимаба посвящено исследование DINORA, в котором инфликсимаб назначается в первые 2–6 недель болезни. Рассматривается даже вопрос о возможности полного излечения РА при максимально раннем начале базисной терапии с использованием инфликсимаба.
Таким образом, тактика лечения РА должна быть направлена на быстрое выявление больных с дебютом суставного синдрома, оперативное проведение диагностических мероприятий и быстрое направление этих больных к специалисту–ревматологу. Очевидно, что трагические исходы РА с полной утратой функции суставов осложнениями болезни в виде утраты функции внутренних органов из–за массивного отложения масс амилоида, асептическими некрозами головок крупных суставов, на современном этапе развития ревматологии не должны допускаться. Тем более, что клиницисты получили новый класс препаратов (биологические агенты), которые реально могут изменить течение РА.


Литература
1. Балабанова Р.М., 1997, гл.9 Руководства по внутренним болезням, стр. 257–294.
2. Goodson N., Symmons D. “Rheumatoid arthritis in women: still associated with increased mortality” Ann. Rheum. Dis., 2002, 61: 955–956
3. Riise T., Jacobsen B.K., Gran J.T. et.al. “Total mortality is increased in rheumatoid arthritis. A 17–year prospective study.” Clin. Rheum., 2002, 20: 123–127
4. Kroot E.J.A., van Leeuwen M.A., van Rijswijk M.H. et.al. “No increased mortality in patient with rheumatoid arthritis: up to 10 years of follow–up from disease onset.” Ann. Rheum. Dis., 2000, 59: 954–958
5. Kanevskaya M.Z., Chichasova N.V. “Treatment of early rheumatoid arthritis: influence on parameters of activity and progression in long–term prospective study”. Ann. Rheum. Dis., Vol. 672, Suppl. 1, 2003, P. 179 (Annual European Congress of Rheumatology, EULAR 2003, Abstracts, Lisbon, 18–21 June 2003)
6. Aletano D., Eberl G., Nell V.P.K. et.al. “Practical progress in realisation of early diagnosis and treatment of patients with suspected rheumatoid arthritis: results from two matched questionnaires within three years” Ann. Rheum. Dis., 2006, V. 61, pp.630–634
7. Scott D.L. “Comparing the benefits of DMARDs in early rheumatoid arthritis” Abstr. Book “Advancing arthritis therapy: addressing patients needs”, Feb. 2006, Seville, Spain, pp.8–9
8. Egmose C., Lund B., Pettersson H. et.al. “Patients with rheumatoid arthritis benefit from early 2nd line therapy: 5 years follow–up of a prospective double–blind placebo controlled study.” J. Rheum., 1995, V.22, pp.2208–2213
9. Felson DT., Anderson J., Boers M. et. al.”The American College of Rheumatology preliminary definition of improvement in rheumatoid arthritis” Arthr. Rheum., 1995, V.38: 727–735
10. Van Gestel AM, Prevoo MLL, van’t Hof MA et.al. “Development and validation of the European League Against Rheumatism response criteria for RA” Arthritis Rheum. 1996; 39:34–40
11. Dougados M., Combe B., Cantagrel A. et.al. “Combination therapy in early rheumatoid arthritis: a randomised, controlled, double blind 52 week clinical trial of sulphasalazine and methotrexate compared with the single components.” Ann. Rheum. Dis., 1999, V.58, pp. 220–225
12. Насонов Е.Л. «Лечение ревматоидного артрита: современное состояние проблемы» РМЖ, 2006, том 14, №8,573–577.
13. Maini R., St Clair E., Breedveld F. et.al. “Infliximab (chimeric antitumour necrosis factor alpha monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randimised phase III trial. ATTRACT Study Group.” Lancet, 1999, 354(9194): 1932–1939
14. St Clair E., van der Heijde D., Smolen J. et.al. “Combination on infliximab and methotrexate therapy for early rheumatoid arthritis:a randomised, controlled trial.” Arthr. Rheum., 2004, 50 (11): 3432–3443
15. Насонов Е.Л. «Инфликсимаб при спондилоатропатиях и псориатическом артрите: новые показания» РМЖ, 2005, том 13, №8, 528–531
16. Чичасова – Ремикейд
17. Мазуров В.И., Лила А.М, Жигурова Е.С. «Опыт применения Ремике0йда при некоторых аутоиммунных заболеваниях», РМЖ, 2005, том 13, №10, 700–73
18. Лукина Г.В., Сигидин Я.А., Чичасова Н.В. и др. «Применение моноклональных антител к фактору некроза опухоли (Ремикейд) при ревматоидном артрите: предварительные результаты» Тер. Архив, 2003, №5, стр. 9–12
19. Laas K., Peltomaa R., Kautiainenet H. al. “Pharmacoeconomic study of patients with chronic inflammatory join disease before and during infliximab treatment” Ann. Rheum. Dis., 2006, 65: 924–928
20. Чичасова Н.В., Шехтер А.Б., Крель А.А. «Эволюция морфологических проявлений синовита с начальной стадией ревматоидного артрита при различных вариантах его дальнейшего течения» Ревматология, 1988, №2, стр. 3–16
21. Van der Hejde D.M. “How to read radiographs to the Sharp/van der Hejde method.” J. Rheum., 1999, 26:743–745
Источник