Ведение больных ревматоидным артритом
В статье представлены рекомендации Европейской антиревматической лиги 2016 г. и национальные рекомендации 2017 г. по ведению больных ревматоидным артритом, приведены результаты лечения больных с ранней стадией заболевания в соответствии с данными рекомендациями. Цель исследования. Оценка эффективности и переносимости подкожной формы метотрексата при проспективном наблюдении больных с ранним ревматоидным артритом. Материал и методы. Подкожная форма метотрексата (15 мг/нед в комбинации с 1–2 мг фолиевой кислоты) была назначена 67 больным с достоверным диагнозом «ревматоидный артрит» по критериям ACR/EULAR 2010 г. В течение 12 мес пролечено 65 больных (97%), 24 мес – 47 больных, 36 мес – 22 пациента. Лечение проводилось в соответствии с принципами стратегии лечения РА «Лечение до достижения цели» (Treat to Target). Исходная активность РА по DAS28 у 43 больных (64%) была умеренной и у 24 (36%) – высокой. Результаты. Практически у всех больных (у 61 из 67 – 91%) первые симптомы улучшения отмечались через 4–5 нед использования метотрексата в дозе 15 мг/нед, к 8 нед терапии эффект отмечался у всех больных. Через 6 мес терапии высокой степени активности ревматоидного артрита не отмечено, умеренная степень активности имела место у 32 из 65 (49%) пациентов, низкая – у 33 (51%). Через 2 года лечения 43% больных достигли ремиссии, у остальных регистрировалась низкая активность РА; через 3 года ремиссия отмечалась у более половины пациентов. Заключение. Подкожная форма метотрексата обладает высокой эффективностью в отношении активности и прогрессирования при раннем ревматоидном артрите, длительной хорошей переносимостью и позволяет при использовании принципов контролируемого лечения, включая обучение больных, достичь цели у большинства пациентов через 6–12 мес терапии. При условии контролируемого лечения со своевременной коррекцией терапии при недостаточном противовоспалительном эффекте, обучении больных можно значительно улучшить результаты лечения ревматоидного артрита, добиться клинико-лабораторной ремиссии более чем у половины пациентов и предупредить деструкцию суставов.
ВВЕДЕНИЕ
Ревматоидный артрит (РА) – одно из самых тяжелых хронических заболеваний человека. Тяжесть заболевания связана со сложным многокомпонентным патогенезом хронического воспаления, развивающегося преимущественно в синовиальной оболочке суставов, что приводит к деструкции хряща суставных поверхностей и субхондральной кости с утратой функции опорно-двигательного аппарата.
 В недавнем прошлом лечение РА при отсутствии современного арсенала лекарственных средств и четкой стратегии терапии не давало возможности стабильного подавления активности и прогрессирования заболевания, что приводило к частой инвалидизации больных в первые 5 лет болезни [1]. На современном этапе результаты лечения РА при грамотном ведении больных позволяют контролировать течение болезни и сохранять работоспособность пациентов. Это стало возможным благодаря нескольким обстоятельствам.
В недавнем прошлом лечение РА при отсутствии современного арсенала лекарственных средств и четкой стратегии терапии не давало возможности стабильного подавления активности и прогрессирования заболевания, что приводило к частой инвалидизации больных в первые 5 лет болезни [1]. На современном этапе результаты лечения РА при грамотном ведении больных позволяют контролировать течение болезни и сохранять работоспособность пациентов. Это стало возможным благодаря нескольким обстоятельствам.
Во-первых, разработаны новые классификационные критерии РА 2010 г. [2], позволяющие устанавливать диагноз на ранних стадиях болезни (табл. 1). Во-вторых, сформулированы принципы стратегии лечения РА «Лечение до достижения цели» (Treat to Target) [3]. Согласно им лечение больных РА должно проводиться при постоянном взаимодействии врача и пациента, основная стратегическая цель лечения РА – максимальное сохранение качества жизни пациента, основной путь к достижению этой цели – подавление воспаления и постоянный контроль за достаточностью терапии. В соответствии со стратегией «Лечение до достижения цели» формулируются и современные международные (рекомендации Европейской антиревматической лиги – EULAR) [4] и национальные [5] рекомендации по ведению больных РА, в которых четко сформулирована тактика этого ведения. Лечение больных РА должно проводиться ревматологами.
В настоящее время для лечения РА используются, с одной стороны, симптоматические (стероидные и нестероидные) противовоспалительные препараты, которые бывают необходимы на ранних этапах проведения терапии, но не способны оказать влияние на течение РА, с другой – синтетические базисные противовоспалительные препараты (БПВП), задача которых надежно подавить воспаление и предотвратить развитие деструкции. В отсутствии достаточного эффекта при их использовании к лечению присоединяют генно-инженерные биологические препараты (ГИБП) или так называемый таргетный БПВП – блокатор янус-киназ тофацитиниб. Высокая стоимость ГИБП лимитирует их применение у всех больных РА, хотя ряд контролируемых исследований и показывает их более высокую эффективность у больных на ранней стадии и не получавших ранее БПВП [6, 7].
Лечение РА с применением синтетических БПВП начинают сразу после установления диагноза, не позднее чем через 3–6 мес от момента появления симптомов поражения суставов (уровень доказательности 1а) [3–5]. В связи с этим каждый врач общей практики должен уметь выделить среди пациентов с болями в суставах больных, у которых имеются признаки хронизации воспаления, и как можно раньше отправить их на консультацию к ревматологу.
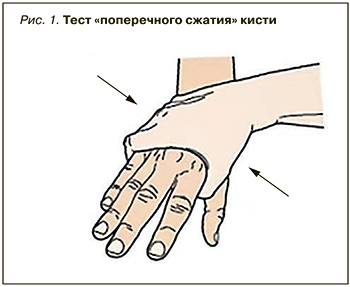 EULAR дано определение артралгий, позволяющих заподозрить развитие РА [8]. Врачу общей практику следует оценить 5 анамнестических параметров (табл. 2), а при осмотре оценить, есть ли затруднения при сжатии кисти в кулак и провести тест поперечного сжатия кисти (или стопы; рис. 1).
EULAR дано определение артралгий, позволяющих заподозрить развитие РА [8]. Врачу общей практику следует оценить 5 анамнестических параметров (табл. 2), а при осмотре оценить, есть ли затруднения при сжатии кисти в кулак и провести тест поперечного сжатия кисти (или стопы; рис. 1).
Как видно из табл. 2, при наличии 4 положительных ответов из 7 риск развития РА уже составляет почти 94%, а при наличии 5–7 положительных ответов он равен 100%, что должно служить основанием для направления больного к ревматологу. При раннем начале лечения (в первые 3–6 мес) у большинства пациентов можно добиться ремиссии или течения РА с низкой активностью, что и является критерием эффективного лечения РА.
Задержка с назначением синтетических БПВП приводит к уменьшению эффекта лечения. Согласно анализу данных 14 рандомизированных клинических исследований (1435 пациентов с РА, из которых 886 получали различные синтетические БПВП и 549 – плацебо) с учетом демографических факторов (пол, возраст), функционального класса по Steinbrocker и клинико-лабораторных параметров активности болезни (боль, число болезненных и припухших суставов, СОЭ, индекс оценки функции HAQ и др.), при любой длительности РА различие в частоте развития терапевтического эффекта между активным лечением и плацебо было примерно одинаковым – около 30% [9]. Однако по мере увеличения длительности РА эффективность синтетических БПВП снижалась с 52% «ответчиков» (в случае начала терапии при длительности РА 10 лет).
 Якорным препаратом в лечении РА считается метотрексат (МТ), который эффективен у большинст…
Якорным препаратом в лечении РА считается метотрексат (МТ), который эффективен у большинст…
Наталья Владимировна Чичасова, д.м.н., проф. кафедры ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова. Адрес: 115522, г. Москва, Каширское шоссе, д. 34А. Тел.: 8 (499) 614-35-22. E-mail: KafedraRheum@yandex.ru
Елена Валентиновна Иголкина, к.м.н., доцент кафедры ФГАОУ ВО Первый МГМУ им. И.М. Сеченова.
Адрес: 115522, г. Москва, Каширское шоссе, д. 34А. Тел. 8 (499) 614-35-22. E-mail: KafedraRheum@yandex.ru
Гюзель Рашидовна Имаметдинова, к.м.н., доцент кафедры ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова. Адрес: 115522, г. Москва, Каширское шоссе д. 34А. Тел.: 8 (499) 614-35-22. E-mail: KafedraRheum@yandex.ru
Евгений Львович Насонов, д.м.н., профессор, зав. кафедры ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова. Адрес: 115522, г. Москва, Каширское шоссе, д. 34А. Тел.: 8 (499) 614-35-22. E-mail: KafedraRheum@yandex.ru
Источник
Ревматоидный артрит (РА) считается одним из самых тяжелых хронических заболеваний человека. Заболевание характеризуется выраженным воспалением с пролиферацией синовиальной оболочки суставов, поражением внутренних органов и систем, многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. До последнего времени в течение первых 5 лет болезни более 40% больных РА становились инвалидами [1]. Кроме того, многими авторами сообщается, что РА снижает продолжительность жизни больных в среднем на 10 лет [2, 3].
Течение РА весьма вариабельно. Это связано со многими причинами. Больной может оказаться резистентным к лечению либо не переносить его. Задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) также ухудшает прогноз при РА. Кроме того, известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания. Известно, что в крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитруллинированному пептиду (АЦЦП) [4] (рис. 1).
Морфологическое исследование синовиальной оболочки, полученной у больных в первые месяцы дебюта артрита, показало, что не у всех выявляются признаки острого ревматоидного воспаления, – у части больных уже в первом биоптате наблюдаются отчетливые признаки хронического синовита [5]. Именно у этих больных отмечался далее более торпидный вариант РА с плохим ответом на терапию БПВП. Тяжесть состояния больного РА на каждом этапе зависит от уровня воспалительной активности, что определяет выраженность болей в суставах, скованность, функциональные нарушения. При адекватно проводимой терапии и подавлении активности до развития необратимых анатомических изменений в суставах (деструкция, деформации) функция суставов восстанавливается (рис. 2). А тяжелый вариант течения болезни встречается при неадекватно проводимой или неэффективной терапии, определяется степенью стойкой утраты функциональной способности больного не только к профессиональному труду, но и к самообслуживанию. Поэтому как можно более раннее начало противовоспалительной терапии имеет при РА принципиальное значение.
В последнее десятилетие в практику здравоохранения внедрены диагностические критерии ранних стадий РА [6] для своевременного направления больного к ревматологу и раннего начала терапии. А появление новых классификационных критериев ACR/EULAR 2010 г. позволило как можно раньше начинать лечение БПВП [7]. Идеальным должно считаться начало терапии БПВП сразу после появления первых симптомов воспаления в синовиальной оболочке: утренней скованности, боли в суставах и припухлости, что и отражено в данных критериях: наличие полиартрита с вовлечением мелких суставов имеет наибольший вес. На практике больной с дебютом РА проходит подчас длинный путь консультаций, диагностических мероприятий до встречи с ревматологом.
Кроме того, начало болезни может быть клинически слабо выражено, и симптомы болезни медленно нарастают, что затрудняет установление диагноза РА. По данным зарубежных авторов [8] и по нашим данным [9], при остром дебюте РА отдаленный исход болезни лучше, чем при постепенном начале заболевания. Вероятно, острое начало болезни заставляет пациента быстрее обращаться за врачебной помощью, а врач в этом случае быстрее определяется с диагнозом и начинает терапию. Наши данные свидетельствуют о лучшем исходе РА, оцененном через 15 лет болезни по степени сохранности функции опорно-двигательного аппарата, выраженности деструкции в суставах, частоте многолетних ремиссий и выживаемости больных, при назначении БПВП в первые 6 мес. от дебюта симптомов артрита [10].
Задержка с назначением БПВП приводит к более плохому ответу на эти препараты, что было показано в контролируемых исследованиях [11]. Препаратом первой линии считается метотрексат, другие БПВП (лефлуномид, сульфасалазин) в начале лечения используют при невозможности назначить метотрексат. Терапия БПВП у многих больных приводит к подавлению активности и прогрессирования РА, особенно при назначении их в первые месяцы болезни. Но и начало терапии в очень ранний период болезни (1–2 мес. болезни) не во всех случаях позволяет добиться выраженного эффекта (клинической ремиссии или поддержания низкой активности РА). Во-первых, больной может не ответить на БПВП; во-вторых, у многих больных эффективность БПВП уменьшается через 1–2 года терапии, у части больных происходит последовательная смена базисных препаратов из-за симптомов непереносимости.
При неэффективности и/или непереносимости последовательно назначаемых БПВП и развивается тяжелая форма РА. Наиболее значимыми параметрами для определения тяжести РА являются выраженность деструктивных изменений в суставах и степень стойкой утраты функциональной способности суставов вплоть до утраты больным способности к самообслуживанию.
Большое количество рандомизированных клинических исследований (РКИ) было посвящено выявлению наиболее эффективных терапевтических стратегий в лечении больных РА: сравнивались результаты лечения при последовательной монотерапии БПВП, при их комбинации как в дебюте болезни (стратегия «step-down»), так и после присоединения 2-го, 3-го препаратов при неэффективности первого средства (стратегия «step-up»). В последних рекомендациях EULAR 2013 [12] использование комбинации БПВП предлагается и в дебюте лечения, что основывается на результатах нескольких рандомизированных открытых исследований [13–15].
Оценка в сравнительном аспекте эффективности монотерапии метотрексатом, сульфасалазином, антималярийными препаратами, циклоспорином А, лефлуномидом и их комбинаций [16–23] не показала однозначного преимущества комбинированной терапии БПВП перед их применением в виде монотерапии. В ряде исследований было показано, что через 6, 12 и 24 мес. клинический эффект был более выражен при использовании комбинации БПВП (либо при «step-up», либо при «step-down» стратегии) [19, 21, 24–28]; по данным других авторов [29, 30] не отмечено достоверных отличий во влиянии на показатели активности монотерапии или комбинации БПВП. При продлении срока исследований (до 5 лет) преимущества во влиянии на активность РА комбинации БПВП перед монотерапией не отмечено [16, 28, 29]. Оценка рентгенологических изменений в суставах через 1–2 года не показала преимуществ комбинированного лечения в исследовании MASCOT [21], а комбинация циклоспорина А и метотрексата в 2-х исследованиях через 6 [31] и 12 [32] мес. в большей степени подавляла прогрессирование деструкции, чем монотерапия метотрексатом. В исследовании FIN-RACo изменение счета Ларсена было достоверно меньше при использовании комбинации БПВП через 2 года [19], но через 5 лет достоверных различий между комбинированной терапией и монотерапией уже не отмечалось [20]. Следует отметить, что комбинация БПВП была более эффективна по сравнению с монотерапией различными БПВП только в том случае, если в комбинации использовался метотрексат.
Кроме того, интересные данные были получены при оценке эффективности двойных комбинаций БПВП с тройной комбинацией: сравнивали эффективность метотрексата + сульфасалазин, метотрексата + гидроксихлорохин и комбинации всех 3-х препаратов [13]. По критериям эффективности ACR было получено превосходство тройной комбинации над двойными, но только в группе больных, которые ранее не получали метотрексат. В группе больных, ранее лечившихся метотрексатом, эффект тройной комбинации не превышал эффект совместного применения метотрексата и гидроксихлорохина.
Весьма интересны данные, полученные в результате исследования TICORA [17, 33], которое сравнило результаты 18-месячного лечения 2-х групп больных РА: в 1-й группе лечение проводилось со строгим ежемесячным контролем изменения активности РА по DAS («tight» контроль), и в соответствии с динамикой DAS корригировалась терапия («интенсивная» группа). Во 2-й группе лечение проводилось рутинным способом без такого жесткого контроля. К концу исследования ремиссия была достигнута у 65% больных 1-й группы и только у 16% больных 2-й группы. Увеличение числа эрозий было меньше в 1-й группе. Контролируемое лечение («интенсивная» группа) сопровождалось более частой коррекцией терапевтической тактики (использование комбинации БПВП, эскалация их дозы, использование внутрисуставных введений ГК). Авторы при анализе этих результатов пришли к выводу, что контроль за лечением обеспечивает наилучшие результаты вне зависимости от выбора БПВП.
Такой же вывод сделан J.M. Albers et al. [34] при оценке результатов 4-х различных режимов использования БПВП: жесткий контроль за успешностью лечения обеспечивает сходные результаты терапии различными БПВП. При оценке лечения метотрексатом пациентов с ранним РА (длительность болезни <1 года) в исследовании CAMERA [22, 23] также сделан вывод, что строгий ежемесячный контроль динамики активности болезни («tight» контроль) и своевременная коррекция терапии позволяют добиться достоверно лучшего результата за период 2-летнего наблюдения. Так, в группе интенсивного контроля (n=76) частота ремиссий составила 50%, а при рутинном способе лечения (n=55) – 37% (p=0,03) [23]. Эти данные совпадают с нашим мнением, основанным на результатах более длительного открытого исследования эффективности базисной терапии у 240 больных: улучшение исхода РА (функциональное состояние суставов, рентгенологическая картина) зависит не только от сроков начала лечения, но и от степени обеспечения постоянного контроля за ходом лечения [10]. Также эти данные создали предпосылки для разработки современной стратегии лечения РА «Лечение до достижения цели» («Treat to target»), когда основной целью лечения становится достижение ремиссии, а альтернативной целью – достижение низкой активности РА [35].
Но даже при грамотном подходе к терапии больных РА в соответствии с внедренной в нашей стране стратегией лечения «Лечение до достижения цели» классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности и прогрессирования болезни) все же развивается тяжелая форма РА. По нашим данным и данным литературы, у 15–25% больных последовательно назначаемые БПВП не приводят к выраженному эффекту (хороший эффект по критериям EULAR или более чем 50% улучшение по критериям ACR) либо приводят к возникновению побочных реакций и необходимости отмены БПВП. Создание генно-инженерных биологических препаратов (ГИБП) позволило в значительной степени оптимизировать лечение больных РА.
В настоящий момент в Российской Федерации зарегистрированы 5 блокаторов фактора некроза опухоли-α (ФНО-α): инфликсимаб, адалимумаб, цертолизумаб пэгол, голимумаб, этанерцепт, препарат ритуксимаб, связывающий CD20, ингибитор растворимых мембранных рецепторов к интерлейкину-6 – тоцилизумаб и абатацепт. Все эти препараты продемонстрировали высокую эффективность у больных с недостаточным эффектом БПВП, включая метотрексат. Лечение ритуксимабом, как правило, проводится при неэффективности ингибиторов ФНО-α, хотя препарат может использоваться как первый ГИБП при особых показаниях (например, проживание в эндемичном по туберкулезу районе), что также отмечено в последних рекомендациях EULAR (2013) [12]. Остальные ГИБП могут быть первыми представителями этой группы, назначаемыми при отсутствии эффекта от БПВП.
С учетом высокой стоимости лечения ГИБП важным представляется вопрос отбора больных для терапии ГИБП. Как было показано в исследовании BEST [13], при неэффективности 2-х последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы и в России одним из критериев отбора больных для назначения ГИБП является неэффективность 2-х БПВП, одним из которых должен быть метотрексат. Как показывает анализ РКИ, начало терапии сразу с комбинации ГИБП и метотрексата не имеет преимуществ перед последовательным усилением терапии при недостаточном эффекте метотрексата [36]. Однако при наличии факторов неблагоприятного прогноза (высокая активность с вовлечением большого количества суставов, высокая концентрация РФ и АЦЦП, прогрессирование деструкции суставов) вопрос о применении ГИБП обсуждается после неэффективности первого БПВП.
Классические БПВП способны в дебюте РА оказать выраженное действие и подавить рентгенологическое прогрессирование деструкции у значительного количества пациентов. В нашей практике больным с установленным диагнозом РА сразу назначается метотрексат, при наличии противопоказаний индивидуально обсуждается выбор БПВП. Далее пациент наблюдается ежемесячно до выраженного эффекта с коррекцией терапии, проводимой индивидуализированно. В течение первых 3-х мес. лечения должно быть установлено, имеется ли эффект, какова его выраженность. Такой контроль за степенью подавления активности позволяет своевременно корректировать терапию, если это требуется. При 50% (и более) улучшении далее в течение первого года терапии оценивается, есть ли подавление прогрессирования эрозивного артрита. Недостаточный противовоспалительный эффект или появление новых эрозий в суставах кистей и стоп, развитие деструкции крупных суставов, сохранение внесуставных проявлений должны приводить к изменению терапии: увеличению дозы метотрексата или переходу на его подкожные инъекции, смене БПВП, комбинации БПВП или их комбинации с ГИБП. Увлечение симптоматической терапией, стремление подавить активность заболевания с помощью частых внутрисуставных или в/в введений глюкокортикоидов при отсутствии достаточного и стабильного эффекта БПВП не предупреждают развития тяжелой формы РА. Эти мероприятия могут быть только дополнением к лечению БПВП, но не подменять его.
Таким образом, для предупреждения утраты функции у больных РА, т. е. для предупреждения развития тяжелой формы болезни врач должен обеспечить следующее:
- раннее назначение БПВП всем больным РА;
- провести обучение больного с объяснением целей терапии, необходимости длительного (многомесячного и многолетнего) лечения, мониторинга переносимости препаратов;
- постоянный контроль за степенью подавления активности и прогрессирования болезни с объективной оценкой количественной выраженности суставного синдрома и деструктивных изменений в суставах, за переносимостью терапии;
- при неэффективности 2-х последовательно назначенных БПВП поставить вопрос о необходимости назначения ГИБП.
Для объективного контроля за активностью РА на каждом этапе лечения врач должен регистрировать число болезненных и припухших суставов, выраженность боли по оценке больным, общее состояние по оценке больным и врачом с использованием визуальной аналоговой шкалы, а также лабораторные параметры (СОЭ и С-реактивный белок). Контроль за успешностью терапии с использованием составного индекса DAS28 позволяет объективизировать контроль изменения активности РА.
Таким образом, внедрение новых классификационных критериев РА, наличие активных БПВП и арсенала ГИБП, безусловно, создает предпосылки для значимого улучшения исходов РА, сохранения качества жизни больных.
Источник


