Интерлейкин 6 при артрите
Макрофаги и фибробласты являются основными источниками цитокинов в ревматической синовиальной оболочке при ревматоидном артрите. Синовиальные макрофаги и фибробласты синтезируют в суставе множество провоспалительных факторов, вовлеченных в цитокиновые сети, включая ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-15, ИЛ-16, ИЛ-18, ИЛ-32, ФНО-а, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и множество хемокинов. Эти цитокины участвуют в паракринной и аутокринной регуляции, в результате которой усиливается и поддерживается воспаление синовиальной оболочки. Например, макрофаги и фибробласты покровного слоя активируют смежные клетки, которые, в свою очередь, синтезируют медиаторы, стимулирующие их «соседей». Понятие цитокиновых сетей, в которых основная функция принадлежит синовиальным клеткам, сыграло главную роль в появлении антицитокинового лечения при ревматоидном артрите.
Хотя провоспалительные цитокины могут быть уравновешены супрессирующими цитокинами (ИЛ-10), растворимыми рецепторами (ФНО-а), связывающими белками (ИЛ-18) и естественными антагонистами рецептора, которые синтезируются макрофагами и фибробластами в синовиальной оболочке, их концентрации ниже требуемых для подавления воспаления. Несмотря на то, что цитокиновая сеть крайне избыточна, контроль болезни у многих пациентов достигается путем ингибирования единичного цитокина. Самый яркий пример — антагонисты ФНО-а; при блокаде этого цитокина у 30- 50% пациентов наблюдается выраженное клиническое улучшение.
Некоторые ключевые цитокины, синтезируемые макрофагами и фибробластами при ревматоидном артрите, обсуждены ниже. Это неполный список, с каждым годом сеть все более усложняется. В некоторых случаях вклад недавно описанных провоспалительных цитокинов не был определен.
Фактор некроза опухоли
Фактор некроза опухоли альфа (ФНО-а) — провоспалительный цитокин, который синтезируется как связанный с мембраной белок и высвобождается после протеолитического расщепления ФНО-конвертазой. Его именем также обозначают группу родственных цитокинов, известных как суперсемейство ФНО, многие из которых также синтезируются в пораженном суставе. Некоторые члены семейства регулируют микроструктуру субсиновиального слоя (лимфотоксины и лиганд рецептора лимфотоксина (3, или LIGHT), в то время как другие участвуют в апоптозе (TRAIL, лиганд Fas) или активации остеокластов (RANKL, лиганд рецептора активатора NF-кВ). При ревматоидном артрите ФНО-а в основном синтезируется синовиальными макрофагами. Активирующие сигналы четко не определены, но могут вовлекать TLR-семейство рецепторов, которые распознают специфические молекулы и активируют врожденный иммунитет и другие цитокины, например ИЛ-15. ФНО-а связывается с двумя повсеместно экспрессированными рецепторами (ФНО-RI и ФНО-RII), таким образом, вызывая секрецию фибробластами других цитокинов и металлопротеаз, уменьшая синтез протеогликанов хондроцитами и способствуя дифференцировке моноцитов в остеокласты в присутствии RANKL. Ингибиторы ФНО-а подавляют симптомы РА, а также уменьшают прогрессирование костных эрозий из-за действия на другие цитокины и остеокласты. Кроме участия в патогенезе данного заболевания, ФНО-а участвует также в ответе макроорганизма на определенные инфекционные агенты. Ингибиторы ФНО-а могут способствовать развитию инфекций, вызываемых условно-патогенными возбудителями, инфицировать реактивации латентного туберкулеза и подавлять противоопухолевый иммунитет
Интерлейкин-1
Интерлейкин-1 (ИЛ-1) активирует воспалительный процесс посредством различных механизмов, в том числе за счет повышения синтеза ИЛ-6, хемокинов, ГМ-КСФА, простагландина и коллагеназы. Ему также принадлежит важная роль в развитии артрита на многих экспериментальных моделях. Из двух форм ИЛ-1 ИЛ-1-b секретируется, тогда как ИЛ-1-a экспрессируется в клетках и связан с клеточными мембранами. Биологически активная форма ИЛ-1-b образуется из белка-предшественника после его расщепления цистеиновой протеазой каспазой-1 (известной nакже как ИЛ-1 конвертирующий фермент — ICE). Действие ИЛ-1 опосредовано рецепторами ИЛ-1 I типа, тогда как IUI-1R2 — рецептор-ловушка, не передающий внутриклеточный сигнал. Главный источник ИЛ-1 в синовиальной оболочке при ревматоидном артрите — макрофаги. Синтез ИЛ-1 индуцируют различные воспалительные факторы, включая ФНО-a, ГМ-КСФ, Fc-фрагменты иммуноглобулинов, фрагменты коллагена и в меньшей степени иммунные комплексы.
Интерлейкин-18
Интерлейкин-18 (ИЛ-18) — провоспалительный представитель семейства ИЛ-1, который индуцирует синтез синовиальными макрофагами у-ИФН, ИЛ-8, ГМ-КСФ и ФНО-a. ИЛ-18 также смещает иммунные ответы Т-клеток к Thl фенотипу. Он экспрессируется главным образом синовиальными фибробластами и макрофагами в ответ на стимуляцию ФНО-a и ИЛ-1. Ингибирование ИЛ-18 значительно снижает коллаген-индуцированный артрит у мышей. Человеческий белок, связывающий ИЛ-18 in vitro, блокирует активность ИЛ-18 и является потенциальным терапевтическим агентом.
Белок — антагонист рецептора интерлейкина-1
При ревматоидном артрите в суставах обнаруживают естественный ингибитор ИЛ-1 — антагонист рецептора ИЛ-1, однако его концентрация слишком мала для подавления активности ИЛ-1. Введение экзогенного белка-антагониста рецептора ИЛ-1 очень эффективно при ИЛ-1-зависимых заболеваниях, таких как системный по началу ювенильный идиопатический артрит, болезнь Стилла взрослых или семейный холодовый аутовоспалительный синдром. Антагонист рецептора ИЛ-1 наряду с другими ИЛ 1-направленными факторами (ингибиторами каспазы-1 и ИЛ-1- связывающими белками) малоэффективен при ревматоидном артрите. Суммируя эти данные, можно предположить, что ИЛ-1 не является центральным цитокином, регулирующим воспаление синовиальной оболочки при данном заболевании.
Семейство интерлейкина-6
Интерлейкин-6 оказывает плейотропное действие и запускает системное воспаление, влияя на гемопоэз и многие типы клеток иммунной системы. Возможно, ИЛ-6 является главным фактором, индуцирующим синтез белков острой фазы, например синтез СРБ печенью. В синовиальной жидкости больных с ревматоидным артитом обнаружены очень высокие концентрации ИЛ-6, при этом их главным источником являются синовиоциты типа В. ИЛ-6 также вовлечен в активацию эндотелия и способствует развитию костных эрозий путем стимуляции созревания остеокластов. При ревматоидном артрите после лечения ингибиторами ФИО уровни ИЛ-6 резко снижаются. Клинические испытания ингибиторов ИЛ-6 показали, что они сопоставимы по эффективности с антагонистами ФНО-а.
Дополнительные цитокины
Количество дополнительных цитокинов и факторов роста, синтезируемых макрофагами и фибробластами при ревматоидном артрите, велико, и их полное описание не входит в задачи этой главы. Например, синовиальная оболочка синтезирует множество С-С, С-Х-С хемокинов, которые привлекают в сустав мононуклеарные клетки и нейтрофилы. ИЛ-15 — макрофагальный цитокин, активирующий Т-клетки и увеличивающий эндогенный синтез ФНО-а. Определенные продукты макрофагов, такие как ИЛ-12, влияют на дифференцировку Т-клеток и смещают клетки к фенотипу Т. Колоние-стимулирующие факторы (макрофагальный и гранулоцито-макрофагальный) синтезируются в синовиальной оболочке как макрофагами, так и фибробластами и увеличивают дифференцировку остеокластов и активацию макрофагов соответственно.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Видео:
Полезно:
Источник
Интерлейкин-6 является одним из важнейших медиаторов острой фазы воспаления. Избыточная продукция интерлейкина 6 вызывает повреждение тканей вследствие аутоиммунной реакции. Например, повреждение суставов при ревматоидном артрите, активирует остеокласты, повреждающие костную ткань.
Маркер воспаления ИЛ-6
 Старение характеризуется хроническим системным воспалением. Одними из важнейших маркеров воспаления являются С-реактивный белок и интерлейкин-6 (ИЛ-6). ИЛ-6 входит в состав секретома сенесцентных клеток или иными словами стареющих клеток (SASP). Вот почему, чем выше уровень ИЛ-6, тем возможно выше уровень стареющих клеток в организме. Чем выше ИЛ-6 в организме, тем выше вероятность перерождения клеток в раковые с их метастазированием.
Старение характеризуется хроническим системным воспалением. Одними из важнейших маркеров воспаления являются С-реактивный белок и интерлейкин-6 (ИЛ-6). ИЛ-6 входит в состав секретома сенесцентных клеток или иными словами стареющих клеток (SASP). Вот почему, чем выше уровень ИЛ-6, тем возможно выше уровень стареющих клеток в организме. Чем выше ИЛ-6 в организме, тем выше вероятность перерождения клеток в раковые с их метастазированием.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/24698728
- www.ncbi.nlm.nih.gov/pubmed/26512918
Как показали исследования, пациенты, у которых уровень ИЛ-6 в плазме крови находился в трети самых высоких значений, имели в 2,48 раза больший риск развития рака толстой кишки по сравнению с пациентами с самыми низкими значениями ИЛ-6. А уменьшение уровня ИЛ-6 в плазме крови всего на 1пг/мл снижает риск рака печени на 12%. Наилучшее значение ИЛ-6 < 1.41. Риск ещё не велик, если ИЛ-6 в диапазоне 1.41-2.56. Но, если ИЛ-6 > 2.56, то риск рака толстой кишки в 2.48 раз выше, чем если ИЛ-6 < 1.41. Рекомендуемое значение ИЛ-6 < 1.41
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/26220152
- www.ncbi.nlm.nih.gov/pubmed/26096712
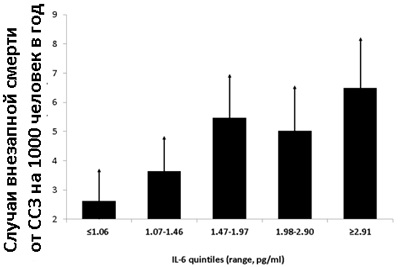 Уровень ИЛ-6 в крови выше 1,5 пг/мл повышает риск внезапной смерти от ССЗ почти в два раза (см. график слева). Люди с анализом крови на ИЛ-6 ниже 1,06 пг/мл имеют риск внезапно умереть от ССЗ в 2,5 раза ниже, чем люди с ИЛ-6 больше чем 2,91 пг/мл.
Уровень ИЛ-6 в крови выше 1,5 пг/мл повышает риск внезапной смерти от ССЗ почти в два раза (см. график слева). Люди с анализом крови на ИЛ-6 ниже 1,06 пг/мл имеют риск внезапно умереть от ССЗ в 2,5 раза ниже, чем люди с ИЛ-6 больше чем 2,91 пг/мл.
Ссылки на исследования и источники:
- www.ncbi.nlm.nih.gov/pubmed/23906927
- www.ncbi.nlm.nih.gov/pubmed/24627113
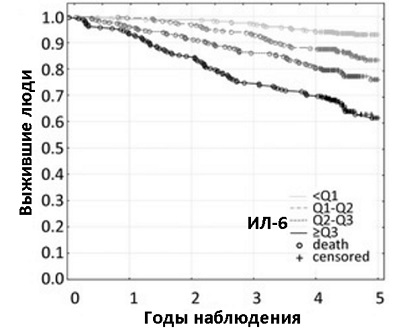
Исследования показывают, что чем выше ИЛ-6, тем выше вероятность внезапно умереть от всех возрастных заболеваний (см. график)
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/23906927
- www.ncbi.nlm.nih.gov/pubmed/24627113
www.ncbi.nlm.nih.gov/pubmed/27274758
Слишком низкий ИЛ-6 также улучшает выживание раковых опухолей, как и высокий. Поэтому вероятно снижать интерлейкин ниже 1 пг/мл также не стоит.
Рекомендуемое значение Ил-6 < 1.07 пг/мл
Методы и средства снижения смертности при повышенном интерлейкине-6:
В результате хронического стресса повышается артериальное давление, повышается уровень воспаления (повышаются воспалительные маркеры интерлейкин-6 и С-реактивный белок в анализах крови), что связано с более высокими рисками умереть от возраст-зависимых заболеваний.
2007 год, University College London. Мета-анализ 2007 года, включающий 30 исследований, показал, что интерлейкин-6 в анализах крови является одним из самых надежных показателей врожденного иммунного ответа на лабораторные стрессоры. Стресс влияет на циркулирующие воспалительные маркеры, и эти эффекты могут стимулировать развитие сердечно-сосудистых заболеваний, а также аутоиммунных заболеваний (псориаз и ревматоидный артрит и др). Мета-анализ также показал небольшое влияние стресса на показатель с-реактивного белка в анализах крови.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/17475444
В свою очередь хронически повышенные маркеры воспаления интерлейкин-6 и с-реактивный белок могут существенно сократить нашу жизнь. Так по данным 2014 года от Колумбийского Университета (США) высокий уровень С-реактивного белка сильно повышает риск внезапной смерти от заболеваний сердца. К тому же по данным 2016 года ученых из Польши повышенный С-реактивный белок хорошо предсказывает риск развития возраст зависимых заболеваний и продолжительность жизни человека даже после поправок на возраст, пол, индекс массы тела и курение.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/24627113
- www.ncbi.nlm.nih.gov/pubmed/27274758
Мета-анализ 2015 года показал, что пациенты, у которых уровень интерлейкин-6 в плазме крови находился в трети самых высоких значений, имели в 2,48 раза больший риск развития рака толстой кишки по сравнению с пациентами с самыми низкими значениями интерлейкина-6. А мета-анализ 2015 года (Университет Биньчжоу Китай) показал, что уменьшение уровня интерлейкина-6 в плазме крови всего на 1 пг/мл снижает риск рака печени на 12%. Исследование с участием 5806 пациентов (Университет Мэриленда 2013 года — показало, что уровень интерлейкина-6 в крови выше 1,06 пг/мл повышает риск внезапной смерти от ССЗ почти в два раза.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/26220152
- www.ncbi.nlm.nih.gov/pubmed/26096712
- www.ncbi.nlm.nih.gov/pubmed/23906927
Ежедневная (а не от случая к случаю) медитация понижает индуцированные стрессом уровни воспалительных маркеров (интерлейкин-6 и с-реактивный белок) и артериальное давления.
 2018 год, Китайский Университет Гонконга, Китай, Гарвардская медицинская школа, США. Мета-анализ РКИ из 7 электронных баз данных (SPORTDiscus, PubMed, PsycINFO, Cochrane Library, Web of Science, CNKI, and Wanfang). «meditative movements may be effective interventions to alleviate MDD symptoms» — медитация может быть эффективным вмешательством для симптоматического лечения большого депрессивного расстройства. «Given the fact that meditative movements are safe and easily accessible, clinicians may consider recommending meditative movements for patients of MDD» Учитывая тот факт, что медитативные движения безопасны и легкодоступны, врачи могут рекомендовать медитативные движения для пациентов с большим депрессивным расстройством
2018 год, Китайский Университет Гонконга, Китай, Гарвардская медицинская школа, США. Мета-анализ РКИ из 7 электронных баз данных (SPORTDiscus, PubMed, PsycINFO, Cochrane Library, Web of Science, CNKI, and Wanfang). «meditative movements may be effective interventions to alleviate MDD symptoms» — медитация может быть эффективным вмешательством для симптоматического лечения большого депрессивного расстройства. «Given the fact that meditative movements are safe and easily accessible, clinicians may consider recommending meditative movements for patients of MDD» Учитывая тот факт, что медитативные движения безопасны и легкодоступны, врачи могут рекомендовать медитативные движения для пациентов с большим депрессивным расстройством
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/30071662
 2018 год, Всеиндийский Институт медицинских наук (АИИМС), Нью-Дели и Институт медицинской психологии, Отто-фон-Герикский Университет Магдебурга, медицинский факультет, Германия. 21 двойное рандомизированное контролируемое исследование с участием 90 пациентов в экспериментальной группе и 90 в контрольной группе (старше 45 лет). Медитация осознанности снижала внутриглазное давление при глаукоме, а также изменила в крови уровни биомаркеров связанных со стрессом: кортизол (с 497,3 до 392,3 нг/мл), интерлейкин-6 (с 2,8 до 1,5 нг/мл), фактор некроза опухоли альфа TNF-α (с 57,1 до 45,4 пг/мл), β-эндорфины (с 38.4 до 52.7 пг/мл), BDNF (с 56.1 до 83.9 нг/мл) и другие.
2018 год, Всеиндийский Институт медицинских наук (АИИМС), Нью-Дели и Институт медицинской психологии, Отто-фон-Герикский Университет Магдебурга, медицинский факультет, Германия. 21 двойное рандомизированное контролируемое исследование с участием 90 пациентов в экспериментальной группе и 90 в контрольной группе (старше 45 лет). Медитация осознанности снижала внутриглазное давление при глаукоме, а также изменила в крови уровни биомаркеров связанных со стрессом: кортизол (с 497,3 до 392,3 нг/мл), интерлейкин-6 (с 2,8 до 1,5 нг/мл), фактор некроза опухоли альфа TNF-α (с 57,1 до 45,4 пг/мл), β-эндорфины (с 38.4 до 52.7 пг/мл), BDNF (с 56.1 до 83.9 нг/мл) и другие.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/30256277
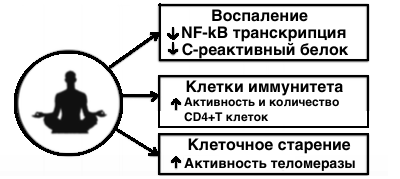 2016 год, Университет Южной Калифорнии, США. Систематический обзор РКИ влияния медитации осознанности на параметры иммунной системы. Был выполнен поиск по электронным базам данных PubMed, Ovid, PsycINFO, Web of Science и Google Scholar. Были отобрано 20 РКИ с участием 1602 человек, которые соответствовали заданным критериям. Медитация осознанности снижала маркер воспаления С-реактивный белок — «we identified mindfulness mediation-related effects for the following four parameters: reductions in the activity of the cellular transcription factor NF-kB, reductions in circulating levels of CRP, increases in CD4+ T cell count (in HIV-diagnosed individuals), and increases in telomerase activity»
2016 год, Университет Южной Калифорнии, США. Систематический обзор РКИ влияния медитации осознанности на параметры иммунной системы. Был выполнен поиск по электронным базам данных PubMed, Ovid, PsycINFO, Web of Science и Google Scholar. Были отобрано 20 РКИ с участием 1602 человек, которые соответствовали заданным критериям. Медитация осознанности снижала маркер воспаления С-реактивный белок — «we identified mindfulness mediation-related effects for the following four parameters: reductions in the activity of the cellular transcription factor NF-kB, reductions in circulating levels of CRP, increases in CD4+ T cell count (in HIV-diagnosed individuals), and increases in telomerase activity»
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4940234
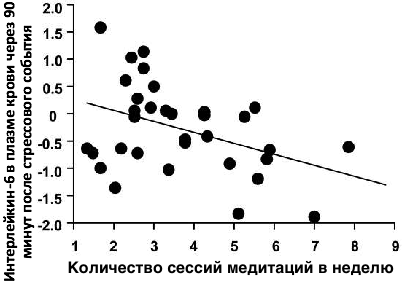 2010 год, Университет Эмори, США. РКИ с участием 61 здорового человека (17-19 лет) в течение 6 недель. Недавний мета-анализ показал, что воспалительный маркер интерлейкин-6 является одним из самых надежных показателей врожденного иммунного ответа на стрессоры, такие как, например, публичное выступление и т.п. В данном исследовании испытуемые практиковали медитацию сострадания в среднем по 20 минут за один сеанс. Если медитация была не ежедневной, то интерлейкин-6 в крови не снижался. Интерлейкин-6 снижался только среди тех испытуемых, которые медитировали ежедневно и чаще — «Post-hoc analyses indicated that participants in the high practice group had significantly reduced maximal TSST-induced IL-6 responses as well as reduced TSST-induced IL-6 responses expressed as AUCg when compared to participants in the low practice group» «effect of compassion meditation on stress responses is dose dependent and only apparent in individuals who commit to some minimum amount of practice time»
2010 год, Университет Эмори, США. РКИ с участием 61 здорового человека (17-19 лет) в течение 6 недель. Недавний мета-анализ показал, что воспалительный маркер интерлейкин-6 является одним из самых надежных показателей врожденного иммунного ответа на стрессоры, такие как, например, публичное выступление и т.п. В данном исследовании испытуемые практиковали медитацию сострадания в среднем по 20 минут за один сеанс. Если медитация была не ежедневной, то интерлейкин-6 в крови не снижался. Интерлейкин-6 снижался только среди тех испытуемых, которые медитировали ежедневно и чаще — «Post-hoc analyses indicated that participants in the high practice group had significantly reduced maximal TSST-induced IL-6 responses as well as reduced TSST-induced IL-6 responses expressed as AUCg when compared to participants in the low practice group» «effect of compassion meditation on stress responses is dose dependent and only apparent in individuals who commit to some minimum amount of practice time»
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC2695992
2018 год. Повышенное артериальное давление является наиболее распространенным хроническим заболеванием в США и в РФ, а также основной причиной смертности. В рандомизированном контролируемом исследовании 66 взрослых человек с предгипертензией медитировали 2 раза в день по 5, по 10, по 15 минут в течение 6 месяцев. Медитирующие два раза в сутки по 15 минут (в сумме 30 минут) наблюдали снижение артериального давления.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/30010353
Дефицит витамин D связан с повышением воспалительных маркеров
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/24198585
Аспирин в терапевтических дозах понижает ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/27999284
- www.ncbi.nlm.nih.gov/pubmed/27557515
- www.ncbi.nlm.nih.gov/pubmed/27504605
Доксициклин снижает ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/28178994
Пропранолол снижает ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/25843793
Сульфорафан из брокколи снижает ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/20233902
Диета, имитирующая голодания (FMD) снижает ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/28202779
Очень лёгкий бег трусцой 3 раза в неделю в течении 6 месяцев, а также омега-3 1000 мг в сутки синергично снижают уровень ИЛ-6
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/21999620
Меня часто спрашивают, где я сдаю анализы. Раньше я сдавал некоторые анализы через поликлинику. Но сейчас это стало проблемно. Я живу в Москве. В Москве хорошая лаборатория по соотношению цена-качество на мой взгляд — ДНКОМ — ссылка на лабораторию ДНКОМ. Я не сдаю анализы в непроверенных лабораториях, так как некоторые виды анализов в них делают крайне некорректно. Если у Вас возникнут вопросы по лаборатории ДНКом, то вы можете их задать напрямую директору ДНКом и получить оперативный ответ — Диалог с Андреем Исаевым — директором ДНКом
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
Уважаемые читатели ресурса www.nestarenie.ru. Если Вы думаете, что статьи настоящего ресурса полезны для Вас, и желаете, чтобы этой информацией могли пользоваться и другие люди многие годы, то имеет возможность помочь в развитии этого сайта, потратив на это около 2-х минут Вашего времени. Для этого кликните по этой ссылке.
Рекомендуем ещё почитать следующие статьи:
- Метформин — самое изученное лекарство, которое может продлевать жизнь, если назначено врачом оп показаниям.
- Подробная программа продления жизни научно обоснованными способами.
- Витамин K2 (МК-7) сокращает смертность
- Витамин B6+магний снижают смертность на 34%
- Глюкозамин Сульфат эффективно продлевает жизнь и защищает от многих видов рака
- Фолаты для предупреждения раннего старения
- Как победить метилглиоксаль — вещество, которое нас старит.
Источник
1. Насонов ЕЛ, Каратеев ДЕ, Балабанова РМ. Ревматоидный артрит. В кн.: Насонов ЕЛ, Насонова ВА, редакторы. Ревматология. Национальное руководство. Москва: ГЭОТАР-Медиа; 2008. С. 290-331.
2. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. New Eng J Med. 2012;365:2205-19. doi: 10.1056/NEJMra1004965
3. Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016 22;388(10055):2023-38. doi: 10.1016/S0140-6736(16)30173-8
4. Насонов ЕЛ, редактор. Генно-инженерные биологические препараты в лечении ревматоидного артрита. Москва, ИМА-ПРЕСС; 2013.
5. Burmester GR, Pope JE. Novel treatment strategies in rheumatoid arthritis. Lancet. 2017;389(10086):2338-48. doi: 10.1016/S0140-6736(17)31491-5
6. Насонов ЕЛ. Фармакотерапия ревматоидного артрита: новая стратегия, новые мишени. Научно-практическая ревматология. 2017;55(4):409-19. doi: 10.14412/1995-4484-2017-409-419
7. Baker KF, Isaacs JD. Novel therapies for immune-mediated inflammatory diseases: What can we learn from their use in rheumatoid arthritis, spondyloarthritis, systemic lupus erythematosus, psoriasis, Crohn’s disease and ulcerative colitis? Ann Rheum Dis. 2018;77(2):175-87. doi: 10.1136/annrheumdis-2017-211555
8. McInnes IB, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis. Lancet. 2017;389(10086):2328-37. doi: 10.1016/S0140-6736(17)31472-1
9. Hunter CA, Jones SA. IL-6 as a keystone cytokine in health and disease. Nat Immunol. 2015;15:448-57. doi: 10.1038/ni1117-1271b
10. Насонов ЕЛ, Лила АМ. Ингибиция интерлейкина 6 при иммуновоспалительных ревматических заболеваниях: достижения, перспективы и надежды. Научно-практическая ревматология. 2017;55(6):590-9. doi: 10.14412/1995-4484-2017-590-599
11. Garbers C, Heink S, Korn T, Rose-John S. Interleukin-6: designing specific therapeutics for a complex cytokine. Nat Rev Drug Discov. 2018;17(6):395-412. doi: 10.1038/nrd.2018.45
12. Rubbert-Roth A, Furst DE, Nebesky JM, et al. A review of recent advances using tocilizumab in the treatment of rheumatic diseases. Rheumatol Ther. 2018;5(1):21-42. doi: 10.1007/s40744-018-0102-x
13. Lamb YN, Deeks ED. Sarilumab: A Review in Moderate to Severe Rheumatoid Arthritis. Drugs. 2018;78(9):929-40. doi: 10.1007/s40265-018-0929-z
14. McCarty D, Robinson A. Efficacy and safety of sarilumab in patients with active rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2018;10(3):61-7. doi: 10.1177/1759720X17752037
15. Genentech Inc. Actemra (package insert). California: Genentech Inc, https://www.gene.com/download/pdf/actemra_prescribing.pdf (2017, accessed 15 September 2017).
16. Regeneron Pharmaceuticals Inc / Sanofi-aventis US LLC. Kevzara (package insert). New York/New Jersey: Regeneron Pharmaceuticals Inc / Sanofi-aventis US LLC, https://products.sanofi.us/kevzara/kevzara.pdf (2017, accessed 10 September 2017).
17. Huizinga TW, Fleischmann RM, Jasson M, et al. Sarilumab, a fully human monoclonal antibody against IL-6Ra in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results for the randomized SARIK-RA-MOBILITY part A trial. Ann Rheum Dis. 2014;73:1626-34. doi: 10.1136/annrheumdis-2013-204405
18. Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: results of a phase III study. Arthritis Rheum. 2015;67:1424-37. doi: 10.1002/art.39093
19. Fleischmann R, van Adelsberg J, Lin Y, et al. Sarilumab and nonbiologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheum. 2017;69:277-90. doi: 10.1002/art.39944
20. Burmester GR, Lin YL, Patel R, et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomized, double-blind, parallel-group phase III trial. Ann Rheum Dis. 2017;76:840-7. doi: 10.1136/annrheumdis-2016-210310
21. Wells AF, Parrino J, Mangan EK, et al. Immunogenicity of sarilumab monotherapy in patients with rheumatoid arthritis who were inadequate responders or intolerant to disease-modifying antirheumatic drugs. Rheumatol Ther. 2019 May 14. doi: 10.1007/s40744-019-0157
22. Emery P, Rondon J, Parrino J, et al. Safety and tolerability of subcutaneous sarilumab and intravenous tocilizumab in patients with rheumatoid arthritis. Rheumatology (Oxford). 2018 Dec 19. doi: 10.1093/rheumatology/key361
23. Genovese MC, van Adelsberg J, Fan C, et al.; EXTEND study investigators. Two years of sarilumab in patients with rheumatoid arthritis and an inadequate response to MTX: safety, efficacy and radiographic outcomes. Rheumatology (Oxford). 2018;57(8):1423-31. doi: 10.1093/rheumatology/key121
24. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006;54(1):26-37. doi: 10.1002/art.21519
25. Emery P, Pope JE, Kruger K, et al. Efficacy of monotherapy with biologics and JAK inhibitors for the treatment of rheumatoid arthritis: A systematic review. Adv Ther. 2018;35(10):1535-63. doi: 10.1007/s12325-018-0757-2
26. Burmester GR, St John G, Iglesias-Rodrigues M, et al. Switching from adalimumab to sarilumasb is associated with comparable efficacy bit lower functional improvement versus comtinous earilumab monotherapy thtough 48-week open-label extension (OLE) of the phase III MONARCH rial. Ann Rheum Dis. 2018;77(Suppl 2):952-3. doi: 10.1136/annrheumdis-2018-eular.1372
27. Tanaka Y, Wada K, Takahashi Y, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: results of a randomized, placebo-controlled phase III trial in Japan. Arthritis Res Ther. 2019;21(1):79. doi: 10.1186/s13075-019-1856-4
28. Kameda H, Wada K, Takahashi Y, et al. Sarilumab monotherapy or in combination with non-methotrexate disease-modifying antirheumatic drugs in active rheumatoid arthritis: A Japan phase 3 trial (HARUKA). Mod Rheumatol. 2019 Jul 24. doi: 10.1080/14397595.2019.1639939
29. Genovese MC, Fleischmann R, Mangan E, et al. Efficacy and safety of Sarilumab in subgroups of patients with rheumatoid arthritis from 2 phase 3 studies [abstract]. Arthritis Rheum. 2016;68(suppl 10). Available from: https://acrabstracts.org/abstract/efficacy-and-safety-of-sarilumab-in-subgroups-of-patients-with-rheumatoid-arthritis-from-2-phase-3-studies/
30. Genovese MC, van der Heijde D, Lin Y, et al. Long-term safety and efficacy of sarikumab plus methotrexate on disease activity, physical function and radiographic progression: 5 years of sarilumab plus methotrexate treatment. RMD Open. 2019;5:e000887. doi: 10:1136/rmdopen-2018-000887
31. Burmester GR, Lin Y, St John G, et al. Long-term efficacy with 5-year-radiographic results and safety of sarilumab in combination with csDMARD in patients with rheumatoid arthritis. Ann Rheum Dis. 2018. doi: 10.1136/qnnrheumdis-20180eular.SAT0172
32. Curtis JR, Lin Y, Thangsvelu K, et al. Withdrawal of conventional synthetic disease-modifying antitheumatic drugs in the sarilumab open-label EXTEND study: efficacy and safety analysis. Ann Rheum Dis. 2019;78(Suppl 2):702-3. doi: 10.1136/annrheumdis-2019-eular.740
33. Emery P, van Hoogstraten H, Jayawardena S, et al. Efficacy of Sarilumab in Patients with Rheumatoid Arthritis Who Previously Received Sarilumab or Tocilizumab [abstract]. Available from: https://acrabstracts.org/abstract/efficacy-of-sarilumab-in-patients-with-rheumatoid-arthritis-who-previously-received-sarilumab-or-tocilizumab/
34. Vershueren P, Emery P, van Hoogstraten H, et al. Efficaсy of sarilumab in patients with rheumatoid arthritis with and without previous response to tocilizumab. Ann Rheum Dis. 2018;77(Suppl.2):327. https://doi.org/10.1136/annrheumdis-2018-eular.1376
35. Насонов ЕЛ, Станислав МЛ, Раскина ТА и др. Эффективность и безопасность сарилумаба в комбинации с метотрексатом у пациентов с активным ревматоидным артритом и неадекватным эффектом монотерапии метотрексатом (результаты исследования III фазы по протоколу MOBILITY). Научно-практическая ревматология. 2019;57(2):142-8. doi: 10.14412/1995-4484-2019-142-148
36. Food and Drug Administration (2009) Guidance for industry. Patient-reported outcome measures: use in medical product development to support labeling claims. Available from: https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM193282.pdf
37. Gossec L, Dougados M, Dixon W. Patient-reported outcomes as end points in clinical trials in rheumatoid arthritis. RMD Open. 2015;1(1):e000019. doi: 10.1136/rmdopen-2014-000019
38. Fautrel B, Alten R, Kirkham B, et al. Call for action: how to improve use of patient-reported outcomes to guide clinical decision making in rheumatoid arthritis. Rheumatol Int. 2018;38(6):935-47. doi: 10.1007/s00296-018-4005-5
39. Strand V, Khanna D. The impact of rheumatoid arthritis and treatment on patients’ lives. Clin Exp Rheumatol. 2010;28:S32-40.
40. Rendas-Baum R, Bayliss M, Kosinski M, et al. Measuring the effect of therapy in rheumatoid arthritis clinical trials from the patient’s perspective. Curr Med Res Opin. 2014;30:1391-403. doi: 10.1185/03007995.2014.896328
41. Matcham F, Scott IC, Rayner L, et al. The impact of rheumatoid arthritis on quality-of-life assessed using the SF-36: a systematic review and meta-analysis. Semin Arthritis Rheum. 2014;44:123-30. doi: 10.1016/j.semarthrit.2014.05.001
42. Насонов ЕЛ, Олюнин ЮА, Лила АМ. Ревматоидный артрит: проблемы ремиссии и резистентности к терапии. Научно-практическая ревматология. 2018;56(3):263-71. doi: 10.14412/1995-4484-2018-263-271
43. Choy EHS, Calabrese LH. Neuroendocrine and neurophysiological effects of interleukin 6 in rheumatoid arthritis. Rheumatology (Oxford). 2018;57(11):1885-95. doi: 10.1093/rheumatology/kex391
44. Каратеев А.Е., Насонов Е.Л. Хроническая боль и центральная сенситизация при иммуновоспалительных ревматических заболеваниях: патогенез, клинические проявления, возможность применения таргетных базисных противовоспалительных препаратов. Научно-практическая ревматология. 2019;57(2):197-209. doi: 10.14412/1995-4484-2019-197-209
45. Лисицына ТА, Вельтищев ДЮ, Серавина ОФ и др. Провоспалительные цитокины и депрессия при ревматоидном артрите. Научно-практическая ревматология. 2013;51(3):261-6. doi: 10.14412/1995-4484-2013-1498
46. Лисицына ТА, Вельтищев ДЮ, Лила АМ, Насонов ЕЛ. Интерлейкин 6 как патогенетический фактор, опосредующий формирование клинических проявлений, и мишень для терапии ревматических заболеваний и депрессивных расстройств. Научно-практическая ревматология. 2019;57(3):318-27. doi: 10.14412/1995-4484-2019-318-32747.
47. Crotti C, Biggioggero M, Becciolini A, Favalli EG. Sarilumab: patient-reported outcomes in rheumatoid arthritis. Patient Relat Outcome Meas. 2018;9:275-84. doi: 10.2147/PROM.S147286
48. Strand V, Kosinski M, Chen CI, et al. Sarilumab plus methotrexate improves patient-reported outcomes in patients with active rheumatoid arthritis and inadequate responses to methotrexate: results of a phase III trial. Arthritis Res Ther. 2016;18:19. doi: 10.1186/s13075-016-1096-9
49. Kosinski M, Zhao SZ, Dedhiya S, et al. Determining minimally important changes in generic and disease-specific health-related quality of life questionnaires in clinical trials of rheumatoid arthritis. Arthritis Rheum. 2000;43(7):1478-87. doi: 10.1002/1529-0131(200007)43:7<1478::AID-ANR10>3.0.CO;2-M
50. Gossec L, Strand V, Proudfoot C, et al. Effects of Sarilumab on rheumatoid arthritis as reported by patients using the rheumatoid arthritis impact of disease scale. J Rheumatol. 2019 Mar 15. doi: 10.3899/jrheum.180904
51. Dougados M, Brault Y, Logeart I, et al. Defining cut-off values for disease activity states and improvement scores for patient-reported outcomes: the example of the Rheumatoid Arthritis Impact of Disease (RAID). Arthritis Res Ther. 2012;14(3):R129. doi: 10.1186/ar3859
52. Gullick NJ, Scott DL. Rheumatoid arthritis: clinical utility of the RAID (RA Impact of Disease) score. Nat Rev Rheumatol. 2011;7:499-500. doi: 10.1038/nrrheum.2011.105
53. Heiberg T, Austad C, Kvien TK, Uhlig T. Performance of the Rheumatoid Arthritis Impact of Disease (RAID) score in relation to other patient-reported outcomes in a register of patients with rheumatoid arthritis. Ann Rheum Dis. 2011;70:1080-2. doi: 10.1136/ard.2010.143032
54. Gossec L, Paternotte S, Aanerud GJ, et al. Finalisation and validation of the Rheumatoid Arthritis Impact of Disease score, a patient-derived composite measure of impact of rheumatoid arthritis: A EULAR initiative. Ann Rheum Dis. 2011;70:935-42. doi: 10.1136/ard.2010.142901
55. Strand V, Gossec L, Proudfoot CWJ, et al. Patient-reported outcomes from a randomized phase III trial of sarilumab monotherapy versus adalimumab monotherapy in patients with rheumatoid arthritis. Arthritis Res Ther. 2018;20(1):129. doi: 10.1186/s13075-018-1614-z
56. Gossec L, Boklage S, St John G, et al. Pain is improved in around 50% of patients and fatigue in 40% of patients with rheumatoid arthritis treated with sarilumab in the target, mobility and monarch trials [abstract]. Arthritis Rheum. 2018;70(suppl 10). Available from: https://acrabstracts.org/abstract/pain-is-improved-in-around-50-of-patients-and-fatigue-in-40-of-patients-with-rheumatoid-arthritis-treated-with-sarilumab-in-the-target-mobility-and-monarch-trials/
57. Choy E, Freemantle N, Proudfoot C, et al. Evaluation of the efficacy and safety of sarilumab combination therapy in patients with rheumatoid arthritis with inadequate response to conventional disease-modifying antirheumatic drugs or tumour necrosis factor α inhibitors: systematic literature review and network meta-analyses. RMD Open. 2019 18;5(1):e000798. doi: 10.1136/rmdopen-2018-000798
58. Choy E, Freemantle N, Proudfoot C, et al. Indirect treatment comparison of the efficacy and safety of Sarilumab monotherapy in rheumatoid arthritis patients with inadequate response to conventional disease-modifying antirheumatic drugs. Adv Ther. 2019;36(4):817-27. doi: 10.1007/s12325-019-00912-x
59. Boyapati A, Msihid J, Fiore S, et al. Sarilumab plus methotrexate suppresses circulating biomarkers of bone resorption and synovial damage in patients with rheumatoid arthritis and inadequate response to methotrexate: a biomarker study of MOBILITY. Arthritis Res Ther. 2016;18:225.
60. Gabay C, Msihid J, Zilberstein M, et al. Identification of sarilumab pharmacodynamic and predictive markers in patients with inadequate response to TNF inhibition: a biomarker substudy of the phase 3 TARGET study. RMD Open. 2018;4(1):e000607. doi: 10.1136/rmdopen-2017-000607
61. Dennis G, Holweg CT, Kummerfeld SK, et al. Synovial phenotypes in rheumatoid arthritis correlate with response to biologic therapeutics. Arthritis Res Ther. 2014;16:R90. doi: 10.1186/ar4555
62. Choi IY, Gerlag DM, Herenius MJ, et al. MRP8/14 serum levels as a strong predictor of response to biological treatments in patients with rheumatoid arthritis. Ann Rheum Dis. 2015;74:499-505. doi: 10.1136/annrheumdis-2013-203923
63. Ferraccioli G, Tolusso B, Bobbio-Pallavicini F, et al. Biomarkers of good EULAR response to the B cell depletion therapy in all seropositive rheumatoid arthritis patients: clues for the pathogenesis. PLoS One. 2012;7:e40362. doi: 10.1371/journal.pone.0040362
64. Han BK, Kuzin I, Gaughan JP, et al. Baseline CXCL10 and CXCL13 levels are predictive biomarkers for tumor necrosis factor inhibitor therapy in patients with moderate to severe rheumatoid arthritis: A pilot, prospective study. Arthritis Res Ther. 2016;18:93. doi: 10.1186/s13075-016-0995-0
65. Koczan D, Drynda S, Hecker M, et al. Molecular discrimination of responders and nonresponders to anti-TNF alpha therapy in rheumatoid arthritis by etanercept. Arthritis Res Ther. 2008;10:R50. doi: 10.1186/ar2419
66. Karsdal MA, Schett G, Emery P, et al. IL-6 receptor inhibition positively modulates bone balance in rheumatoid arthritis patients with an inadequate response to anti-tumor necrosis factor therapy: biochemical marker analysis of bone metabolism in the tocilizumab RADIATE study (NCT00106522). Semin Arthritis Rheum. 2012;42:131-9. doi: 10.1016/j.semarthrit.2012.01.004
67. Boumans MJ, Thurlings RM, Yeo L, et al. Rituximab abrogates joint destruction in rheumatoid arthritis by inhibiting osteoclastogenesis. Ann Rheum Dis. 2012;71:108-13. doi: 10.1136/annrheumdis-2011-200198
68. Yasunori K, Masaaki T, Tetsuyuki N, et al. Reduction of urinary levels of pyridinoline and deoxypyridinoline and serum levels of soluble receptor activator of NF-kappaB ligand by etanercept in patients with rheumatoid arthritis. Clin Rheumatol. 2008;27:1093-101. doi: 10.1007/s10067-008-0870-8
69. Cohen SB, Dore RK, Lane NE, et al. Denosumab treatment effects on structural damage, bone mineral density, and bone turnover in rheumatoid arthritis: a twelve-month, multicenter, randomized, double-blind, placebo-controlled, phase II clinical trial. Arthritis Rheum. 2008;58:1299-309. doi: 10.1002/art.23417
70. Boyapati A, Msihid J, Schwartzman S, et al. High baseline serum IL-6 identies a subgroup of rheumatoid arthritis patients with rapid joint damage and clinical progression and predicts increased sarilumab treatment response [abstract]. Arthritis Rheum. 2018 Oct;70(Suppl 10). Available from: https://acrabstracts.org/abstract/high-baseline-serum-il-6-identifies-a-subgroup-of-rheumatoid-arthritis-patients-with-rapid-joint-damage-and-clinical-progression-and-predicts-increased-sarilumab-treatment-response/
71. Wang J, Devenport J, Low JM, et al. Relationship between base-line and early changes in C-reactive protein and interleukin-6 levels and clinical response to tocilizumab in rheumatoid arthritis. Arthritis Care Res. 2016;68:882-5. doi: 10.1002/acr.22765
72. Burmester GR, Hagino O, Dong Q, et al. Unique Changes in Hemoglobin with Sarilumab Versus Adalimumab Are Independent of Better Disease Control in Patients with Rheumatoid Arthritis (RA) [abstract]. Arthritis Rheum. 2018;70 (suppl 10). Available from: https://acrabstracts.org/abstract/unique-changes-in-hemoglobin-with-sarilumab-versus-adalimumab-are-independent-of-better-disease-control-in-patients-with-rheumatoid-arthritis-ra/
73. Genovese MC, Fleischmann R, Hagino O, et al. The effect of Sarilumab in combination with dmards on fasting glucose and glycosylated hemoglobin in patients with rheumatoid arthritis with and without diabetes [abstract]. Arthritis Rheum. 2017;69(Suppl 10).
74. Winthrop KL. Infections and biologic therapy in rheumatoid arthritis: our changing understanding of risk and prevention. Rheum Dis Clin North Am. 2012;38(4):727-45. doi: 10.1016/j.rdc.2012.08.019
75. Fleischmann R, Genovese MC, Lin Y, et al. Long-term safety of sarilumab in rheumatoid arthritis: an integrated analysis with up to 7 years’ follow-up. Rheumatology (Oxford). 2019 Jul 15. pii: kez265. doi: 10.1093/rheumatology/kez265
76. Genovese MC, Rubbert-Roth A, Smolen JS, et al. Longterm safety and efficacy of tocilizumab in patients with rheumatoid arthritis: a cumulative analysis of up to 4.6 years of exposure. J Rheumatol. 2013;40:768-80. doi: 10.3899/jrheum.120687
77. Kovalenko P, Paccaly A, Boyapati A, et al. Pharmacodynamic (PD) model of neutrophil margination to describe transient effect of single-dose sarilumab on absolute neutrophil count (ANC) in patients with rheumatoid arthritis (RA). J Pharmacokinet Pharmacodyn. 2017;44(Suppl 1):S11-S143. Abstract T-033.
78. Lok LSC, Farahi N, Juss JK et al. Effects of tocilizumab on neutrophil function and kinetics. Eur J Clin Invest. 2017;47:736-45. doi: 10.1111/eci.12799
79. Wright HL, Cross AL, Edwards SW, Moots RJ. Effects of IL-6 and IL-6 blockade on neutrophil function in vitro and in vivo. Rheumatology. 2014;53:1321-31. doi: 10.1093/rheumatology/keu035
80. Choy E, Ganeshalingam K, Semb AG, et al. Cardiovascular risk in rheumatoid arthritis: recent advances in the understanding of the pivotal role of inflammation, risk predictors and the impact of treatment. Rheumatology. 2014;53:2143-54. doi: 10.1093/rheumatology/keu224
81. Ogdie A, Yu Y, Haynes K, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis. 2015;74:326-32. doi: 10.1136/annrheumdis-2014-205675
82. Liao KP, Liu J, Lu B, et al. Association between lipid levels and major adverse cardiovascular events in rheumatoid arthritis compared to non-rheumatoid arthritis patients. Arthritis Rheum. 2015;67:2004-10. doi: 10.1002/art.39165
83. Hartman J, Frishman WH. Inflammation and atherosclerosis: a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy. Cardiol Rev. 2014;22:147-51. doi: 10.1097/CRD.0000000000000021
84. Ridker PM. From C-reactive protein to interleukin-6 to interleukin-1: moving upstream to identify novel targets for atheroprotection. Circ Res. 2016;118:145-56. doi: 10.1161/CIRCRESAHA.115.306656
85. Насонов ЕЛ, Попкова ТВ. Противовоспалительная терапия атеросклероза – вклад и уроки ревматологии. Научно-практическая ревматология. 2017;55(5):465-73. doi: 10.14412/1995-4484-2017-465-473
86. Charles-Schoeman C, St John G, Leher H, et al. The relationship between lipid profile changes and inflammation across the Phase 3 sarilumab rheumatoid arthritis (RA) development programme. Rheumatology. 2019;58(Suppl 3):kez110.062, E064. doi: 10.1093/rheumatology/kez110.062
87. Curtis JR, Lanas A, John A, et al. Factors associated with gastrointestinal perforation in a cohort of patients with rheumatoid arthritis. Arthritis Care Res. 2012;64:1819-28. doi: 10.1002/acr.21764
88. Gout T, Ostor AJ, Nisar MK. Lower gastrointestinal perforation in rheumatoid arthritis patients treated with conventional DMARDs or tocilizumab: a systematic literature review. Clin Rheumatol. 2011;30:1471-4. doi: 10.1007/s10067-011-1827-x
89. Scott IC, Hider SL, Scott DL. Thromboembolism with Janus kinase (JAK) inhibitors for rheumatoid arthritis: how real is the risk? Drug Saf. 2018;41:645-53. doi: 10.1007/s40264-018-0651-5
90. Ungprasert P, Srivali N, Spanuchart I, et al. Risk of venous thromboembolism in patients with rheumatoid arthritis: a systematic review and meta-analysis. Clin Rheumatol. 2014;33:297-304. doi: 10.1007/s10067-014-2492-7
91. Сатыбалдыева МА. Ревматоидный артрит и венозные тромбоэмболические осложнения. Научно-практическая ревматология. 2016;54(4):456-62. doi: 10.14412/1995-4484-2016-456-462
92. Насонов ЕЛ, Лила АМ. Ингибиторы Янус-киназ при иммуновоспалительных ревматических заболеваниях: новые возможности и перспективы. Научно-практическая ревматология. 2019;57(1):8-16. doi: 10.14412/1995-4484-2019-8-16
93. Gadina M, Johnson C, Schwartz D, et al. Translational and clinical advances in JAK-STAT biology: The present and future of jakinibs. J Leukoc Biol. 2018;104(3):499-514. doi: 10.1002/JLB.5RI0218-084R
94. Qu X, Tang Y, Hua S. Immunological approaches towards cancer and inflammation: A Cross Talk. Front Immunol. 2018;9:563. doi: 10.3389/fimmu.2018.00563
95. Johnson DE, O’Keefe RA, Grandis JR. Targeting the IL-6/JAK/STAT3 signalling axis in cancer. Nat Rev Clin Oncol. 2018;15(4):234-48. doi: 10.1038/nrclinonc.2018.8
96. Genovese MC, Kremer JM, van Vollenhoven RF et al.Transaminase levels and hepatic events during tocilizumab treatment: pooled analysis of long-term clinical trial safety data in rheumatoid arthritis. Arthritis Rheum. 2017;69:1751-61. doi: 10.1002/art.40176
97. Smolen JS, Landewe R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017;76(6):960-77. doi: 10.1136/annrheumdis-2016-210715
98. Насонов ЕЛ, редактор. Ревматология. Российские клинические рекомендации. Москва: ГЭОТАР-Медиа; 2017. 464 с.
99. Emery P, Sebba A, Huizinga TW. Biologic and oral disease-modifying antirheumatic drug monotherapy in rheumatoid arthritis. Ann Rheum Dis. 2013;72(12):1897-904. doi: 10.1136/annrheumdis-2013-203485
100. Schaeverbeke T, Truchetet ME, Kostine M, et al. Immunogenicity of biologic agents in rheumatoid arthritis patients: lessons for clinical practice. Rheumatology (Oxford). 2016;55(2):210-20. doi: 10.1093/rheumatology/kev277
101. Kalden JR, Schulze-Koops H. Immunogenicity and loss of response to TNF inhibitors: implications for rheumatoid arthritis treatment. Nat Rev Rheumatol. 2017;13(12):707-18. doi: 10.1038/nrrheum.2017
Источник


