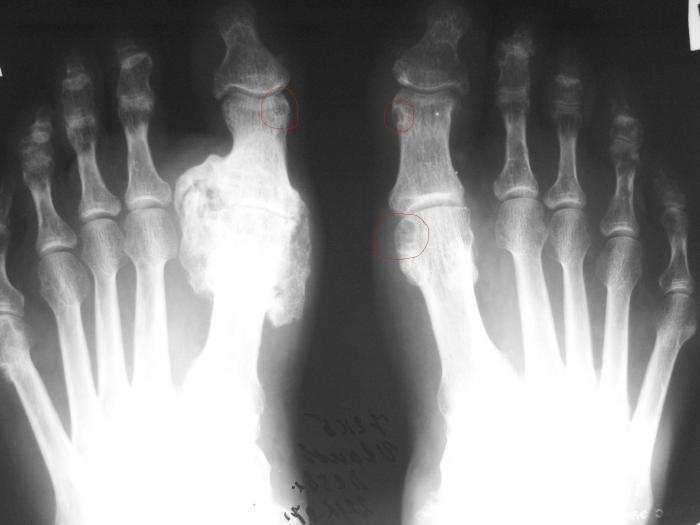
Какие бактерии вызывают ревматоидный артрит
Инфекционный артрит – воспалительное заболевание суставов бактериальной, вирусной, паразитарной или грибковой этиологии. Инфекционный артрит может поражать различные суставы и, кроме местных проявлений (опухания, гиперемии, болезненности, ограничения движения в суставе), сопровождается ярко выраженной общей симптоматикой (лихорадкой, ознобами, интоксикационным синдромом). Диагностика инфекционного артрита основана на данных рентгенографии, УЗИ, артроцентеза, исследования синовиальной жидкости, бакпосева крови. Лечение инфекционного артрита включает иммобилизацию и лаваж сустава, системное и внутрисуставное введение антибиотиков, при необходимости – выполнение артроскопической санации или артротомии.
Общие сведения
Инфекционный артрит – группа артритов, вызываемых инфекционными возбудителями (вирусами, бактериями, грибами, простейшими), проникающими непосредственно в ткани сустава. В ревматологии и травматологии артриты, ассоциированные с инфекцией, диагностируются в каждом третьем случае. Инфекционный артрит чаще поражает суставы нижних конечностей, испытывающие большую весовую нагрузку (коленные, тазобедренные, голеностопные), а также суставы кистей рук. Инфекционные артриты регистрируются у представителей различных возрастных групп: новорожденных, детей дошкольного и школьного возраста, взрослых.
Согласно этиологическому принципу, инфекционные артриты делятся на бактериальные, вирусные, грибковые, паразитарные. С учетом нозологической принадлежности различают септический (пиогенный, гнойный), гонорейный, туберкулезный, сифилитический, бруцеллезный и другие виды артритов. Ввиду особенностей возникновения в отдельную группу выделяются посттравматические артриты.
При попадании инфекции в суставные ткани извне говорят о первичном артрите. В случае распространения инфекционного процесса на сустав из окружающих тканей или отдаленных гнойных очагов развивается вторичный артрит. Течение инфекционных артритов может быть острым, подострым и хроническим. Поражение суставов может происходить по типу моно-, олиго- или полиартрита.
Инфекционный артрит
Причины
«>
Чаще всего при инфекционных артритах имеет место метастатический путь поражения суставов, т. е. проникновение инфекции в полость сустава гематогенным или лимфогенным путем, в результате чего возбудитель заболевания может быть обнаружен в синовиальной жидкости. Также возможен прямой путь инфицирования, например, при открытых ранениях и травмах сустава, а также диссеминации микроорганизмов из близко расположенных очагов остеомиелита.
У новорожденных и детей младшего возраста бактериальные артриты чаще вызываются стафилококком, энтеробактериями, гемолитическим стрептококком, гемофильной палочкой. У взрослых пациентов, наряду с аэробами, частыми возбудителями инфекционного артрита являются анаэробные микроорганизмы: пептострептококки, фузобактерии, клостридии, бактероиды. Острые бактериальные артриты могут возникнуть на фоне ангины, синусита, пневмонии, фурункулеза, пиелонефрита, инфекционного эндокардита, сепсиса. Кроме этого, встречаются специфические инфекционные артриты, обусловленные туберкулезом, сифилисом, гонореей и др.
Грибковые артриты, как правило, ассоциированы с актиномикозом, аспергиллезом, бластомикозом, кандидозом. Паразитарные артриты обычно связаны с глистными и протозойными инвазиями. Вирусные артриты встречаются при краснухе, эпидемическом паротите, вирусном гепатите В и С, инфекционном мононуклеозе и др. Посттравматические инфекционные артриты в большинстве случаев развиваются вследствие перенесенных проникающих травм суставов. Не исключается ятрогенное инфицирование при проведении лечебно-диагностической пункции сустава, внутрисуставных инъекций, артроскопии или эндопротезирования.
К категории лиц, имеющих повышенный риск развития инфекционного артрита, относятся пациенты, страдающие ревматоидным артритом, остеоартрозом, ИППП, алкогольной или наркотической зависимостью, иммунодефицитными состояниями, сахарным диабетом, ожирением, авитаминозами; испытывающие значительные физические (в т. ч. спортивные) нагрузки и пр.
Симптомы инфекционного артрита
Инфекционные артриты, вызванные неспецифической микрофлорой (стафилококками, стрептококками, синегнойной палочкой и др.), имеют острое начало с выраженными локальными и общими проявлениями. Местные признаки гнойного артрита включают резкую боль в покое, при пальпации, активных и пассивных движениях; нарастающую припухлость, изменение контуров сустава; местное покраснение и повышение температуры кожи. Следствием гнойно-воспалительной реакции служит нарушение функции конечности, которая принимает вынужденное положение. В большинстве случаев при остром инфекционном артрите развивается общая симптоматика – лихорадка, озноб, миалгия, потливость, слабость; у детей – тошнота и рвота.
Септический артрит обычно протекает в форме моноартрита коленного, тазобедренного или голеностопного сустава. Полиартриты обычно развиваются у лиц, получающих иммуносупрессивную терапию или страдающих суставной патологией. У наркозависимых пациентов часто отмечается поражение суставов осевого скелета, главным образом, сакроилеит. Инфекционный артрит, вызванный золотистым стафилококком, может привести к разрушению суставных хрящей буквально за 1-2 дня. При тяжелом течении гнойного артрита возможно развитие остеоартрита, септического шока и летальный исход.
Для инфекционного артрита гонококковой этиологии характерен кожно-суставной синдром (периартрит-дерматит), характеризующийся множественными высыпаниями на коже и слизистых (петехиями, папулами, пустулами, геморрагическими везикулами и др.), мигрирующими артралгиями, теносиновитами. При этом симптомы первичной урогенитальной инфекции (уретрита, цервицита) могут быть стертыми или вовсе отсутствовать. При гонорейном артрите чаще поражаются суставы кистей рук, локтевой, голеностопный, коленный суставы. Характерными осложнениями служат плоскостопие, деформирующий остеоартроз. Сифилитический артрит протекает с развитием синовита коленных суставов, сифилитического остеохондрита и дактилита (артрита пальцев рук).
Туберкулезный артрит имеет хроническое деструктивное течение с поражением крупных (тазобедренного, коленного, голеностопного, лучезапястного) суставов. Изменения суставных тканей развиваются в течение нескольких месяцев. Течение заболевания связано с местным синовитом и общей туберкулезной интоксикацией. Подвижность пораженного сустава ограничена болезненностью и мышечными контрактурами. При вовлечении в воспалительный процесс периартикулярных тканей могут возникать «холодные» абсцессы.
Артрит, ассоциированный с бруцеллезом, протекает на фоне симптомов общего инфекционного заболевания: волнообразной лихорадки, ознобов, проливных потов, лимфаденита, гепато- и спленомегалии. Характерны кратковременные миалгии и артралгии, развитие спондилита и сакроилеита.
Вирусные артриты обычно отличаются кратковременным течением и полной обратимостью происходящих изменений, без остаточных явлений. Отмечаются мигрирующие артралгии, припухлость суставов, болезненность движений. Длительность течения вирусного артрита может составлять от 2—3 недель до нескольких месяцев. Грибковый артрит часто сочетается с микотическим поражением кости. Заболевание характеризуется длительным течением, образованием свищей. В исходе инфекционного артрита грибковой этиологии может развиваться деформирующий остеоартроз или костный анкилоз сустава.
Диагностика
В зависимости от этиологии инфекционного артрита, пациенты могут нуждаться в консультации и наблюдении хирурга, травматолога, ревматолога, фтизиатра, инфекциониста, венеролога. В числе первоочередных мероприятий для установления диагноза выполняется УЗИ и рентгенография пораженных суставов. Рентгенологически при инфекционном артрите определяется остеопороз, сужение суставной щели, костный анкилоз, костные эрозии. Ультразвуковая диагностика выявляет изменения периартикулярных тканей, наличие внутрисуставного выпота. На ранних стадиях, когда рентгенографические признаки инфекционного артрита еще не обнаруживаются, могут использоваться более чувствительные методы – КТ сустава, МРТ, сцинтиграфия.
Важное значение для верификации этиологического фактора имеют данные диагностической пункции сустава, исследование синовиальной жидкости (микроскопия, цитология, посев на среды). Большую диагностическую ценность в определенных случаях представляют иммуноферментный анализ, бактериологическое исследование крови и отделяемого уретры, обзорное исследование мазков из половых путей. Установлению диагноза туберкулезного артрита способствует биопсия синовиальной оболочки сустава, обнаружение в организме других туберкулезных очагов, положительные туберкулиновые пробы. Инфекционный артрит дифференцируют с ревматоидным, подагрическим артритом, гнойным бурситом, остеомиелитом.
Лечение инфекционного артрита
В острой стадии лечение инфекционного артрита проводится стационарно. Осуществляется иммобилизация конечности на короткий срок с последующим постепенным расширением двигательного режима сначала за счет пассивных, затем – активных движений в суставе. В том случае, если произошло инфицирование протезированного сустава, проводится удаление эндопротеза. При гнойном артрите выполняется ежедневный артроцентез, лаваж сустава, по показаниям – артроскопическая санация сустава или артротомия с проточно-аспирационным промыванием.
Лекарственная терапия инфекционного артрита включает парентеральное назначение антибиотиков с учетом чувствительности выявленного возбудителя (цефалоспорины, синтетические пенициллины, аминогликозиды), дезинтоксикационные мероприятия. При вирусных артритах назначаются НВПС, при грибковой инфекции — антимикотические препараты, при туберкулезном артрите – специфические химиопрепараты. После купирования острых воспалительных явлений для восстановления функции сустава проводится комплекс ЛФК и физиотерапевтического лечения, бальнеотерапии, массажа.
Прогноз и профилактика
У трети больных, перенесших инфекционный артрит, отмечаются остаточные явления в виде ограничения подвижности суставов, контрактур, анкилозов. Септические артриты представляют серьезную угрозу: несмотря на возможности терапевтического и хирургического лечения, летальность при осложненном течении достигает 5-15%. К числу неблагоприятных прогностических факторов относятся ревматоидный артрит, септицемия, пожилой возраст, иммунодефицитные состояния. Профилактика артрита включает своевременную терапию общих инфекционных заболеваний, адекватные физические нагрузки, предупреждение травм суставов, защиту от ИППП, соблюдение требований асептики и антисептики при проведении хирургических манипуляций.
Источник

- Главная
- Статьи
- Науки о жизни
- Другие науки о жизни
- Ревматоидный артрит и микробы
07
Февраля
2018
Медики напали на след виновника ревматоидного артрита
Полит.ру
Исследователи из Университета Центральной Флориды установили связь между определенным видом бактерий, попадающим в организм человека из молока или мяса, и заболеванием ревматоидным артритом (Bacteria found in milk and beef linked to rheumatoid arthritis).
Ревматоидный артрит относится к аутоиммунным болезням. Лимфоциты человека начинают нападать не на проникшие в организм патогены, а на собственные клетки, что приводит к воспалению. Выделяемый клетками иммунной системы интерлейкин-1 активирует остеокласты – клетки, которые должны разрушать костную ткань. Они начинают разрушать часть головок костей, лежащую непосредственно под суставным хрящом и питающую его. Постепенно в суставе разрастается ткань особого типа, разрушающая как хрящ, так и поверхность кости.
В результате у человека опухают и болят суставы, затем они деформируются, затрудняя движения. Точные причины ревматоидного артрита неизвестны, но предполагается, что важным фактором, запускающим болезнь, может быть инфекция. Подобное явление отмечено для других аутоиммунных заболеваний.
Ученые рассматривают разных кандидатов на роль первоначальной причины ревматоидного артрита. В основном это различные виды вирусов. Но в новом исследовании впервые отмечена связь ревматоидного артрита с бактерией Mycobacterium avium ssp. paratuberculosis. Эта бактерия часто встречается у крупного рогатого скота, например, в США ею заражены около половины коров. Недавнее исследование показало связь этой бактерии с тяжелым заболеванием пищеварительной системы – болезнью Крона.
Поскольку болезнь Крона и ревматоидный артрит имеют общие генетические предрасположенности и часто лечатся с использованием тех же самых типов иммунодепрессантов, исследователь из Школы биомедицинских наук Университета Центральной Флориды Салех Насер (Saleh Naser) и его коллеги заподозрили, что и вызывать эти болезни может одна и та же бактерия.
Они изучили 100 пациентов с ревматоидным артритом и обнаружили, что у 78 % из них есть та же мутация в гене PTPN2 / 22, что и у тех, кто страдает болезнью Крона, при этом 40 % этих людей были заражены Mycobacterium avium ssp. paratuberculosis. Ученые считают, что данная мутация в сочетании с дальнейшим заражением бактерией из пищи значительно повышает риск ревматоидного артрита.
Исследование опубликовано в журнале Frontiers in Cellular and Infection Microbiology.
Портал «Вечная молодость» https://vechnayamolodost.ru
назад
Читать также:
14
Декабря
2017
Что такое полиартрит?
Полиартрит – это воспаление четырех и более суставов. Термин состоит из двух греческих слов: «poly» – много и «arthron» – сустав.
читать
04
Февраля
2013
Мезенхимальные клетки-предшественники в терапии ревматоидного артрита
Австралийская компания Mesoblast Limited получила разрешение на проведение II фазы клинического исследования препарата мезенхимальных клеток-предшественников в терапии ревматоидного артрита.
читать
04
Сентября
2012
Ревматоидный артрит в глобальном масштабе
К 2015 году количество больных ревматоидным артритом вырастет на 75% по сравнению с 2005-м. И это при том, что в мире этот диагноз уже поставлен 21 миллиону человек.
читать
03
Декабря
2009
Генетически модифицированные Т-лимфоциты для терапии артрита
После введения генетически модифицированных лимфоцитов мышам с артритом в очагах ревматоидного воспаления наблюдалось уменьшение количества T-хелперов и разрушительных процессов костной ткани, т.е. снижение аутоиммунной реакции.
читать
28
Января
2009
Генотерапия при ревматоидном артрите: проверено на людях
Соскобы ткани из суставов двух пожилых пациенток, страдающих тяжелым артритом, инфицировали ретровирусом со встроенным геном белка, блокирующего действие интерлейкина-1. Затем экспериментаторы размножили захваченные вирусом клетки и вновь подсадили их в суставы пациенток. Уже через 4 недели обе женщины почувствовали себя лучше.
читать
Источник
Для цитирования: Белов Б.С. Бактериальные (септические) артриты // РМЖ. 2004. №20. С. 1137
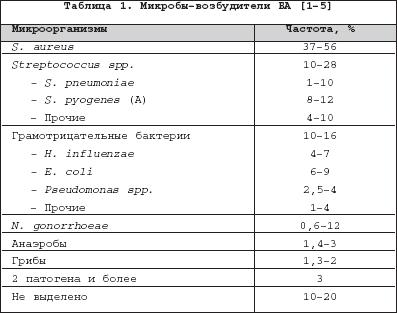
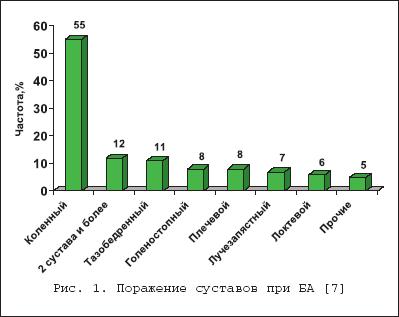
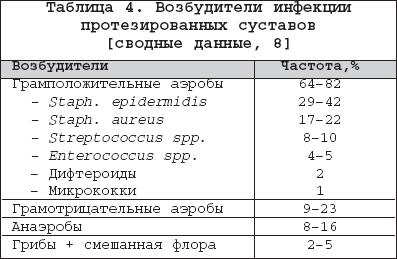
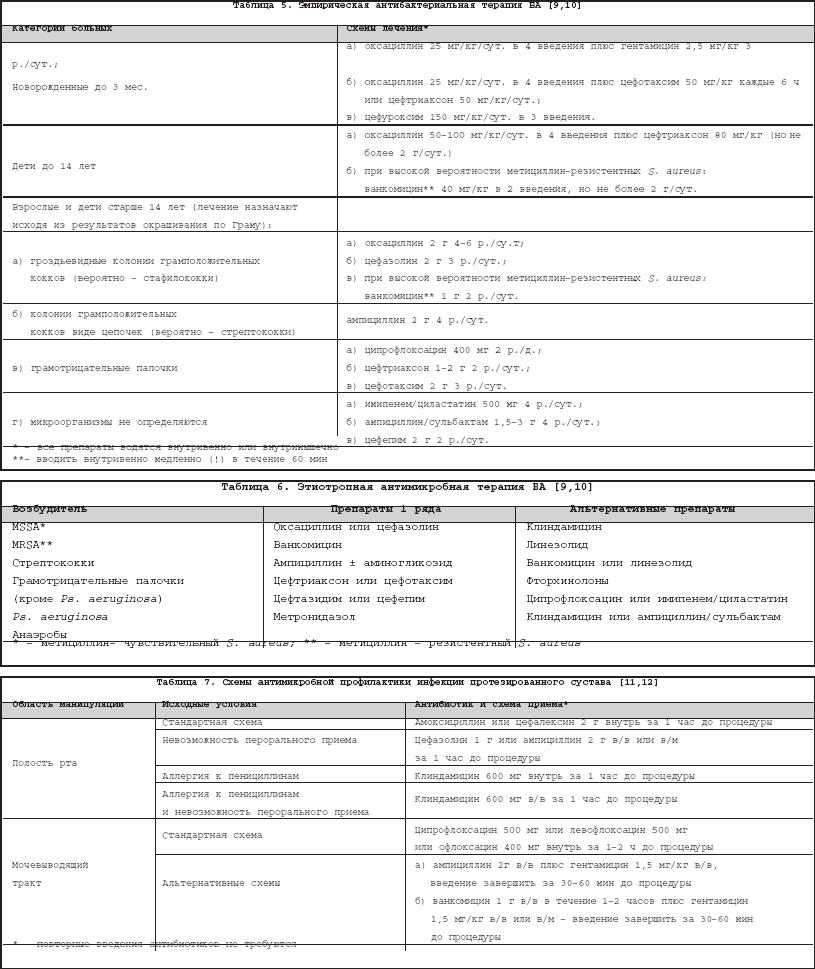
Бактериальный (септический) артрит (БА) представляет собой быстропрогрессирующую патологию, обусловленную непосредственной инвазией сустава гноеродными микроорганизмами 1 . Заболевание встречается повсеместно. Поражаются преимущественно дети и лица старше 60 лет. Ежегодная частота БА составляет 2–10 случаев на 100 000 населения , а среди больных ревматоидным артритом (РА) и реципиентов клапанных протезов эти значения достигают 30–70 на 100 000. Несмотря на обширный арсенал разработанных и внедренных в клиническую практику антимикробных средств и интенсивное развитие хирургической технологии, необратимая утрата функции сустава развивается у 25–50% больных. Частота летальных исходов при БА существенно не изменилась за последние 25 лет и составляет 5–15% [1]. Этиология Теоретически все известные бактерии могут вызвать БА (табл. 1). Самым распространенным этиологическим агентом БА является S. aureus , на долю которого приходится до 80% случаев инфекций суставов у больных РА и сахарным диабетом. Данный патоген также является основным при инфекционном коксите и полиартикулярных вариантах БА. На втором месте по частоте выделения у больных БА находятся стрептококки (в первую очередь, ? –гемолитический стрептококк группы А), которые, как правило, ассоциируются с фоновыми аутоиммунными заболеваниями, хронической инфекцией кожи и предшествующей травмой. Встречаемость S. pneumoniae в качестве возбудителя БА в последние годы существенно снизилась. Стрептококки других групп (B,G, C и F – в порядке убывания) выделяются при БА у больных с иммунной недостаточностью, злокачественными новообразованиями, а также инфекционной патологией пищеварительного и урогенитального тракта. Грамотрицательные палочки – причина БА у пожилых больных, наркоманов, вводящих наркотики внутривенно, а также у больных с иммунодефицитом. Анаэробы в качестве возбудителей БА чаще фигурируют у реципиентов суставных протезов, лиц с глубокими инфекциями мягких тканей и больных сахарным диабетом. Наиболее значимые этиологические агенты БА среди детей – S. aureus и Str . pyogenes . Роль H. influenzae , ранее встречавшейся достаточно часто при БА у детей, в последние годы значительноуменьшилась в связи с широким внедрением специфической вакцины. В то же время ряд исследователей отмечают рост встречаемости при БА грамотрицательной палочки K. kingae , являющейся нормальным обитателем ротовой полости у детей до 2 лет [6]. В таблице 2 суммированы данные о наиболее часто встречающихся возбудителях БА в зависимости от категорий больных. Патогенез В норме суставные ткани стерильны, что обеспечивается успешным функционированием фагоцитов синовиальной мембраны и синовиальной жидкости (СЖ). Для развития БА необходимо наличие ряда «факторов риска», зависящих как от состояния макроорганизма (в первую очередь – противоинфекционного иммунитета и суставного статуса), так и микроба–патогена (вирулентность, экспозиция, объем инокулята и т.д.). Основные факторы, предрасполагающие к развитию БА, представлены в таблице 3. Одним из наиболее значимых аспектов возникновения БА является ослабление естественных защитных сил макроорганизма, обусловленное сопутствующими заболеваниями, иммуносупрессией, возрастом пациентов. Немаловажное значение придается фоновой суставной патологии, проводимой терапии, а также возможным осложнениям последней. В частности, при РА вероятность возникновения БА нарастает в связи с назначением глюкокортикостероидов (в т.ч. внутрисуставно), цитотоксических иммунодепрессантов, а также моноклональных антител к фактору некроза опухоли– ? (инфликсимаб). Проникновение возбудителя в сустав может происходить несколькими путями. 1. Гематогенная диссеминация при транзиторной или стойкой бактериемии, как следствие отдаленных первичных очагов инфекции (пневмония, пиелонефрит, пиодермия и т.д.). 2. Лимфогенное распространение из близлежащих к суставу очагов инфекции. 3. Ятрогенный путь при проведении артроцентеза или артроскопии. 4. Проникающие травмы , вызванные шипами растений, иными загрязненными предметами. Инвазия бактерии в сустав сопровождается активным воспалительным клеточным ответом и выходом клеток, участвующих в воспалении, в полость сустава. В дальнейшем под влиянием продуктов жизнедеятельности бактерий происходит стимуляция иммунного ответа и высвобождение разнообразных медиаторов воспаления. Накопление провоспалительных цитокинов и продуктов аутолиза фагоцитов – протеаз влечет за собой торможение синтеза хряща и его деградацию с последующей деструкцией хрящевой и костной ткани и формированием костного анкилоза. Клиническая картина Как правило, БА характеризуется острым началом с интенсивной болью, припухлостью, гиперемией кожи и гипертермией пораженного сустава. В большинстве случаев (60–80%) имеет место лихорадка. Однако температура тела может быть субфебрильной и даже нормальной, что чаще встречается при поражении тазобедренных и крестцово–подвздошных суставов, на фоне активной противовоспалительной терапии по поводу основного заболевания, а также у больных пожилого возраста. В 80–90% случаев поражается единственный сустав (чаще – коленный или тазобедренный) (рис. 1). Развитие инфекционного процесса в суставах кистей в основном имеет травматический генез (проникающие колотые раны или укусы). Олиго– или полиартикулярный тип поражения чаще наблюдается при развитии БА у больных РА, системными поражениями соединительной ткани, а также у наркоманов, вводящих наркотики внутривенно. Помимо этого, у «внутривенных» наркоманов БА характеризуется более медленным началом, длительным течением и частым поражением синдесмозов туловища (крестцово–подвздошные и грудино–ключичные сочленения, лонное сращение). У маленьких детей единственным проявлением бактериального коксита может быть резкая боль при движении с фиксацией тазобедренного сустава в положении сгибания и наружной ротации. В отличие от гонококкового артрита для БА несвойственно поражение околосуставных мягких тканей. Диагностика При анализепериферической крови у больных БА выявляют лейкоцитоз со сдвигом лейкоцитарной формулы влево и значительное повышение СОЭ. Основу диагностики БА составляет развернутый анализ СЖ , полученной с помощью пункционной аспирации из пораженного сустава (при этом в максимально возможной степени необходимо удалить выпот). Для определенного диагноза БА требуется идентификация бактерий в СЖ. Посев ее производится на среды для аэробных и анаэробных микробов и должен быть выполнен сразу же после взятия (у постели больного). С целью получения предварительной информации о возбудителе и назначения эмпирической антибактериальной терапии необходимо окрашивание мазков по Граму, при этом эффективность исследования увеличивается посредством предварительного центрифугирования СЖ. Диагностическая эффективность данной методики составляет 75% и 50% при инфицировании грамположительными кокками и грамотрицательными палочками, соответственно. Визуально СЖ при БА имеет гнойный характер, серовато–желтого или кровянистого цвета, интенсивно мутная, густая, с большим аморфным осадком. При подсчете лейкоцитов уровень цитоза часто превышает таковой при других воспалительных заболеваниях (РА, подагрический артрит, реактивные артриты) и составляет >50 000/мм 3 , нередко более 100 000/мм 3 с преобладанием нейтрофилов (>85%). В СЖ также отмечается низкое содержание глюкозы, составляющее менее половины от ее сывороточной концентрации, и высокий уровень молочной кислоты. Посевы крови на гемокультуру дают положительные результаты в 50% случаев. Рентгенография сустава входит в число первоочередных диагностических мероприятий, поскольку она позволяет исключить сопутствующий остеомиелит и определиться с дальнейшей тактикой обследования и лечения больного. Однако следует отметить, что отчетливые изменения на рентгенограммах при БА (остеопороз, сужение суставной щели, краевые эрозии) появляются примерно на 2–й неделе от начала заболевания. Применение методик радиоизотопного сканирования с технецием, галлием или индием особенно важно в тех случаях, когда исследуемый сустав располагается глубоко в тканяхили труднодоступен для пальпации (тазобедренные, крестцово–подвздошные). Эти методы также помогают выявить изменения, присущие БА, на ранних стадиях процесса, т.е. в течение первых двух суток, когда рентгенологические изменения еще отсутствуют. На компьютерных томограммах деструктивные изменения костной ткани выявляются значительно раньше, чем на обзорных рентгенограммах. Данный метод наиболее информативен при поражении крестцово–подвздошных и грудино–ключичных сочленений. Магнитно–резонансное исследование позволяет выявить на ранних стадиях заболевания отек мягких тканей и выпот в полость сустава, а также остеомиелит. Дифференциальный диагноз Дифференциальную диагностику БА надо проводить со следующими заболеваниями, проявляющимися острым моноартритом: – острый подагрический артрит; – псевдоподагра; – ревматоидный артрит; – вирусные артриты; – серонегативные спондилоартриты; – лайм–боррелиоз. Необходимо отметить, что инфекция сустава является одной из немногих неотложных ситуаций в ревматологии, требующей быстрой диагностики и интенсивного лечения, что позволяет избежать необратимых структурных изменений. Поэтому существует правило – расценивать каждый острый моноартрит как инфекционный, пока не доказано обратное . Инфекции протезированного сустава Частота инфицирования суставных протезов составляет 0,5–2%. Среди возбудителей преобладают стафилококки (в первую очередь – коагулазонегативные), стрептококки, грамотрицательные аэробы и анаэробы (табл. 4). Ранние формы инфекций суставного протеза (до 3 мес. после имплантации) вызываются преимущественно эпидермальными стафилококками и развиваются по причине послеоперационной контаминации или вследствие контактного распространения из инфицированной кожи, подкожных тканей, мышц или послеоперационной гематомы. Поздние формы возникают при инфицировании другими микробами, представленными в таблице 4, и обусловлены гематогенным путем диссеминации. К основным факторам риска поражения протезированных суставов относят: иммунодефицитные состояния, РА, повторные операции на суставе, длительное по времени оперативное вмешательство, протезирование поверхностно расположенных суставов (локтевой, плечевой, голеностопный). Начало заболевания может быть острым или подострым в зависимости от вирулентности возбудителя. Появляется боль (95%), лихорадка (43%), припухлость сустава (38%), отток гнойного отделяемого по дренажу (32%). Данная симптоматика в сочетании с рентгенографическими признаками разрушения костной ткани вблизи протеза всегда свидетельствует об инфицировании. Разграничение хирургической инфекции кожи от гнойного поражения суставного протеза нередко вызывает большие трудности. Окончательный диагноз ставится по данным анализов крови, исследования аспирата из полости искусственого сустава и/или костного биоптата, взятого вблизи области соединения цемента с протезом. Лечение Лечение БА – комплексное, включающее антимикробную и симптоматическую терапию, дренаж инфицированной СЖ и лечебную физкультуру. Антимикробная терапия проводится в течение первых 1–2 суток эмпирически с учетом возраста больного, клинической картины заболевания и результатов исследования мазков СЖ по Граму, в дальнейшем – с учетом выделенного возбудителя и его чувствительности к антибиотикам (табл. 5, 6). Антибиотики следует вводить преимущественно парентерально, внутрисуставное их применение нецелесообразно. Отсутствие позитивной динамики через 2 суток диктует необходимость смены антибиотика. Сохраняющаяся ускоренная СОЭ служит показанием к продлению сроков лечения, которое в среднем составляет 3–4 нед. (иногда до 6 нед.), но не менее 2 нед. после ликвидации всех признаков заболевания. Дополнительно к антимикробной терапии назначают анальгетики и нестероидные противовоспалительные препараты (диклофенак, кетопрофен и др.). Дренаж инфицированного сустава производят (иногда по несколько раз в день) методом закрытой аспирации через иглу. С целью оценки эффективности лечения каждый раз выполняют подсчет лейкоцитов, окрашивание по Граму и посевы СЖ. Открытое хирургическое дренирование инфицированного сустава осуществляют при наличии следующих показаний [7]: – инфицирование тазобедренного и, возможно, плечевого сустава; – остеомиелит позвонков, сопровождающийся сдавлением спинного мозга; – анатомические особенности, затрудняющие дренирование сустава (например, грудино–ключичное сочленение); – невозможность удаления гноя при закрытом дренировании через иглу из–за повышенной вязкости содержимого или спаечного процесса в полости сустава; – неэффективность закрытой аспирации (персистенция возбудителя или отсутствие снижения лейкоцитоза в синовиальной жидкости); – протезированные суставы; – сопутствующий остеомиелит, требующий проведения хирургического дренирования; – артрит, развившийся вследствие попадания инородноготела в суставную полость; – позднее начало терапии (более 7 дней). В течение первых двух суток сустав иммобилизируют. Начиная с 3–го дня болезни, осуществляют пассивные движения в суставе. К нагрузкам и/или активным движениям в суставе переходят после исчезновения артралгии. Лечение инфицированного протезированного сустава осуществляют следующим образом: 1. Одномоментная артропластика с иссечением инфицированных тканей, установкой нового протеза и последующим 6–недельным курсом антибиотикотерапии (ванкомицин + амикацин; ванкомицин + цефепим/цефтазидим; оксациллин + рифампицин). 2. Иссечение протезных компонентов , загрязненных участков кожи и мягких тканей с последующей парентеральной антимикробной терапией в течение 6 нед. После этого осуществляется реимплантация сустава с продолжением антибиотикотерапии в течение 5 дней. Профилактика Вероятность инфицирования протезированного сустава значительно возрастает во время бактериемии, возникающей при стоматологических и урологических манипуляциях. В связи с этим экспертами Американской ортопедо–хирургической академии, Американской стоматологической ассоциации и Американской урологической ассоциации разработаны схемы антибиотикопрофилактики для лиц с высоким риском развития инфекции суставного протеза [11,12]. Профилактике подлежат все реципиенты суставных протезов в течение первых двух лет после операции, больные с иммуносупрессией, обусловленной фоновым заболеванием (РА, системная красная волчанка) или лекарственной/лучевой терапией, а также пациенты с отягощающей сопутствующей патологией (перенесенная инфекция суставного протеза, гемофилия, ВИЧ–инфекция, инсулин–зависимый диабет I типа, злокачественные новообразования) при выполнении у них ряда стоматологических вмешательств, включающих экстракцию зуба, манипуляции на периодонте, установку имплантантов и т.д. Вышеуказанные категории больных также должны получать профилактику при разнообразных манипуляциях, связанных с возможным нарушением целостности слизистой мочевыводящего тракта (литотрипсия, эндоскопия, трансректальная биопсия простаты и т.д.) Схемы антимикробной профилактики представлены в таблице 7.
Литература
1. Goldenberg DL. Septic arthritis. Lancet. 1998;351(9097):197–202.
2. Weston VC, Jones AC, Bradbury N, Fawthrop F, Doherty M. Clinical
features and outcome of septic arthritis in a single UK Health
District 1982–1991. Ann Rheum Dis. 1999; 58(4):214–219.
3. Dubost JJ, Soubrier M, De Champs C, Ristori JM, Bussiere JL,Sauvezie B. No changes in the distribution of organisms responsible
for septic arthritis over a 20 year period. Ann Rheum Dis. 2002;
61(3):267–269.
4. Kaandorp CJ, Dinant HJ, van de Laar MA, Moens HJ, Prins AP,
Dijkmans BA. Incidence and sources of native and prosthetic joint
infection: a community based prospective survey. Ann Rheum Dis. 1997;
56(8): 470–475.
5. Shirtliff ME, Mader JT. Acute septic arthritis. Clin Microbiol
Rev. 2002; 15(4): 527–544.
6. Lahmann J.D., Lahmann S.J. Etiology of septic arthritis in children:
an update for the 1990s. Pediatr. Emerg. Care. 1999; 15: 40–42.
7. Gilliard W.R. Бактериальные (септические) артриты. В кн. Вест С.Д.
Секреты ревматологии. /Пер. с англ. М., СПб.– «Издательство Би-
ном»–»Невский диалект», 1999. 331–341.
8. Urban J.A., Garvin K.L. Prosthetic joint infections. Curr. Treat.
Opt. Infect. Dis. 2003; 5: 309–321.
9. Rao N. Septic arthritis. Curr. Treat. Opt. Infect. Dis. 2002; 4:
279–287.
10. Trampuz A., Steckelberg J.M. Septic arthritis. Curr. Treat. Opt.
Infect. Dis. 2003; 5: 337–344.
11. Antibiotic prophylaxis for dental patients with total joint
replacements. JADA. 2003; 134:895–898.
12. Antibiotic prophylaxis for urological patients with total joint
replacements. J. Urology 2003; 169 (5): 1796–1797.
Поделитесь статьей в социальных сетях
Источник