Клинические случаи ревматоидного артрита
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
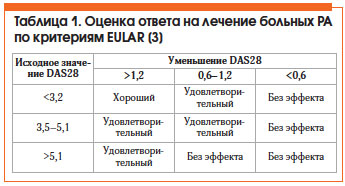
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

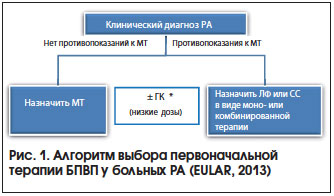
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
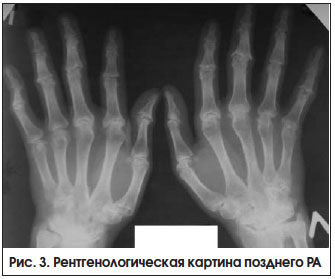
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
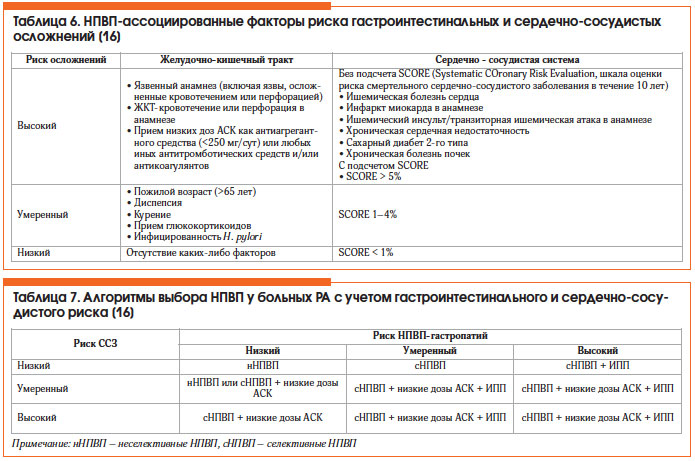
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
Выбор тактики лечения больных с ревматоидным артритом (РА) на сегодняшний день связан с концепцией «Лечение до достижения цели», что обуславливает как можно более раннюю и достаточно агрессивную терапию [1].
Известно, что для лечения РА используется широкий спектр препаратов, обладающих противовоспалительной и иммуносупрессивной активностью [2, 3]. Однако, несмотря на рациональное применение синтетических лекарственных средств (базовых противовоспалительных препаратов, БПВП), позволившее существенно улучшить прогноз и отсрочить развитие инвалидности, более чем у половины пациентов с РА не удается надежно контролировать прогрессирование заболевания.
При отсутствии эффекта от традиционной терапии с применением БПВП и сохранении высокой активности иммуновоспалительного процесса больным РА назначаются генно-инженерные биологические препараты (ГИБП) [4]. Перечень ГИБП постоянно расширяется, однако наиболее изученными и чаще всего используемыми в клинической практике остаются ингибиторы фактора некроза опухоли-α (ФНО-α) — основного цитокина, определяющего развитие иммуновоспалительного процесса и костных деструкций при РА, а также анти-В-клеточные моноклональные антитела против антигена CD20, находящегося на поверхности зрелых В-лимфоцитов (ритуксимаб). К препаратам, блокирующим стимуляцию Th1-лимфоцитов путем связывания молекул CD80/86, находящихся на поверхности антигенпрезентирующих клеток, которые взаимодействуют с рецепторами CD28 Т-лимфоцитов, относится абатацепт. Также применяется гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 — тоцилизумаб [4, 9, 11].
Несмотря на высокую клиническую эффективность ГИБП у пациентов с тяжелым РА, опыт длительного применения этих препаратов в реальной клинической практике свидетельствует, что 30% пациентов рефрактерны к этой терапии [9].
Следует подчеркнуть, что и синтетические БПВП, и ГИБП в равной степени способны токсически воздействовать на различные системы организма, включая сердечно-сосудистую, гепатобилиарную, вызывая развитие тяжелых состояний, что является существенным ограничением для применения данного вида терапии [1, 4].
Больная С., 59 лет, с апреля 2010 г. наблюдается в ревматологическом отделении клиники СЗГМУ им. И. И. Мечникова. На основании критериев ACR (1987 г.) верифицирован РА высокой степени активности (DAS28 = 5,8). Показатели функции печени на тот момент находились в пределах нормальных значений. Проведена пульс-терапия высокими дозами глюкокортикоидов и цитостатиков с улучшением, базисная терапия лефлуномидом 20 мг в сутки совместно с глюкокортикоидами (метилпреднизолон 12 мг в сутки). От приема метотрексата решено воздержаться в связи с имеющимся участком фиброателекталаза S5 правого легкого и участков локального пневмофиброза обоих легких.
В августе 2010 г. активность РА высокая (DAS28 = 6,4), впервые отмечается повышение уровня печеночных ферментов до 7–8 норм, прием лефлуномида отменен.
С ноября 2010 г. начата ГИБП — препаратом выбора стал тоцилизумаб (моноклональное антитело к рецептору интерлейкина-6). После первых трех инфузий лабораторная активность заболевания остается высокой. Параллельно проводилась пульс-терапия, плазмаферез без эффекта, а также начата базисная терапия азатиоприном 100 мг в сутки. В декабре 2010 г. уровень аланинаминотрансферазы (АЛТ) составлял 12 норм, аспартатаминотрансфераза (АСТ) 17 норм, в связи с чем азатиоприн отменен.
В связи со стойкой высокой активностью РА, отсутствием эффекта от неоднократной комбинированной пульс-терапии, инфузий тоцилизумаба, непереносимости базисной терапии лефлуномидом, метотрексатом, в марте 2011 г. начата анти-В-клеточная терапия ритуксимабом. Первые 2 инфузии препарата по 500 мг выполнены без осложнений. После лечения значительного улучшения больная не отмечала, сохранялись боли в суставах, синовиты, длительная утренняя скованность, субфебрильная лихорадка.
В июле 2011 г. активность РА сохраняется высокая (DAS28 = 6,19) и принято решение о переводе больной на биологическую терапию модуляторами Т-клеточной костимуляции — препарат абатацепт. Первое введение без осложнений, показатели функции печени находились на высоком уровне. Пациентке регулярно проводилось обследование на вирусные гепатиты, неоднократно проводилось ультразвуковое исследование (УЗИ) брюшной полости, компьютерная томография (КТ) брюшной полости, но размеры и структура печени находились в пределах нормы.
На фоне терапии абатацептом впервые отмечалось улучшение самочувствия и регресс суставного синдрома. В декабре 2011 г. после пятой инфузии абатацепта уровень печеночных ферментов стабильно высокий и дальнейшее лечение данным препаратом прекращено.
В июле 2012 г. начата базисная терапия циклофосфаном внутримышечно в дозе 200 мг 2 раза в неделю, но попытка однократного введения препарата вызвала тошноту, слабость, головокружение, сердцебиение, кардиалгии, боли в животе. От дальнейшего введения циклофосфана также было решено отказаться. Лабораторное обследование в это время демонстрировало стабильно высокий уровень печеночных ферментов (до 8 норм) при отсутствии повышения уровня билирубина. Для уточнения состояния печени больной проведена эластометрия печени, сцинтиграфия скелета, печени, селезенки, компьютерная томография брюшной полости, расширенное вирусологическое обследование, но патологии не выявлено. На фоне массивного курса гепатопротекторной терапии добиться значимого снижения уровня биохимических показателей не удавалось. В ноябре 2012 г. проведена биопсия печени, по результатам которой обнаружен лобулярный гепатит минимальной степени активности, данных за вирусное поражение не получено. К лечению в это время добавлена урсодезоксихолевая кислота (УДХК) в дозировке 1000 мг в сутки. Все изменения биохимических показателей были расценены как проявления лекарственного токсического гепатита. На фоне приема УДХК в феврале 2013 г. наблюдалась практически полная нормализации уровня ферментов. Обсуждался вопрос о назначении биологической терапии блокаторами ФНО-α (инфликсимаб), но больная отказалась от этого лечения.
До июня 2015 г. пациентка наблюдалась амбулаторно с коррекцией дозы метилпреднизолона (максимально до 16 мг в сутки). От приема базисной терапии, а также терапии биологическими препаратами и проведения пульс-терапии решено воздержаться.
Последнее стационарное обследование в декабре 2015 г. Сохраняется умеренная активность РА (DAS28 — 5,1) и нормальный уровень ферментативной активности печени. Значимых изменений и ухудшений со стороны внутренних органов не выявлено. До настоящего времени для лечения РА больная получает метилпреднизолон 8 мг в сутки, НПВП (рис.).
Данный клинический случай демонстрирует яркий пример неэффективности и развития побочного действия препаратов терапии РА при соблюдении концепции «Лечение до достижения цели».
Преодоление неэффективности остается одной из актуальных проблем клинической ревматологии, в связи с чем разрабатываются лекарственные средства нового поколения для лечения данной патологии [6].
Одним из таких препаратов является тофацитиниб, отличающийся по механизму подавления провоспалительных цитокинов от других ГИБП [5]. Это единственный препарат для перорального приема, блокирующий сигнальные пути цитокинов через систему «янус-киназ» (ЯК, JAK). Сигнализирование с помощью ЯК — основной сигнальный путь для многих важных цитокинов и факторов роста, задействованных в РА, в том числе ФНО-α/β и нескольких интерлейкинов.
На сегодняшний день активность РА у больной сохраняется на высоком уровне, что требует поиска решения проблемы дальнейшей тактики ее ведения. В мае 2016 г. после расширенного комплексного обследования планируется начать терапию с применением ингибиторов янус-киназ (тофацитиниб (Яквинус)) согласно рекомендациям Европейской противоревматической лиги (European League Against Rheumatism, EULAR) 2013 г. [10] совместно с поддерживающей дозой препарата УДХК [7, 8].
Литература
- Smolen J. S. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update // Ann Rheum Dis. 2013; 0: 1–18.
- Мазуров В. И. Современные методы диагностики и лечения ревматических заболеваний // Мед. иммунология. 2001. Т. 3, № 2. С. 187–193.
- Мазуров В. И., Лила А. М., Зоткин Е. Г. Клиническая ревматология. М.: ООО «Изд-во ФОЛИАНТ», 2005. С. 515.
- Насонов Е. Л. Генно-инженерные биологические препараты в лечении ревматоидного артрита / Под ред. академика РАМН Е. Л. Насонова. М.: ООО «ИМА-ПРЕСС», 2013. С. 549.
- Насонов Е. Л, Денисов Л. Н., Станислав М. Л. Новые аспекты фармакотерапии ревматоидного артрита: ингибиторы малых молекул // Научно-практическая ревматология. 2012. № 2. С. 66–75.
- Keystone E. C., Braun J. et al. Update consensus statement on biological agents for the treatment of rheumatic disease, 2011 // Ann Rheum Dis. 2012; 71 Suppl 2: i2–45.
- Федосьина Е. А., Маевская М. В. Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите // РЖГГК. 2010. Т. 20. № 3. С. 29–36.
- Roma M. G., Toledo F. D., Boaglio A. C., Basiglio C. L., Crocenzi F. A., Sánchez Pozzi E. J. Ursodesoxycholic acid in cholestasis: Linking action mechanisms to therapeutic applications // Clin. Sci. (Lond.). 2011. Vol. 121. Р. 523–544.
- Чичасова Н. В. Возможные причины неэффективности генно-инженерных биологических препаратов при ревматоидном артрите и пути ее предотвращения // Современная ревматология. 2012. № 2. С. 31–41.
- Nam J. L., Winthrop K. L., Vollenhoven R. F. Current evidence for the management of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendation for the management of RA // Ann Rheum Dis. 2010; 69: 976–986.
- Saag K. S., Teng G. G., Patkar N. M. et al. American College of Rheumatology 2008 Recommendations for the Use of Nonbiologic and Biologic Disease-Modifying Antirheumatic Drugs in Rheumatoid Arthritis // Arthritis Care & Research. 2008; 59: 762–784.
Е. А. Трофимов, кандидат медицинских наук
А. С. Трофимова1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
1 Контактная информация: bukatsel_anna@mail.ru
Купить номер с этой статьей в pdf
Источник


